名校
解题方法
1 . 为实现“碳中和”“碳达峰”,碳的循环利用是重要措施。利用氢气和CO反应生成甲烷,涉及的反应如下:
i.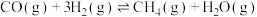

ii.

iii.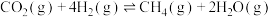

回答下列问题:
(1)在25℃和101kPa下,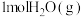 转变为
转变为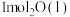 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为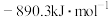 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为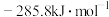 ,则
,则
________  。
。
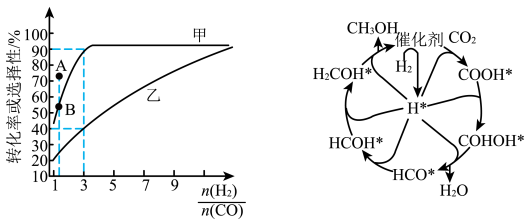
(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及 的选择性随
的选择性随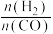 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。 选择性变化的曲线是
选择性变化的曲线是________ (填“甲”或“乙”),保持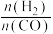 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为________ 。
②相同温度下,向恒容容器内加入 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为________ mol,反应ii的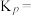
________ (保留小数点后一位)。
(3) 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共________ 种, 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为________ 。
i.
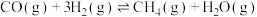

ii.


iii.
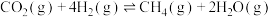

回答下列问题:
(1)在25℃和101kPa下,
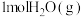 转变为
转变为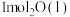 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为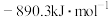 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为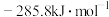 ,则
,则
 。
。(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及
 的选择性随
的选择性随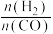 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。
 选择性变化的曲线是
选择性变化的曲线是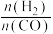 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为②相同温度下,向恒容容器内加入
 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为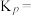
(3)
 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为
您最近一年使用:0次
7日内更新
|
217次组卷
|
7卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
解题方法
2 . 二甲醚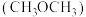 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:
 .
.

 .
.

 .
.

回答下列问题:
(1)
___________ 。
(2)向初始温度为T℃的某恒容绝热容器中投入2mol 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为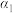 。
。
①下列叙述能说明反应 已经达到平衡的是
已经达到平衡的是___________ (填选项字母)。
a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c. 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率
d. 的体积分数不再发生变化
的体积分数不再发生变化
②相同条件下,若向该容器中加入 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
___________ 1(填“>”“=”或“<”)。
③在催化剂条件下反应 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为___________ (填“第一步”或“第二步”),判断的理由是___________ 。
(3)向压强恒定为p kPa的某密闭容器中按 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。
①图中能表示 随温度变化的曲线是
随温度变化的曲线是___________ (填“ ”或“
”或“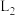 ”),原因为
”),原因为___________ 。
② K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为___________ (保留3位有效数字); K时反应
K时反应 的压强平衡常数
的压强平衡常数
___________  (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
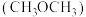 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下: .
.

 .
.

 .
.

回答下列问题:
(1)

(2)向初始温度为T℃的某恒容绝热容器中投入2mol
 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为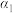 。
。①下列叙述能说明反应
 已经达到平衡的是
已经达到平衡的是a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c.
 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率d.
 的体积分数不再发生变化
的体积分数不再发生变化②相同条件下,若向该容器中加入
 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
③在催化剂条件下反应
 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为
(3)向压强恒定为p kPa的某密闭容器中按
 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。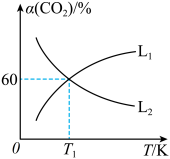
①图中能表示
 随温度变化的曲线是
随温度变化的曲线是 ”或“
”或“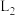 ”),原因为
”),原因为②
 K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为 K时反应
K时反应 的压强平衡常数
的压强平衡常数
 (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
您最近一年使用:0次
2024-05-19更新
|
206次组卷
|
4卷引用:2024届陕西省安康市汉滨区高三下学期联考模拟预测(四)理综试题-高中化学
2024届陕西省安康市汉滨区高三下学期联考模拟预测(四)理综试题-高中化学(已下线)押题卷01(14+4题型)-2024高考化学考点必杀300题(新高考通用)河南省青桐鸣联考2023-2024学年高二下学期3月月考化学试题(已下线)压轴题13?化学反应原理综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
3 . 含硫化合物在能源、材料及环境等工业领域均有广泛的应用。
Ⅰ.工业废气 分解可制取
分解可制取 。
。
(1)已知热化学方程式:
ⅰ.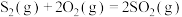

ⅱ.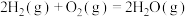

ⅲ.

 热分解反应
热分解反应 的
的
___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)一定温度下,2mol 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为___________  ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
___________ 。
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:
ⅳ.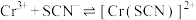
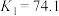
ⅴ.

(3)根据以上络合反应,下列说法正确的有___________(填字母)。
(4)常温下,某研究小组配制了起始浓度 、
、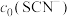 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、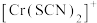 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随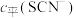 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。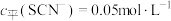 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为___________ ;A点时,溶液中 的平衡浓度为
的平衡浓度为___________ (列出计算式即可)。
②在某电镀工艺中, 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺________ (写出计算过程)。
Ⅰ.工业废气
 分解可制取
分解可制取 。
。(1)已知热化学方程式:
ⅰ.
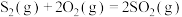

ⅱ.
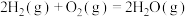

ⅲ.


 热分解反应
热分解反应 的
的
 、
、 、
、 的式子表示)。
的式子表示)。(2)一定温度下,2mol
 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为 ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中
 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:ⅳ.
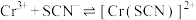
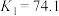
ⅴ.


(3)根据以上络合反应,下列说法正确的有___________(填字母)。
| A.加水稀释后,溶液中离子的总数减少 |
B.加入少量 固体,溶液中含铬微粒总数不变 固体,溶液中含铬微粒总数不变 |
C.反应 的平衡常数 的平衡常数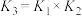 |
D.溶液中 减小, 减小, 与 与 浓度的比值减小 浓度的比值减小 |
(4)常温下,某研究小组配制了起始浓度
 、
、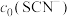 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、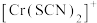 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随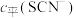 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。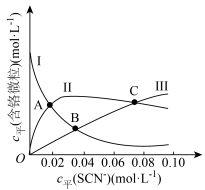
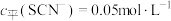 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为 的平衡浓度为
的平衡浓度为②在某电镀工艺中,
 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
您最近一年使用:0次
名校
4 . 某温度下,利用CO2生产甲醇主要涉及以下两个反应。
反应I._______
反应Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
回答下列问题:
(1)已知CO(g)+2H2(g) CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为
CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为_______ ,在_______ 条件下反应I可自发发生。_______ 移动(填“正向”、“逆向”或“不”)。
(3)将1molCO2(g)和3molH2(g)充入密闭容器发生反应I和Ⅱ,并达到平衡状态。相同温度下,在不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性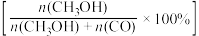 和CO的选择性
和CO的选择性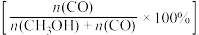 随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是
随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是_______ (填“m”、“n”或“p”),A点时H2的转化率为_______ ,CH3OH的平衡分压为_______ MPa(保留两位有效数字)。 ,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp_______ (填“增大”、“减小”或“不变”)。根据速率方程分析,T>Tm时v逐渐减小的原因是_______ 。
反应I._______
反应Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
回答下列问题:
(1)已知CO(g)+2H2(g)
 CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为
CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为
(3)将1molCO2(g)和3molH2(g)充入密闭容器发生反应I和Ⅱ,并达到平衡状态。相同温度下,在不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性
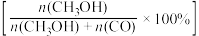 和CO的选择性
和CO的选择性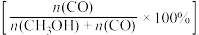 随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是
随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是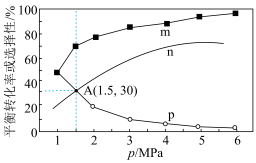
 ,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
您最近一年使用:0次
5 .  (丙烯)是重要基本有机原料。
(丙烯)是重要基本有机原料。 (丙烷)催化脱氢制
(丙烷)催化脱氢制 过程如下:
过程如下:
Ⅰ.主反应: ;
;
Ⅱ.副反应: 。
。
回答下列问题:
(1)已知断裂 下列化学键所需能量如下表:
下列化学键所需能量如下表:
上述主反应的
___________  。
。
(2)一定条件下, 催化脱氢制
催化脱氢制 发生上述Ⅰ、Ⅱ反应,
发生上述Ⅰ、Ⅱ反应, 和
和 的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为
的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为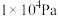 和
和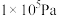 )。
)。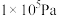 时,图中表示
时,图中表示 和
和 积分数变化的曲线分别为
积分数变化的曲线分别为___________ 、___________ 。
②提高 催化脱氢制
催化脱氢制 的反应平衡转化率的方法是
的反应平衡转化率的方法是___________ (任写一种)。
(3)在压力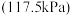 恒定,以
恒定,以 作为稀释气,不同水烃比
作为稀释气,不同水烃比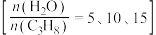 时,
时, 催化脱氢制备
催化脱氢制备 反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。
反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。 平衡转化率相同时,水烃比越高,对应的反应温度越
平衡转化率相同时,水烃比越高,对应的反应温度越___________ (填“高”或“低”)。
②相同温度下,水烃比远大于15:1时,丙烷的消耗速率明显下降,可能的原因是:
ⅰ.丙烷的浓度过低;
ⅱ.___________ 。
③M点对应条件下,若 的选择性为
的选择性为 ,则反应Ⅰ的分压平衡常数
,则反应Ⅰ的分压平衡常数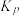 为
为___________ kPa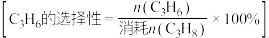 。
。
(4)利用 的弱氧化性,科研人员开发了
的弱氧化性,科研人员开发了 氧化脱氢制
氧化脱氢制 的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。
的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。___________ 。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___________ 。
(5)研究表明, 氧化脱氢制
氧化脱氢制 的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的
的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的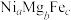 的立方晶胞结构如图4所示。已知晶胞的边长为
的立方晶胞结构如图4所示。已知晶胞的边长为 ,设
,设 为阿伏加德罗常数的值。该晶体密度是
为阿伏加德罗常数的值。该晶体密度是___________  (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
 (丙烯)是重要基本有机原料。
(丙烯)是重要基本有机原料。 (丙烷)催化脱氢制
(丙烷)催化脱氢制 过程如下:
过程如下:Ⅰ.主反应:
 ;
;Ⅱ.副反应:
 。
。回答下列问题:
(1)已知断裂
 下列化学键所需能量如下表:
下列化学键所需能量如下表:| 化学键 |  |  |  |
能量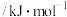 | 436.0 | 413.4 | 344.7 |

 。
。(2)一定条件下,
 催化脱氢制
催化脱氢制 发生上述Ⅰ、Ⅱ反应,
发生上述Ⅰ、Ⅱ反应, 和
和 的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为
的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为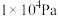 和
和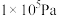 )。
)。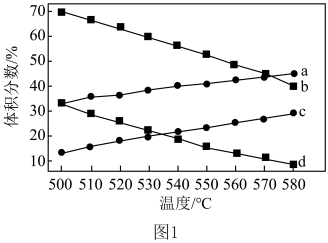
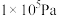 时,图中表示
时,图中表示 和
和 积分数变化的曲线分别为
积分数变化的曲线分别为②提高
 催化脱氢制
催化脱氢制 的反应平衡转化率的方法是
的反应平衡转化率的方法是(3)在压力
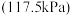 恒定,以
恒定,以 作为稀释气,不同水烃比
作为稀释气,不同水烃比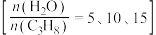 时,
时, 催化脱氢制备
催化脱氢制备 反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。
反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。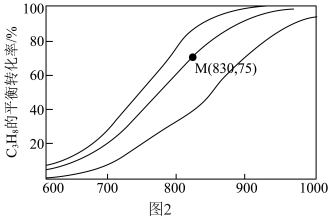
 平衡转化率相同时,水烃比越高,对应的反应温度越
平衡转化率相同时,水烃比越高,对应的反应温度越②相同温度下,水烃比远大于15:1时,丙烷的消耗速率明显下降,可能的原因是:
ⅰ.丙烷的浓度过低;
ⅱ.
③M点对应条件下,若
 的选择性为
的选择性为 ,则反应Ⅰ的分压平衡常数
,则反应Ⅰ的分压平衡常数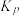 为
为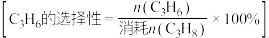 。
。(4)利用
 的弱氧化性,科研人员开发了
的弱氧化性,科研人员开发了 氧化脱氢制
氧化脱氢制 的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。
的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
(5)研究表明,
 氧化脱氢制
氧化脱氢制 的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的
的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的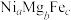 的立方晶胞结构如图4所示。已知晶胞的边长为
的立方晶胞结构如图4所示。已知晶胞的边长为 ,设
,设 为阿伏加德罗常数的值。该晶体密度是
为阿伏加德罗常数的值。该晶体密度是 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024高三·全国·专题练习
6 . 工业上用磷铁渣(主要含FeP、Fe2P,以及少量Fe2O3、SiO2等杂质)制备磷酸铁的工艺流程如下图。已知:①在密闭的反应釜中,硝酸首先分解生成NO2和O2,O2进一步将磷铁渣中的FeP、Fe2P氧化成Fe2O3和P2O5,继而生成Fe(NO3)3和H3PO4;②FePO4难溶于水,可溶于无机强酸。___________ 。
(2)“浸取”时Fe2P与O2反应的化学方程式为___________ 。
(3)“浸取”时设定反应时间为2h,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在1.5~2.0mol·L-1时,磷铁渣溶解率呈现降低的趋势,其原因是___________ 。___________ ;“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及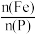 比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,
比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,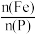 为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,
为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,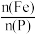 明显增大,其原因是
明显增大,其原因是___________ 。 )为
)为___________ mol·L-1[已知:Ksp(FePO4)=1.3×10-22]。
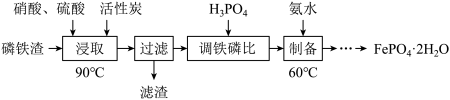
(2)“浸取”时Fe2P与O2反应的化学方程式为
(3)“浸取”时设定反应时间为2h,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在1.5~2.0mol·L-1时,磷铁渣溶解率呈现降低的趋势,其原因是

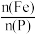 比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,
比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,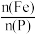 为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,
为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,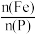 明显增大,其原因是
明显增大,其原因是
 )为
)为
您最近一年使用:0次
名校
解题方法
7 . 水煤气是一种优质燃料和重要的化工原料,其制备方法是将水蒸气与焦炭在高温下混合反应,然后投入固体 进行处理。
进行处理。
I.在温度 下将高温水蒸气通入炽热的焦炭中,其中可能发生的一些反应如下:
下将高温水蒸气通入炽热的焦炭中,其中可能发生的一些反应如下:
(1)已知反应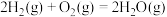 的焓变
的焓变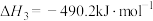 ,近似认为反应焓变不随温度变化,则焦炭的燃烧热
,近似认为反应焓变不随温度变化,则焦炭的燃烧热
______  。
。
(2)在温度 下体系达到化学平衡,将这一时刻记为
下体系达到化学平衡,将这一时刻记为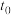 ,然后将可压缩的恒温反应容器突然压缩至原来体积的一半。将压缩之后这一瞬间的时刻记为
,然后将可压缩的恒温反应容器突然压缩至原来体积的一半。将压缩之后这一瞬间的时刻记为 ,重新达到平衡时的时刻记为
,重新达到平衡时的时刻记为 ,则______(填标号)。
,则______(填标号)。
(3)反应②的平衡常数 很小,若近似忽略生成
很小,若近似忽略生成 的反应,在一个体积固定的恒温容器内投入足量焦炭与一定量的水蒸气,在温度
的反应,在一个体积固定的恒温容器内投入足量焦炭与一定量的水蒸气,在温度 下达到平衡时水蒸气的转化率为
下达到平衡时水蒸气的转化率为 ,下图的三条曲线分别代表了达到平衡时不同的转化率
,下图的三条曲线分别代表了达到平衡时不同的转化率 对应的水蒸气分压、
对应的水蒸气分压、 分压、体系的总压,则代表
分压、体系的总压,则代表 分压的曲线是
分压的曲线是______ (填标号)。欲使平衡转化率为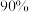 ,则初始充入水蒸气的压强应为
,则初始充入水蒸气的压强应为______  (结果保留两位有效数字)。
(结果保留两位有效数字)。 ,生成
,生成 。除了以外,钙还有多种氧化物。
。除了以外,钙还有多种氧化物。
(4) 在大约
在大约 的高压条件下还可以进一步与
的高压条件下还可以进一步与 反应得到由
反应得到由 和
和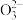 构成的另一种钙的氧化物
构成的另一种钙的氧化物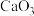 ,预测
,预测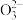 的VSEPR模型名称是
的VSEPR模型名称是______ .
(5)反应生成的 在自然界中会被溶解有
在自然界中会被溶解有 的雨水溶蚀,该过程的离子方程式为
的雨水溶蚀,该过程的离子方程式为______ 。已知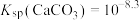 ,碳酸的
,碳酸的 (碳酸浓度以
(碳酸浓度以 形式计算)、
形式计算)、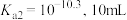 某雨水恰好能够溶解
某雨水恰好能够溶解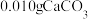 ,此时该雨水中的
,此时该雨水中的 浓度为
浓度为 ,忽略固体溶解产生的体积变化,则此时该雨水的
,忽略固体溶解产生的体积变化,则此时该雨水的 为
为______ 。
 进行处理。
进行处理。I.在温度
 下将高温水蒸气通入炽热的焦炭中,其中可能发生的一些反应如下:
下将高温水蒸气通入炽热的焦炭中,其中可能发生的一些反应如下:反应方程式 | 焓变 | 压强平衡常数 |
① |
|
|
② |
|
|
(1)已知反应
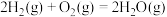 的焓变
的焓变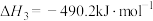 ,近似认为反应焓变不随温度变化,则焦炭的燃烧热
,近似认为反应焓变不随温度变化,则焦炭的燃烧热
 。
。(2)在温度
 下体系达到化学平衡,将这一时刻记为
下体系达到化学平衡,将这一时刻记为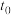 ,然后将可压缩的恒温反应容器突然压缩至原来体积的一半。将压缩之后这一瞬间的时刻记为
,然后将可压缩的恒温反应容器突然压缩至原来体积的一半。将压缩之后这一瞬间的时刻记为 ,重新达到平衡时的时刻记为
,重新达到平衡时的时刻记为 ,则______(填标号)。
,则______(填标号)。A. 时,反应①的正反应速率比 时,反应①的正反应速率比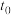 时增大 时增大 | B. 时,反应②的逆反应速率比 时,反应②的逆反应速率比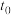 时减小 时减小 |
C. 时,反应①的压强平衡常数 时,反应①的压强平衡常数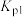 比 比 时增大 时增大 | D. 时,水蒸气的转化率比 时,水蒸气的转化率比 时减小 时减小 |
(3)反应②的平衡常数
 很小,若近似忽略生成
很小,若近似忽略生成 的反应,在一个体积固定的恒温容器内投入足量焦炭与一定量的水蒸气,在温度
的反应,在一个体积固定的恒温容器内投入足量焦炭与一定量的水蒸气,在温度 下达到平衡时水蒸气的转化率为
下达到平衡时水蒸气的转化率为 ,下图的三条曲线分别代表了达到平衡时不同的转化率
,下图的三条曲线分别代表了达到平衡时不同的转化率 对应的水蒸气分压、
对应的水蒸气分压、 分压、体系的总压,则代表
分压、体系的总压,则代表 分压的曲线是
分压的曲线是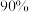 ,则初始充入水蒸气的压强应为
,则初始充入水蒸气的压强应为 (结果保留两位有效数字)。
(结果保留两位有效数字)。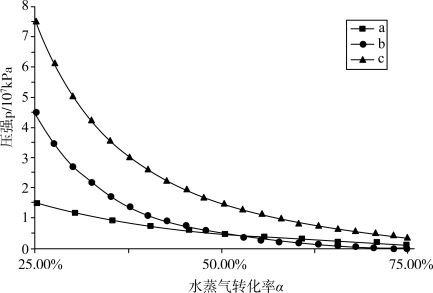
 ,生成
,生成 。除了以外,钙还有多种氧化物。
。除了以外,钙还有多种氧化物。(4)
 在大约
在大约 的高压条件下还可以进一步与
的高压条件下还可以进一步与 反应得到由
反应得到由 和
和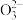 构成的另一种钙的氧化物
构成的另一种钙的氧化物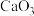 ,预测
,预测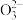 的VSEPR模型名称是
的VSEPR模型名称是(5)反应生成的
 在自然界中会被溶解有
在自然界中会被溶解有 的雨水溶蚀,该过程的离子方程式为
的雨水溶蚀,该过程的离子方程式为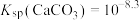 ,碳酸的
,碳酸的 (碳酸浓度以
(碳酸浓度以 形式计算)、
形式计算)、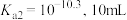 某雨水恰好能够溶解
某雨水恰好能够溶解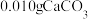 ,此时该雨水中的
,此时该雨水中的 浓度为
浓度为 ,忽略固体溶解产生的体积变化,则此时该雨水的
,忽略固体溶解产生的体积变化,则此时该雨水的 为
为
您最近一年使用:0次
2024-04-21更新
|
401次组卷
|
4卷引用:河北省重点高中2023-2024学年高三下学期5月高考模拟化学试题(二)
河北省重点高中2023-2024学年高三下学期5月高考模拟化学试题(二)(已下线)压轴题13?化学反应原理综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)湖南省新高考教学教研联盟2023-2024学年高三下学期第二次联考化学试题福建省福建师范大学附属中学2023-2024学年高三下学期4月末化学综合模拟测试
2024高三下·全国·专题练习
8 . 丙烯是三大合成材料的基本原料之一,可用于生产多种重要有机化工原料。由丙烷制丙烯的两种方法如下:
I.丙烷无氧脱氢法: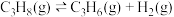
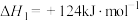
II.丙烷氧化脱氢法: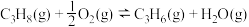

请回答下列问题:
(1)对于反应I,下列条件有利于提高 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)
(2)某温度下,在刚性密闭容器中充入 发生反应I,起始压强为
发生反应I,起始压强为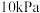 ,平衡时总压强为
,平衡时总压强为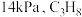 的平衡转化率为
的平衡转化率为___________ 。
(3)一定压强下,向密闭容器中充入一定量的 和
和 ,发生反应
,发生反应
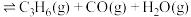 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比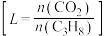 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为___________ ,判断依据是___________ 。 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃___________ 575℃(填“>”或“<”)。
I.丙烷无氧脱氢法:
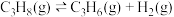
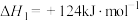
II.丙烷氧化脱氢法:
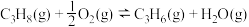

请回答下列问题:
(1)对于反应I,下列条件有利于提高
 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
 发生反应I,起始压强为
发生反应I,起始压强为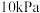 ,平衡时总压强为
,平衡时总压强为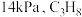 的平衡转化率为
的平衡转化率为(3)一定压强下,向密闭容器中充入一定量的
 和
和 ,发生反应
,发生反应
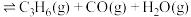 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比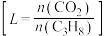 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为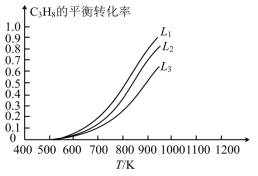
 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃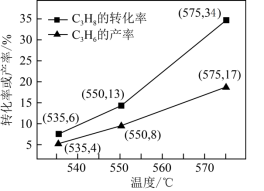
您最近一年使用:0次
9 . 精脱硫技术主要用于煤气中羰基硫(COS)和二硫化碳(CS2)的转化。回答下列问题:
(1)利用焦炉煤气中的H2可脱除煤气中羰基硫(COS)。羰基硫氢化反应历程有途径I和途径Ⅱ两种可能,如图所示:___________ (填“I”或“Ⅱ”)。
②反应 的△H=
的△H=___________ kJ·mol-1。
(2)MoS2可作羰基硫氢化反应的催化剂,催化机理如图所示:___________ (填“3.4%Mo”或“8.7%Mo”)作催化剂效果最好;当H2S选择性低于100%时表明部分COS气体与催化剂发生了反应,催化剂有吸硫现象,若H2S选择性高于100%,可能的原因是___________ 。
(3)金属Mo的晶胞如图所示,若原子a、b的坐标分别为(0,0,0)、(1,0,0),则原子c的坐标为___________ ,设晶体密度为ρg·cm3,则晶胞参数为___________ pm(阿伏加德罗常数的值为NA)。 ,容器内气体压强随时间变化如下表所示。
,容器内气体压强随时间变化如下表所示。
①0-250min内,H2分压的平均变化值为___________ kPa·min-l。
②该温度下,平衡常数Kp=___________ (kPa)-2(列出计算式)。
(1)利用焦炉煤气中的H2可脱除煤气中羰基硫(COS)。羰基硫氢化反应历程有途径I和途径Ⅱ两种可能,如图所示:
②反应
 的△H=
的△H=(2)MoS2可作羰基硫氢化反应的催化剂,催化机理如图所示:
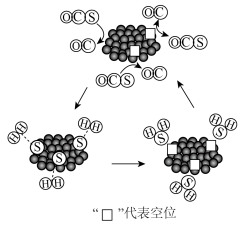
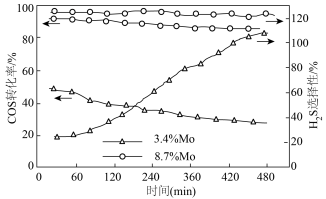
(3)金属Mo的晶胞如图所示,若原子a、b的坐标分别为(0,0,0)、(1,0,0),则原子c的坐标为

 ,容器内气体压强随时间变化如下表所示。
,容器内气体压强随时间变化如下表所示。| 时间/min | 0 | 50 | 100 | 150 | 200 | 250 | 300 |
| 压强/kPa | 100 | 88.0 | 79.8 | 72.4 | 68.2 | 65.0 | 65.0 |
②该温度下,平衡常数Kp=
您最近一年使用:0次
10 . 煤的间接液化是煤的综合利用的一种重要方法。首先是煤燃烧生成 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 。过程中主要发生如下反应:
。过程中主要发生如下反应:
反应I: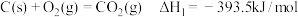
反应Ⅱ:
反应Ⅲ: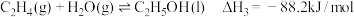
(1)钼 的基态原子中未成对电子数为
的基态原子中未成对电子数为_______ 。
(2)已知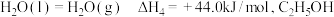 的燃烧热
的燃烧热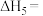
___  。
。
(3)为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个 的刚性容器中加入
的刚性容器中加入 气体及
气体及 水蒸气,在
水蒸气,在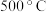 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
①下列能说明该反应已达到平衡状态的有_______ (填标号) 。
A. 的体积分数不再改变 B.
的体积分数不再改变 B.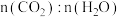 不再改变
不再改变
C.容器的总压不再改变 D.容器中气体的密度不再改变
②下图为四种组分的平衡时物质的量分数随温度的变化曲线。图中曲线b表示的物质是_______ ,原因是_______ 。 时该反应的平衡常数为
时该反应的平衡常数为_______ 。
④ 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和 ,同时加入了
,同时加入了 和
和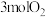 ,达到平衡后
,达到平衡后 的体积分数仍与N点相同,则
的体积分数仍与N点相同,则
_______ (用含m的代数式表示)。
 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 。过程中主要发生如下反应:
。过程中主要发生如下反应:反应I:
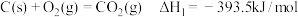
反应Ⅱ:

反应Ⅲ:
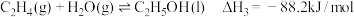
(1)钼
 的基态原子中未成对电子数为
的基态原子中未成对电子数为(2)已知
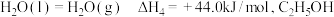 的燃烧热
的燃烧热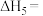
 。
。(3)为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个
 的刚性容器中加入
的刚性容器中加入 气体及
气体及 水蒸气,在
水蒸气,在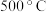 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。①下列能说明该反应已达到平衡状态的有
A.
 的体积分数不再改变 B.
的体积分数不再改变 B.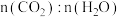 不再改变
不再改变C.容器的总压不再改变 D.容器中气体的密度不再改变
②下图为四种组分的平衡时物质的量分数随温度的变化曲线。图中曲线b表示的物质是
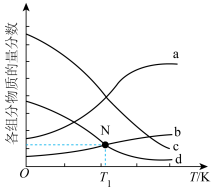
 时该反应的平衡常数为
时该反应的平衡常数为④
 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和 ,同时加入了
,同时加入了 和
和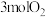 ,达到平衡后
,达到平衡后 的体积分数仍与N点相同,则
的体积分数仍与N点相同,则
您最近一年使用:0次