名校
解题方法
1 . 工业制硫酸的关键反应为 。T℃时,向
。T℃时,向 恒容密闭容器中按照物质的量之比
恒容密闭容器中按照物质的量之比 通入
通入 和
和 ,测得容器内某些物质的量随时间变化如图。下列说法正确的是
,测得容器内某些物质的量随时间变化如图。下列说法正确的是
 。T℃时,向
。T℃时,向 恒容密闭容器中按照物质的量之比
恒容密闭容器中按照物质的量之比 通入
通入 和
和 ,测得容器内某些物质的量随时间变化如图。下列说法正确的是
,测得容器内某些物质的量随时间变化如图。下列说法正确的是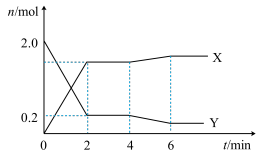
A.用 表示 表示 内的平均反应速率为 内的平均反应速率为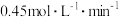 |
B.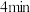 时改变的条件可能是降温或增加 时改变的条件可能是降温或增加 的量 的量 |
| C.T℃,正反应的化学平衡常数K为810 |
D. 时,若再加入 时,若再加入 和 和 各 各 ,平衡逆向移动 ,平衡逆向移动 |
您最近一年使用:0次
2024-01-07更新
|
242次组卷
|
4卷引用:湖南省长沙市长郡中学2023-2024学年高三上学期月考(四)化学试题
湖南省长沙市长郡中学2023-2024学年高三上学期月考(四)化学试题(已下线)提升练05 化学平衡常数的计算-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题
23-24高二·全国·假期作业
2 . 回答下列问题。
(I)载人飞船中通过如下过程实现O2再生:
①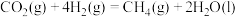

②

(1)已知18g液态水完全气化要吸收44kJ的热量,则1molCH4完全燃烧生成气态水时放出___________ kJ热量。
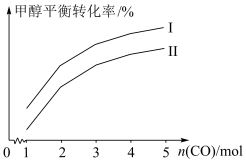
(II)工业上可用CO和H2合成甲醇: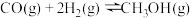 。一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应,CO的平衡转化率与温度、压强的关系如图所示:
。一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应,CO的平衡转化率与温度、压强的关系如图所示:

(2)在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:v正___________ v逆(填“>”“<”或“=”);B点和C点的逆反应速率的关系:v逆(B)___________ v正(C)(填“>”“<”或“=”)。
(3)该反应的
___________ 0(填“>”或“<”);生产中有利于增大CO平衡转化率的措施有___________ (写出1条即可)。
(4)若p2=100kPa,B点的Kp=___________ 。(结果保留2位有效数字;Kp表示分压平衡常数,分压=总压 物质的量分数)。
物质的量分数)。
(I)载人飞船中通过如下过程实现O2再生:
①

②


(1)已知18g液态水完全气化要吸收44kJ的热量,则1molCH4完全燃烧生成气态水时放出
(II)工业上可用CO和H2合成甲醇:
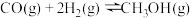 。一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应,CO的平衡转化率与温度、压强的关系如图所示:
。一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应,CO的平衡转化率与温度、压强的关系如图所示:
(2)在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:v正
(3)该反应的

(4)若p2=100kPa,B点的Kp=
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
23-24高二·全国·假期作业
3 . 合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
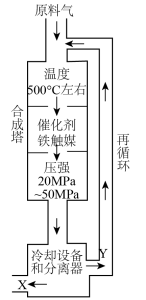
(1)图中条件选定的主要原因是_______ (填字母编号)。
A.温度、压强对化学平衡的影响
B.催化剂铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(2)工业生产中氮气与氢气按物质的量之比为1∶2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为x mol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的
_______ (用p表示,气体分压=总压×物质的量分数)。
(3)合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,若进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
而实际流程从合成塔出来的混合气体中含有氨约为15%,这表明_______ 。
A.表中所测数据有明显误差 B.生产条件控制不当
C.氨的分解速率大于预测值 D.合成塔中的反应并未达到平衡
该流程控制含氨约为15%的原因是_______ 。

(1)图中条件选定的主要原因是
A.温度、压强对化学平衡的影响
B.催化剂铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(2)工业生产中氮气与氢气按物质的量之比为1∶2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为x mol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的

(3)合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,若进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
| 压强 | 20MPa | 60MPa |
| 500℃ | 19.1 | 42.2 |
A.表中所测数据有明显误差 B.生产条件控制不当
C.氨的分解速率大于预测值 D.合成塔中的反应并未达到平衡
该流程控制含氨约为15%的原因是
您最近一年使用:0次
解题方法
4 . 近日,中国科学院大连化学物理研究所研究员丁云杰团队以功能化改性的活性炭为载体,研究了 单核络合物催化剂的多相甲醇羰基化反应性能。
单核络合物催化剂的多相甲醇羰基化反应性能。
①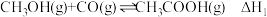
②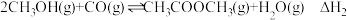
回答下列问题:
(1)已知:几种共价键的键能如下表。

___________  。
。
(2)一定温度下,向恒容密闭容器中充入一定量 和
和 ,发生上述反应①和②。下列情况表明该反应达到平衡状态的有___________(填字母标号)。
,发生上述反应①和②。下列情况表明该反应达到平衡状态的有___________(填字母标号)。
(3)已知几种反应的热化学方程式如下:
i.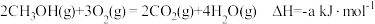
ii.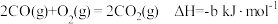
iii.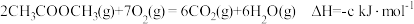

___________  (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
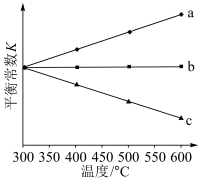
(4)反应①的平衡常数K与温度关系如图所示,其中曲线___________ (填“a”“b”或“c”)变化符合实际,理由是___________ 。
(5)一定温度下,向体积可变的密闭容器中充入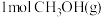 和
和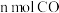 。
。 平衡转化率与压强、
平衡转化率与压强、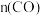 的关系如图所示。
的关系如图所示。
①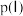
___________ 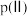 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②随着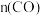 增大,
增大, 平衡转化率增大的原因是
平衡转化率增大的原因是___________ 。
(6)一定温度下,保持总压强为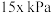 时,向反应器中充入
时,向反应器中充入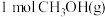 和
和 ,达到平衡时,
,达到平衡时, 转化率为
转化率为 ,
, 选择性为
选择性为 。反应①的平衡常数
。反应①的平衡常数 为
为_________ 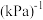 。
。
提示:用分压计算的平衡常数叫压强平衡常数( ),分压=总压×物质的量分数。
),分压=总压×物质的量分数。
 选择性
选择性 。
。
 单核络合物催化剂的多相甲醇羰基化反应性能。
单核络合物催化剂的多相甲醇羰基化反应性能。①
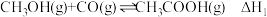
②
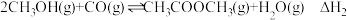
回答下列问题:
(1)已知:几种共价键的键能如下表。
| 共价键 | 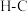 | 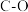 |  |  |  | 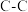 |
键能/( ) ) | 413 | 343 | 465 | 1076 | 745 | 348 |

 。
。(2)一定温度下,向恒容密闭容器中充入一定量
 和
和 ,发生上述反应①和②。下列情况表明该反应达到平衡状态的有___________(填字母标号)。
,发生上述反应①和②。下列情况表明该反应达到平衡状态的有___________(填字母标号)。| A.混合气体密度不随时间变化 |
| B.气体总压强不随时间变化 |
| C.气体平均摩尔质量不随时间变化 |
D. 消耗速率等于水蒸气生成速率 消耗速率等于水蒸气生成速率 |
(3)已知几种反应的热化学方程式如下:
i.
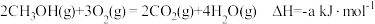
ii.
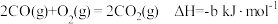
iii.
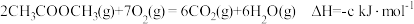

 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。(4)反应①的平衡常数K与温度关系如图所示,其中曲线

(5)一定温度下,向体积可变的密闭容器中充入
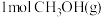 和
和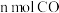 。
。 平衡转化率与压强、
平衡转化率与压强、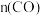 的关系如图所示。
的关系如图所示。
①
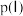
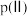 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②随着
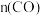 增大,
增大, 平衡转化率增大的原因是
平衡转化率增大的原因是(6)一定温度下,保持总压强为
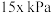 时,向反应器中充入
时,向反应器中充入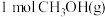 和
和 ,达到平衡时,
,达到平衡时, 转化率为
转化率为 ,
, 选择性为
选择性为 。反应①的平衡常数
。反应①的平衡常数 为
为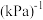 。
。提示:用分压计算的平衡常数叫压强平衡常数(
 ),分压=总压×物质的量分数。
),分压=总压×物质的量分数。 选择性
选择性 。
。
您最近一年使用:0次
5 . Ⅰ.环氧乙烷( )常用于医学消毒,工业上常用乙烯氧化法生产,其反应原理为:CH2=CH2(g)+
)常用于医学消毒,工业上常用乙烯氧化法生产,其反应原理为:CH2=CH2(g)+ O2(g)
O2(g)

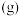 △H=-120kJ/mol。
△H=-120kJ/mol。
(1)该反应在________ (填“高温”或“低温”)条件下自发进行。
(2)化工生产设计时,常用串联多个反应器的工艺方法进行合成,并在两个相同的反应器中间加产物吸收装置和热交换降温装置,设计这种工艺的目的是________ 。
(3)在恒容密闭容器中,利用乙烯氧化法制备环氧乙烷(不考虑副反应),下列情况能说明该反应一定达到化学平衡状态的是________(填序号)。
Ⅱ.反应过程中常伴随副反应
 ,在恒容密闭容器中充入1mol乙烯和含1molO2的净化空气,在Ag(耐热)催化下发生上述两个反应,反应相同时间后测得乙烯的转化率α及O2的分压随温度变化如图所示:
,在恒容密闭容器中充入1mol乙烯和含1molO2的净化空气,在Ag(耐热)催化下发生上述两个反应,反应相同时间后测得乙烯的转化率α及O2的分压随温度变化如图所示:

(4)比较a点 和
和 :
:
________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)若200℃时测得环氧乙烷的选择性为 (某产物的选择性
(某产物的选择性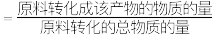 ),计算该温度下主反应的平衡常数(用物质分压表示)
),计算该温度下主反应的平衡常数(用物质分压表示)
________ 。(用含 的式子表示)
的式子表示)
Ⅲ.有研究人员对该制备过程的催化剂(其他条件相同)催化机理进行研究,发现Ag通过对 的吸附完成催化作用,形成的两种中间体相对能量如图所示,研究还发现若原料气(混有
的吸附完成催化作用,形成的两种中间体相对能量如图所示,研究还发现若原料气(混有 等杂质)不净化,两个中间体和产物环氧乙烷都几乎检测不到。
等杂质)不净化,两个中间体和产物环氧乙烷都几乎检测不到。

(6)根据以上研究结果下列推测合理的是________ (填字母)。
A.由图可知中间体 更容易形成
更容易形成
B.杂质气体 能与催化剂反应而使催化剂失去活性
能与催化剂反应而使催化剂失去活性
C.催化剂Ag并未参与反应
Ⅳ.工业上也可以通过电化学方法获得环氧乙烷,原理如图所示:

(7)P电极是该电解池的________ 极。
(8)该电池阴极电极反应式为________ 。
 )常用于医学消毒,工业上常用乙烯氧化法生产,其反应原理为:CH2=CH2(g)+
)常用于医学消毒,工业上常用乙烯氧化法生产,其反应原理为:CH2=CH2(g)+ O2(g)
O2(g)

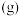 △H=-120kJ/mol。
△H=-120kJ/mol。(1)该反应在
(2)化工生产设计时,常用串联多个反应器的工艺方法进行合成,并在两个相同的反应器中间加产物吸收装置和热交换降温装置,设计这种工艺的目的是
(3)在恒容密闭容器中,利用乙烯氧化法制备环氧乙烷(不考虑副反应),下列情况能说明该反应一定达到化学平衡状态的是________(填序号)。
| A.混合气体的密度保持不变 | B.混合气体的平均摩尔质量保持不变 |
| C.乙烯和氧气的物质的量比为2:1 | D.每消耗 同时消耗1mol环氧乙烷 同时消耗1mol环氧乙烷 |
Ⅱ.反应过程中常伴随副反应

 ,在恒容密闭容器中充入1mol乙烯和含1molO2的净化空气,在Ag(耐热)催化下发生上述两个反应,反应相同时间后测得乙烯的转化率α及O2的分压随温度变化如图所示:
,在恒容密闭容器中充入1mol乙烯和含1molO2的净化空气,在Ag(耐热)催化下发生上述两个反应,反应相同时间后测得乙烯的转化率α及O2的分压随温度变化如图所示:
(4)比较a点
 和
和 :
:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)若200℃时测得环氧乙烷的选择性为
 (某产物的选择性
(某产物的选择性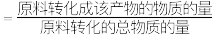 ),计算该温度下主反应的平衡常数(用物质分压表示)
),计算该温度下主反应的平衡常数(用物质分压表示)
 的式子表示)
的式子表示) Ⅲ.有研究人员对该制备过程的催化剂(其他条件相同)催化机理进行研究,发现Ag通过对
 的吸附完成催化作用,形成的两种中间体相对能量如图所示,研究还发现若原料气(混有
的吸附完成催化作用,形成的两种中间体相对能量如图所示,研究还发现若原料气(混有 等杂质)不净化,两个中间体和产物环氧乙烷都几乎检测不到。
等杂质)不净化,两个中间体和产物环氧乙烷都几乎检测不到。
(6)根据以上研究结果下列推测合理的是
A.由图可知中间体
 更容易形成
更容易形成B.杂质气体
 能与催化剂反应而使催化剂失去活性
能与催化剂反应而使催化剂失去活性C.催化剂Ag并未参与反应
Ⅳ.工业上也可以通过电化学方法获得环氧乙烷,原理如图所示:

(7)P电极是该电解池的
(8)该电池阴极电极反应式为
您最近一年使用:0次
名校
6 . 反应M(g)+N(g)  P(g)+Q(g)在不同温度(T)时的平衡常数(K)如下:
P(g)+Q(g)在不同温度(T)时的平衡常数(K)如下:
密闭容器中,某温度(T)、某时刻(t)时,反应混合物中M、N、P、Q的浓度分别为1mol/L、1mol/L、1.5mol/L、1.5mol/L,下列说法正确的是
 P(g)+Q(g)在不同温度(T)时的平衡常数(K)如下:
P(g)+Q(g)在不同温度(T)时的平衡常数(K)如下:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A.该反应ΔH<0 |
| B.若T=700℃,则t时刻反应向正反应方向进行 |
| C.若t时刻反应达到化学平衡,则1000℃<T<1200℃ |
| D.当T=830℃达到化学平衡时,c(M)=0.75mol/L |
您最近一年使用:0次
2023-12-28更新
|
89次组卷
|
8卷引用:北京市东城区2021届高三综合练习(二)化学试题
北京市东城区2021届高三综合练习(二)化学试题(已下线)2021年高考化学押题预测卷(北京卷)(02)河南省中原名校2021-2022学年高二上学期第一次联考化学试题云南省昆明市官渡区第一中学2021-2022学年高二上学期期中考试化学试题(已下线)第22讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(全国通用)北京市第五中学2023-2024学年高三上学期期中考试化学试题北京市通州区潞河中学2021-2022学年高三下学期开学考试化学试卷北京市东直门中学2023-2024学年高三上学期综合(三)阶段性考试化学试题
名校
解题方法
7 . 丙烯是重要的化工原料,可用于生产丙醇、卤代烃和塑料。回答下列问题:
(1)工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①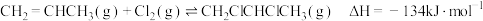
②
已知: 的活化能
的活化能 为
为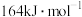 ,则该反应的活化能
,则该反应的活化能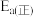 为
为___________  。
。
(2)某研究小组向密闭容器中充入一定量的 和
和 ,分别在
,分别在 、
、 两种不同催化剂作用下发生反应①,一段时间后测得
两种不同催化剂作用下发生反应①,一段时间后测得 的产率与温度的关系如下图所示。
的产率与温度的关系如下图所示。___________ (填代号)。
A.使用催化剂 的最佳温度约为
的最佳温度约为
B.相同条件下,改变压强不影响 的产率
的产率
C.两种催化剂均能降低反应的活化能,但 不变
不变
D.P点是对应温度下 的平衡产率
的平衡产率
②在催化剂 作用下,温度低于
作用下,温度低于 时,
时, 的产率随温度升高变化不大,主要原因是
的产率随温度升高变化不大,主要原因是___________ 。
(3) 在不同温度下达到平衡,在总压强分别为
在不同温度下达到平衡,在总压强分别为 和
和 时,测得丙烷及丙烯的物质的量分数如图所示。
时,测得丙烷及丙烯的物质的量分数如图所示。___________ (填“丙烷”或“丙烯”),
___________  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
②起始时充入一定量丙烷,在恒压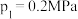 条件下发生反应,
条件下发生反应, 点对应温度下丙烷的转化率为
点对应温度下丙烷的转化率为___________ (保留1位小数),该反应的平衡常数
___________ 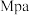 (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
(1)工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①
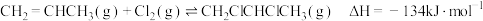
②

已知:
 的活化能
的活化能 为
为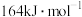 ,则该反应的活化能
,则该反应的活化能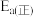 为
为 。
。(2)某研究小组向密闭容器中充入一定量的
 和
和 ,分别在
,分别在 、
、 两种不同催化剂作用下发生反应①,一段时间后测得
两种不同催化剂作用下发生反应①,一段时间后测得 的产率与温度的关系如下图所示。
的产率与温度的关系如下图所示。
A.使用催化剂
 的最佳温度约为
的最佳温度约为
B.相同条件下,改变压强不影响
 的产率
的产率C.两种催化剂均能降低反应的活化能,但
 不变
不变D.P点是对应温度下
 的平衡产率
的平衡产率②在催化剂
 作用下,温度低于
作用下,温度低于 时,
时, 的产率随温度升高变化不大,主要原因是
的产率随温度升高变化不大,主要原因是(3)
 在不同温度下达到平衡,在总压强分别为
在不同温度下达到平衡,在总压强分别为 和
和 时,测得丙烷及丙烯的物质的量分数如图所示。
时,测得丙烷及丙烯的物质的量分数如图所示。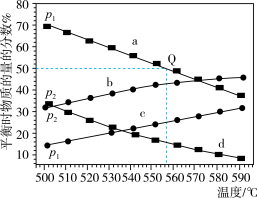

 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。②起始时充入一定量丙烷,在恒压
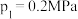 条件下发生反应,
条件下发生反应, 点对应温度下丙烷的转化率为
点对应温度下丙烷的转化率为
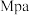 (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2023-12-19更新
|
638次组卷
|
4卷引用:2024届四川省自贡市普高高三上学期第一次诊断性考试理综试题
2024届四川省自贡市普高高三上学期第一次诊断性考试理综试题河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)大题04 化学反应原理综合题(逐空突破)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
8 . “氢经济”是“双碳”转型中非常关键的一环。大量安全制氢是关键技术之一。
方法一:工业上常用甲烷、水蒸气重整制备氢气,体系中发生如下反应:
反应①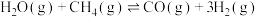
反应②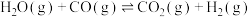
(1)下列操作中,能提高 平衡转化率的是_____。(双选)
平衡转化率的是_____。(双选)
(2)恒温条件下,1L密闭容器中, 和
和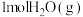 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为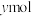 ,则反应①的平衡常数
,则反应①的平衡常数
_____ 。(用 、
、 表示)
表示)
方法二:用与 制备
制备 可以同时实现资源化利用,其反应历程如下:
可以同时实现资源化利用,其反应历程如下:
反应①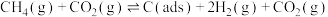
反应②
已知: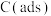 为吸附型活性炭。
为吸附型活性炭。
(3)使用不同催化剂时,相同时间内测得 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示:

催化效果最佳的是催化剂_____ (选填“Ⅰ”、“Ⅱ”或“Ⅲ”),b点的
_____  (选填“>”、“<”或“=”),c点转化率比a点低的可能原因是
(选填“>”、“<”或“=”),c点转化率比a点低的可能原因是_____ 。(任写一点)
方法一:工业上常用甲烷、水蒸气重整制备氢气,体系中发生如下反应:
反应①
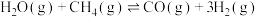
反应②
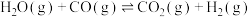
(1)下列操作中,能提高
 平衡转化率的是_____。(双选)
平衡转化率的是_____。(双选)A.增大 的浓度 的浓度 | B.分离出 |
| C.恒温恒压下通入惰性气体 | D.加入催化剂 |
(2)恒温条件下,1L密闭容器中,
 和
和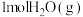 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为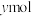 ,则反应①的平衡常数
,则反应①的平衡常数
 、
、 表示)
表示)方法二:用与
 制备
制备 可以同时实现资源化利用,其反应历程如下:
可以同时实现资源化利用,其反应历程如下:反应①
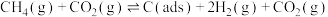
反应②

已知:
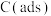 为吸附型活性炭。
为吸附型活性炭。(3)使用不同催化剂时,相同时间内测得
 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示:
催化效果最佳的是催化剂

 (选填“>”、“<”或“=”),c点转化率比a点低的可能原因是
(选填“>”、“<”或“=”),c点转化率比a点低的可能原因是
您最近一年使用:0次
9 . 氨氧化法是工业制硝酸的常见方法。
第一步:合成氨。
(1)传统方法:在恒温恒容的密闭容器中,进行如下化学反应:
 ,对该反应的条件进行探究,下列实验措施与结论正确对应的是___________(填字母)。
,对该反应的条件进行探究,下列实验措施与结论正确对应的是___________(填字母)。
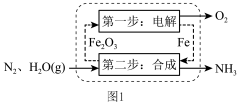
(2)铁基循环制氨:如图1所示,工作时,使用熔融的电解质通过两步循环实现氨的合成,该工艺合成氨的化学方程式为___________ 。
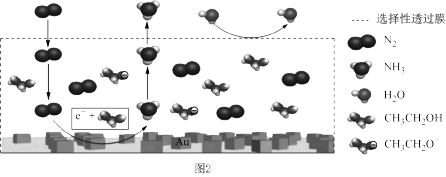
(3)电解法在常温常压下实现合成氨:工作时,电极生成 的微观示意图如图2所示,其中电解液为溶有三氟甲硝酸锂和乙醇的惰性有机溶剂。电极上生成
的微观示意图如图2所示,其中电解液为溶有三氟甲硝酸锂和乙醇的惰性有机溶剂。电极上生成 的电极反应式为
的电极反应式为___________ 。
第二步:氮氧化物的制备。
(4)氨催化氧化生成 后,
后, 氧化生成
氧化生成 的总反应为
的总反应为
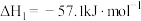 ,可分两步进行,其反应过程中的能量变化示意图如图所示:
,可分两步进行,其反应过程中的能量变化示意图如图所示:
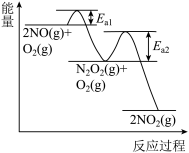
Ⅰ.
Ⅱ.
①决定 氧化反应速率的步骤是
氧化反应速率的步骤是___________ (填“Ⅰ”或“Ⅱ”)。
②在恒容密闭容器中充入一定量的 和
和 ,保持其他条件不变,控制反应温度分别为
,保持其他条件不变,控制反应温度分别为 和
和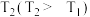 ,测得
,测得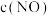 随时间变化的曲线如图,转化相同量的
随时间变化的曲线如图,转化相同量的 ,在温度
,在温度___________ (填“ ”或“
”或“ ”)下消耗的时间较长,试结合反应过程及能量图(如图)分析其原因:
”)下消耗的时间较长,试结合反应过程及能量图(如图)分析其原因:___________ 。
(5)已知:
 ,将一定物质的量的
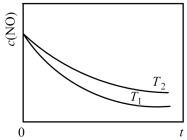
,将一定物质的量的 充入某恒容密闭容器中,测得不同温度下
充入某恒容密闭容器中,测得不同温度下 和
和 的平衡体积分数如图所示:
的平衡体积分数如图所示:
①代表 的曲线是
的曲线是___________ (填“a”或“b”)。
②假设平衡时体系的总压为 ,则
,则 点温度下的平衡常数
点温度下的平衡常数
___________ (用含 的表达式表示),
的表达式表示), 的平衡转化率
的平衡转化率
___________ (保留3位有效数字)。
第三步:硝酸的制备。
(6)已知: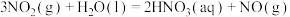
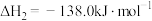 ,则
,则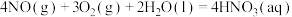

___________  。
。
第一步:合成氨。
(1)传统方法:在恒温恒容的密闭容器中,进行如下化学反应:

 ,对该反应的条件进行探究,下列实验措施与结论正确对应的是___________(填字母)。
,对该反应的条件进行探究,下列实验措施与结论正确对应的是___________(填字母)。| A.通过更换不同种类的催化剂,可以调节平衡时原料的转化率 |
| B.反应装置保持在相对较低的温度下,将有利于该反应的自发进行 |
| C.在反应过程中任意时刻移除部分产物,都可以使反应正向进行,但该反应的平衡常数保持不变 |
D.当检测到装置内的 保持不变时,不一定能说明反应已经达到平衡状态 保持不变时,不一定能说明反应已经达到平衡状态 |
(2)铁基循环制氨:如图1所示,工作时,使用熔融的电解质通过两步循环实现氨的合成,该工艺合成氨的化学方程式为

(3)电解法在常温常压下实现合成氨:工作时,电极生成
 的微观示意图如图2所示,其中电解液为溶有三氟甲硝酸锂和乙醇的惰性有机溶剂。电极上生成
的微观示意图如图2所示,其中电解液为溶有三氟甲硝酸锂和乙醇的惰性有机溶剂。电极上生成 的电极反应式为
的电极反应式为
第二步:氮氧化物的制备。
(4)氨催化氧化生成
 后,
后, 氧化生成
氧化生成 的总反应为
的总反应为
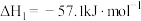 ,可分两步进行,其反应过程中的能量变化示意图如图所示:
,可分两步进行,其反应过程中的能量变化示意图如图所示:
Ⅰ.

Ⅱ.

①决定
 氧化反应速率的步骤是
氧化反应速率的步骤是②在恒容密闭容器中充入一定量的
 和
和 ,保持其他条件不变,控制反应温度分别为
,保持其他条件不变,控制反应温度分别为 和
和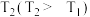 ,测得
,测得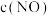 随时间变化的曲线如图,转化相同量的
随时间变化的曲线如图,转化相同量的 ,在温度
,在温度 ”或“
”或“ ”)下消耗的时间较长,试结合反应过程及能量图(如图)分析其原因:
”)下消耗的时间较长,试结合反应过程及能量图(如图)分析其原因:
(5)已知:

 ,将一定物质的量的
,将一定物质的量的 充入某恒容密闭容器中,测得不同温度下
充入某恒容密闭容器中,测得不同温度下 和
和 的平衡体积分数如图所示:
的平衡体积分数如图所示:
①代表
 的曲线是
的曲线是②假设平衡时体系的总压为
 ,则
,则 点温度下的平衡常数
点温度下的平衡常数
 的表达式表示),
的表达式表示), 的平衡转化率
的平衡转化率
第三步:硝酸的制备。
(6)已知:
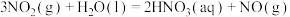
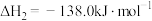 ,则
,则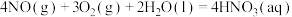

 。
。
您最近一年使用:0次
解题方法
10 . 某温度下,可逆反应: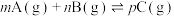 的平衡常数为K,下列对K的说法正确的是
的平衡常数为K,下列对K的说法正确的是
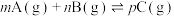 的平衡常数为K,下列对K的说法正确的是
的平衡常数为K,下列对K的说法正确的是A.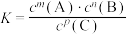 |
B.如果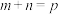 ,则 ,则 |
| C.K值越大,表明该反应越有利于C的生成,平衡时反应物的转化率越大 |
D.增大压强缩小反应器的容积到原来的一半,达到新的平衡时C的浓度为原平衡的1.5倍则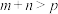 |
您最近一年使用:0次
2023-12-14更新
|
112次组卷
|
2卷引用:贵州省贵阳市三新改革联盟校2023-2024学年高二上学期10月月考化学试题



