1 . 甲烷在日常生活及有机合成中用途广泛,某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+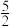 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g) C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=_____ 。
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为____ 。
②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=___ ,上述变化过程中T1____ (填“>”或“<”)T2,判断理由是____ 。
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将____ (填“不移动”、“正向移动”或“逆向移动”),与原平衡相比,CH4的平衡转化率____ (填“不变”、“变大”或“变小”)。
(3)若容器中发生反应2CH4(g) C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=____ Pa2(用平衡分压代替平衡浓度)。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+
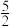 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-12H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g)
 C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将
(3)若容器中发生反应2CH4(g)
 C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
您最近一年使用:0次
2022-10-19更新
|
601次组卷
|
3卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
名校
解题方法
2 . 利用I2O5可消除CO污染,其反应为I2O5(s)+5CO(g) 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是

 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是
| A.b点时,CO的转化率为80% |
| B.容器内的压强保持恒定,表明反应达到平衡状态 |
| C.b点和d点的化学平衡常数:Kb>Kd |
| D.由起始到a点这段时间的反应速率v(CO)=0.3mol•L-1•min-1 |
您最近一年使用:0次
2022-10-19更新
|
258次组卷
|
2卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
名校
3 . (1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)=ETBE(g) △H。回答下列问题:
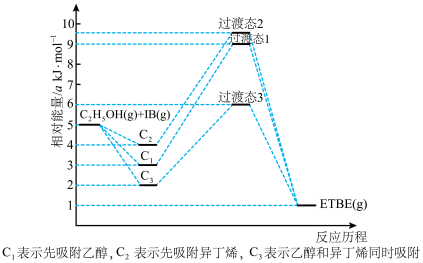
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__________ kJ·mol-1。反应历程的最优途径是________ (填C1、C2或C3)。
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
反应ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
反应ⅲ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________ 。
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时刻v正___ v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___ 。
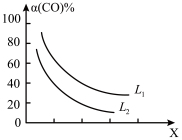
③催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表___ (填“温度”或“压强”),且L1___ L2(填“>”“<”或“=”)。
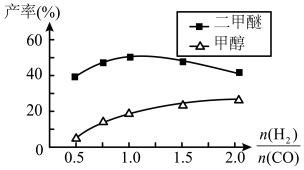
④在催化剂的作用下同时进行三个反应,发现随着起始投料比 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________ 。

反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
反应ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
反应ⅲ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol·L−1) | 0.46 | 1.0 | 1.0 |
③催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表

④在催化剂的作用下同时进行三个反应,发现随着起始投料比
 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
您最近一年使用:0次
2020-05-13更新
|
229次组卷
|
3卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
名校
解题方法
4 . 聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)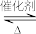 CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____ 0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____ (保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是____ ;A、B、C、D四点中,v正最大的是___ ,v逆最大的是____ 。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____ 时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___ (填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____ 。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
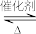 CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
您最近一年使用:0次
2020-02-11更新
|
890次组卷
|
7卷引用:山东省2020年普通高中学业水平等级考试模拟试题
山东省2020年普通高中学业水平等级考试模拟试题【省级联考】山东省2020届新高考模拟统考化学试题河南省洛阳市2020届高三上学期期末模拟考试化学试题(已下线)第24讲 化学平衡常数及转化率的计算(精练)-2021年高考化学一轮复习讲练测(已下线)小题29 化学平衡的相关计算——备战2021年高考化学经典小题考前必刷(全国通用)湖北省沙市中学2021-2022学年高二上学期期末考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题



