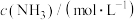名校
解题方法
1 . 用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)⇌CH3OH(g)。在体积一定的密闭容器中分别充入1molCO和2molH2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
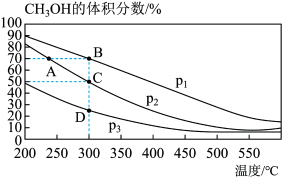
| A.该反应的ΔH<0,且p1<p2 |
| B.反应速率:v逆(状态A)>v逆(状态B) |
| C.在C点时,CO转化率为75% |
| D.在恒温恒容条件下,再向密闭容器中充入1molCO和2molH2,达平衡时CH3OH的体积分数不变 |
您最近一年使用:0次
2020-12-23更新
|
403次组卷
|
3卷引用:广东实验中学2020-2021学年高二上学期期中考试化学试题
名校
2 . 图I是NO2(g)+CO(g)⇌CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件x,y随x的变化关系曲线如图II所示。

下列有关说法正确的是

下列有关说法正确的是
| A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g),充分反应放出234kJ热量 |
| B.若x表示温度,则y表示的可能是CO2的物质的量浓度 |
| C.若x表示CO的起始浓度,则y表示的可能是NO2的转化率 |
| D.若x表示反应时间,则y表示的可能是混合气体的密度 |
您最近一年使用:0次
2022-04-26更新
|
263次组卷
|
32卷引用:2016-2017学年河北省冀州中学高二上第二次月考化学试卷
2016-2017学年河北省冀州中学高二上第二次月考化学试卷2016-2017学年河北省沧州一中高二上10月检测化学卷广东省红岭中学2017-2018学年高二下学期第二学段考试化学试题(已下线)2018-2019学年同步单元双基双测AB卷:第二单元化学反应速率与化学平衡单元测试B卷四川省成都市实验中学2018-2019学年高二上学期期中模拟考试化学试题【全国百强校】河北省武邑中学2018-2019学年高二上学期第二次月考化学试题吉林省长春市一五O中2018-2019学年高二上学期期中考试化学试题云南省大理市下关一中2018-2019学年高二上学期期中考试化学试题福建省永春县第一中学2018-2019学年高二上学期期末考试(理)化学试题河北省沧州市肃宁县第一中学2019-2020学年高二上学期第三次月考化学试题浙江省名校协作体2020年3月高三第二次联考化学试题河南省南阳市2019-2020学年高二上学期期终质量评估化学试题浙江省台州市天台中学2020届高三下学期3月月考化学试题浙江省宁波市北仑中学2019-2020学年高二下学期期中考试化学(1班)试题辽宁省本溪市2019-2020学年高二下学期寒假验收考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素河南省豫南九校2020-2021学年高二上学期第一次联考(9月)化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡 方法帮山西大学附属中学2020-2021学年高二上学期10月模块诊断化学试题安徽省池州市第一中学2020-2021学年高二上学期9月月考化学试题江西南昌新建一中2020-2021学年高二上学期第一次月考化学试题四川省自贡市富顺一中2020—2021学年度高二上学期期中考试化学试题(已下线)【浙江新东方】95选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素重庆市万州第二高级中学2021-2022学年高二上学期第一次月考化学试题江西省吉安市2021-2022学年高三上学期期末考试化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高二上学期9月月考化学试题(已下线)卷01 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)福建省福州第三中学2022-2023学年高二上学期半期考试化学试题福建省漳州市正兴学校2023-2024学年高二上学期10月月考化学试卷
3 . 向某恒容密闭容器中充入一定量CO2和H2,发生反应: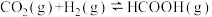 ,测得平衡体系中CO2的物质的量分数与反应温度的关系如图所示。下列物理量中,a点大于b点的是( )
,测得平衡体系中CO2的物质的量分数与反应温度的关系如图所示。下列物理量中,a点大于b点的是( )
①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度的平衡常数

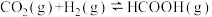 ,测得平衡体系中CO2的物质的量分数与反应温度的关系如图所示。下列物理量中,a点大于b点的是( )
,测得平衡体系中CO2的物质的量分数与反应温度的关系如图所示。下列物理量中,a点大于b点的是( )①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度的平衡常数

| A.①② | B.①③ | C.②④ | D.③④ |
您最近一年使用:0次
2020-10-12更新
|
196次组卷
|
2卷引用:人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时4 化学平衡图象
4 . 如图所示图像中,与可逆反应: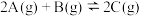
 对应的是()
对应的是()
 对应的是()
对应的是()A. | B.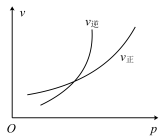 |
C.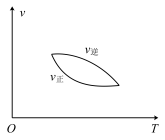 | D.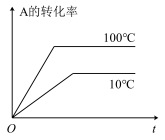 |
您最近一年使用:0次
解题方法
5 . 某化学科研小组研究在其他条件不变时,改变某一条件对反应 的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图像得出的结论正确的是()
的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图像得出的结论正确的是()
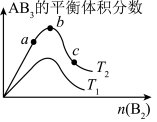
①正反应一定是放热反应
②达到平衡时 的转化率大小为
的转化率大小为
③若 ,则正反应一定是吸热反应
,则正反应一定是吸热反应
④b点时,平衡体系中A、B原子数之比接近1:3
 的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图像得出的结论正确的是()
的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图像得出的结论正确的是()
①正反应一定是放热反应
②达到平衡时
 的转化率大小为
的转化率大小为
③若
 ,则正反应一定是吸热反应
,则正反应一定是吸热反应④b点时,平衡体系中A、B原子数之比接近1:3
| A.①② | B.①③ | C.②④ | D.③④ |
您最近一年使用:0次
2020-10-10更新
|
270次组卷
|
2卷引用:鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 易错疑难集训(一)
6 . 如图表示外界条件(温度、压强)的变化对反应: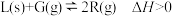 的影响,则在图中Y表示( )
的影响,则在图中Y表示( )

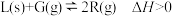 的影响,则在图中Y表示( )
的影响,则在图中Y表示( )
| A.平衡混合气体中R的质量分数 | B.平衡混合气体中G的体积分数 |
| C.G的平衡转化率 | D.L的平衡转化率 |
您最近一年使用:0次
7 . 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )

根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ: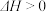 , ,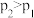 |
B.反应Ⅱ: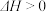 , , |
C.反应Ⅲ: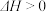 , , 或 或 , , |
D.反应Ⅳ: , , |
您最近一年使用:0次
解题方法
8 . 哈伯发明用氮气和氢气合成氨的方法,获得了1918年诺贝尔化学奖。其原理为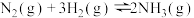
 ,
,
________ (填“>”“<”或“=”)0。
(1)下列关于工业合成氨的说法不正确的是__________ (填标号)。
A.因为 ,所以该反应一定能自发进行
,所以该反应一定能自发进行
B.采用高压是为了增大反应速率,但会使反应物的转化率降低
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂增大反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是________ (填标号)。
a.容器内 、
、 、
、 的浓度之比为1∶3∶2
的浓度之比为1∶3∶2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如图:
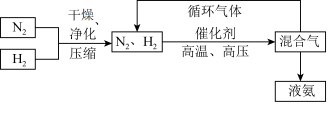
请用平衡移动原理解释在工艺流程中及时分离出氨气和将 分离后的原料气循环使用的原因
分离后的原料气循环使用的原因___________________ 。
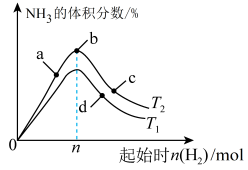
(4)某科研小组研究在其他条件不变的情况下,改变起始时氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示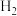 的物质的量)。
的物质的量)。
①图中 和
和 的关系:
的关系:
________ (填“>”“<”或“=”) 。
。
②a、b、c、d四点所处的平衡状态中, 的转化率最高的是
的转化率最高的是__________ (填字母)。
(5)恒温下,向一个4L的密闭容器中充入5.2mol 和2mol
和2mol ,反应过程中对
,反应过程中对 的浓度进行测定,得到的数据如表所示:
的浓度进行测定,得到的数据如表所示:
①此条件下该反应的化学平衡常数
________ 。
②若维持容器容积不变,温度不变,向原平衡体系中加入 、
、 和
和 各4mol,化学平衡将向
各4mol,化学平衡将向_______ (填“正”或“逆”)反应方向移动。
(6)已知: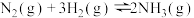
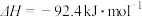
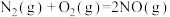
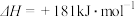
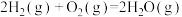
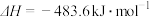
写出氨气催化氧化生成NO和水蒸气的热化学方程式________________ 。
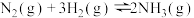
 ,
,
(1)下列关于工业合成氨的说法不正确的是
A.因为
 ,所以该反应一定能自发进行
,所以该反应一定能自发进行B.采用高压是为了增大反应速率,但会使反应物的转化率降低
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂增大反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a.容器内
 、
、 、
、 的浓度之比为1∶3∶2
的浓度之比为1∶3∶2b.

c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如图:

请用平衡移动原理解释在工艺流程中及时分离出氨气和将
 分离后的原料气循环使用的原因
分离后的原料气循环使用的原因(4)某科研小组研究在其他条件不变的情况下,改变起始时氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示
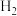 的物质的量)。
的物质的量)。①图中
 和
和 的关系:
的关系:
 。
。②a、b、c、d四点所处的平衡状态中,
 的转化率最高的是
的转化率最高的是
(5)恒温下,向一个4L的密闭容器中充入5.2mol
 和2mol
和2mol ,反应过程中对
,反应过程中对 的浓度进行测定,得到的数据如表所示:
的浓度进行测定,得到的数据如表所示:时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

②若维持容器容积不变,温度不变,向原平衡体系中加入
 、
、 和
和 各4mol,化学平衡将向
各4mol,化学平衡将向(6)已知:
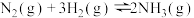
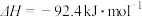
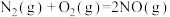
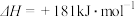
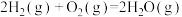
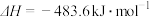
写出氨气催化氧化生成NO和水蒸气的热化学方程式
您最近一年使用:0次
2020-10-05更新
|
252次组卷
|
3卷引用:人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第四节 化学反应的调控 方法帮
人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第四节 化学反应的调控 方法帮(已下线)专题2.4 化学反应的调控(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)云南省昭通市2022-2023学年高二下学期期中考试化学试题
名校
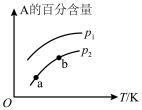
9 . 某化学研究小组探究外界条件(压强、温度)对化学反应 平衡的影响图象如图所示,下列判断正确的是( )
平衡的影响图象如图所示,下列判断正确的是( )
 平衡的影响图象如图所示,下列判断正确的是( )
平衡的影响图象如图所示,下列判断正确的是( )
| A.由图可知,该反应的正反应为吸热反应 |
B.由图可知,若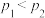 ,则该反应中 ,则该反应中 |
C.图中,点a和点b的反应速率大小为 |
| D.当反应达到平衡时,只加入催化剂,A的百分含量将发生变化 |
您最近一年使用:0次
2020-10-05更新
|
106次组卷
|
6卷引用:广东省2019-2020学年高二下学期期末考试化学试题
广东省2019-2020学年高二下学期期末考试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)广东省云浮市2019-2020学年高二下学期期末考试化学试题吉林省长春市实验中学2020-2021学年高二上学期开学考试化学试题(已下线)2.3.2影响化学平衡状态的因素(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)内蒙古喀喇沁旗锦山蒙古族中学2021-2022学年高二上学期第二次调研考试化学试题
名校
10 . 已知可逆反应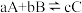 中,5min时在不同温度下物质A、C的质量分数
中,5min时在不同温度下物质A、C的质量分数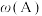 和
和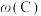 的变化曲线如图所示,下列说法正确的是
的变化曲线如图所示,下列说法正确的是
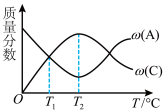
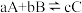 中,5min时在不同温度下物质A、C的质量分数
中,5min时在不同温度下物质A、C的质量分数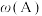 和
和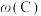 的变化曲线如图所示,下列说法正确的是
的变化曲线如图所示,下列说法正确的是
A.该反应在 ℃时达到化学平衡 ℃时达到化学平衡 | B.该反应在 ℃时达到化学平衡 ℃时达到化学平衡 |
| C.该反应的逆反应是放热反应 | D.升高温度,平衡向正反应方向移动 |
您最近一年使用:0次
2020-10-04更新
|
194次组卷
|
2卷引用:人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡