1 . 乙烯是合成多种塑料的单体。我国科学家开发的特殊催化剂用 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。
主反应: 放热反应
放热反应
(1)在容积为2L的恒容密闭容器中充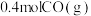 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内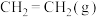 的平均反应速率为
的平均反应速率为___________ 。
(2)在一定温度下,向恒容密闭容器中充入 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是___________ (填编号)。
A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高 平衡转化率的措施是
平衡转化率的措施是___________ (任填一条)。
(3)下列事实中,不能用勒夏特列原理解释的是_______。
(4)下图表示反应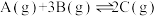 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。主反应:
 放热反应
放热反应(1)在容积为2L的恒容密闭容器中充
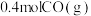 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内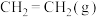 的平均反应速率为
的平均反应速率为(2)在一定温度下,向恒容密闭容器中充入
 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高
 平衡转化率的措施是
平衡转化率的措施是(3)下列事实中,不能用勒夏特列原理解释的是_______。
A.反应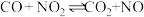 (放热反应),升高温度平衡向逆反应方向移动 (放热反应),升高温度平衡向逆反应方向移动 |
B.采用高压有利于合成氨反应: |
C.使用催化剂有利于合成氨反应: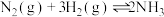 |
D.氯水中有下列平衡: ,当加入 ,当加入 溶液后溶液颜色变浅 溶液后溶液颜色变浅 |
(4)下图表示反应
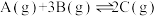 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。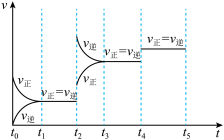
A. | B. | C. | D. |
您最近半年使用:0次
名校
解题方法
2 . 绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措,可以用以下方法制备氢气。
Ⅰ.甲烷和水蒸气催化制氢气。主要反应如下:
i.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.2kJ•mol-1
ii.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2kJ•mol-1
(1)反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的 ΔH=___________ kJ•mol-1。
(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是___________ (填标号)。
A.气体混合物的密度不再变化
B.CH4消耗速率和H2的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。
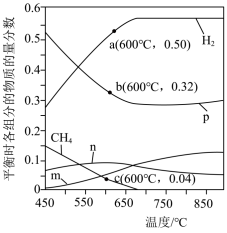
①图中表示CO2的物质的量分数与温度的变化曲线是___________ (填字母)。
②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是___________ (填标号)。
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是________ 。
③600℃时,反应ii的平衡常数的计算式为Kp=___________ (Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅱ.“氰化提金”产生的废水中含有一定量的 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:
(4)25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
①将少量 通入NaCN溶液中,反应的离子方程式是
通入NaCN溶液中,反应的离子方程式是___________ 。
②常温下,在 溶液中加入
溶液中加入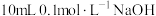 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是___________ 。
Ⅰ.甲烷和水蒸气催化制氢气。主要反应如下:
i.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.2kJ•mol-1
ii.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2kJ•mol-1
(1)反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的 ΔH=
(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是
A.气体混合物的密度不再变化
B.CH4消耗速率和H2的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。

①图中表示CO2的物质的量分数与温度的变化曲线是
②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是
③600℃时,反应ii的平衡常数的计算式为Kp=
Ⅱ.“氰化提金”产生的废水中含有一定量的
 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:(4)25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
| 酸 | HCN |  |
 | 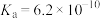 |   |
 通入NaCN溶液中,反应的离子方程式是
通入NaCN溶液中,反应的离子方程式是②常温下,在
 溶液中加入
溶液中加入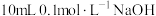 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是
您最近半年使用:0次
3 . 以 为原料炼铁,主要发生如下反应:
为原料炼铁,主要发生如下反应:
反应I: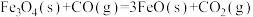
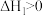
反应Ⅱ:

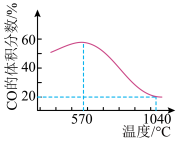
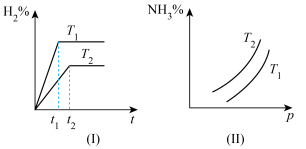
将一定体积CO 通入装有 粉末的反应器,其它条件不变,反应达平衡,测得 CO的体积分数随温度的变化关系如图所示。下列说法错误的是
粉末的反应器,其它条件不变,反应达平衡,测得 CO的体积分数随温度的变化关系如图所示。下列说法错误的是
 为原料炼铁,主要发生如下反应:
为原料炼铁,主要发生如下反应:反应I:
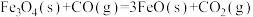
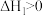
反应Ⅱ:


将一定体积CO 通入装有
 粉末的反应器,其它条件不变,反应达平衡,测得 CO的体积分数随温度的变化关系如图所示。下列说法错误的是
粉末的反应器,其它条件不变,反应达平衡,测得 CO的体积分数随温度的变化关系如图所示。下列说法错误的是
A. <0 <0 |
| B.在恒温、恒容条件下, 当容器压强保持不变,反应Ⅰ、 Ⅱ均达到平衡状态 |
| C.1040℃时, 反应Ⅰ的化学平衡常数K=4 |
D.反应温度较高时,  主要还原产物为 FeO 主要还原产物为 FeO |
您最近半年使用:0次
解题方法
4 . 对于反应N2(g)+3H2(g) 2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?
2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?_____
 2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?
2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?
您最近半年使用:0次
名校
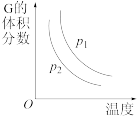
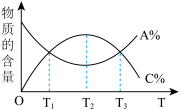
5 . 根据相应的图像,下列相关说法正确的是
| 甲 | 乙 | 丙 | 丁 |
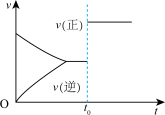 |  |  |  |
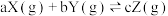 | 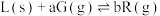 |  |  |
A.图甲所示,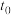 时改变的条件一定是加入了正催化剂 时改变的条件一定是加入了正催化剂 |
B.图乙所示,若 ,则a>b ,则a>b |
C.图丙所示,平衡时C的百分含量 比 比 低 低 |
| D.图丁所示,该反应中C一定是气体 |
您最近半年使用:0次
2023-09-17更新
|
628次组卷
|
6卷引用:河北省邢台市第一中学2022-2023学年高二上学期期末考试化学试题
河北省邢台市第一中学2022-2023学年高二上学期期末考试化学试题(已下线)专题04 化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)(已下线)寒假收官卷01-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)湖北省沙市中学2023-2024学年高二上学期1月期末化学试题黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学验收考试化学黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学化学试题
名校
6 . T℃时,在2L恒容密闭容器中进行反应:X(g)+Y(g)→Z(g)(未配平)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
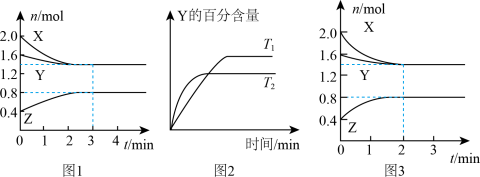

A.反应方程式为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.0~3min,反应速率v(Z)=0.067mol∙L-1∙min-1 |
| C.其他条件不变,升高温度,化学平衡正向移动 |
| D.如图3所示的反应进程,改变的条件可能是增大压强 |
您最近半年使用:0次
2023-09-17更新
|
165次组卷
|
2卷引用:浙江省海宁市高级中学2022-2023学年高二上学期10月月考化学试题
7 . “先拐先平”原则
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g) cC(g)为例]。
cC(g)为例]。
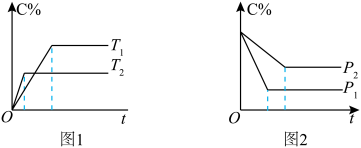
根据图像回答下列问题:
(1)图1中,温度T1、T2的大小关系是___________ ,温度升高,C%(C的含量)的变化是___________ ,化学平衡___________ 移动,正反应是___________ 反应。
(2)图2中,压强p1、p2的大小关系是___________ ,压强增大,C%(C的含量)的变化是___________ ,化学平衡___________ 移动,a+b___________ c。
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g)
 cC(g)为例]。
cC(g)为例]。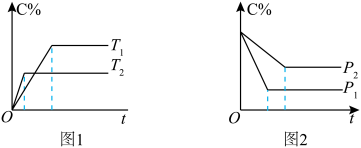
根据图像回答下列问题:
(1)图1中,温度T1、T2的大小关系是
(2)图2中,压强p1、p2的大小关系是
您最近半年使用:0次
名校
解题方法
8 . 氮是地球上含量丰富的一种元素,氮及其化合物是科学研究的重点内容:在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
请回答下列问题:
(1)试比较K1、K2的大小,K1___________ K2(填“>”、“=”或“<”)。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是___________ (填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.3v正(N2)=v逆(H2)
c.v正(NH3)=v逆(NH3)
d.混合气体的密度保持不变
(3)400℃时,反应2NH3(g) N2(g)+3H2(g)的平衡常数K=
N2(g)+3H2(g)的平衡常数K=___________ 。当测得NH3、N2、H2的浓度分别为3mol⋅L−1、2mol⋅L−1、1mol⋅L−1时,则该反应的v正(N2)___________ v逆(N2)(填“>”、“=”或“<”)。
(4)下图为一定温度下,N2和H2以1:3进行反应,平衡时,NH3的体积分数随压强的变化示意图
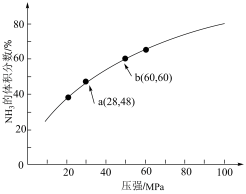
①随压强增大,NH3的体积分数增大的原因是___________ 。
②比较b点和a点:平衡常数K(a)___________ K(b)(填“>”、“<”或“=”,下同),N2的浓度c(a)___________ c(b)。
③计算b点的平衡常数Kp=___________ (Mpa)-2(用分压表示的平衡常数,结果保留2位有效数字)
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1
(2)下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.3v正(N2)=v逆(H2)
c.v正(NH3)=v逆(NH3)
d.混合气体的密度保持不变
(3)400℃时,反应2NH3(g)
 N2(g)+3H2(g)的平衡常数K=
N2(g)+3H2(g)的平衡常数K=(4)下图为一定温度下,N2和H2以1:3进行反应,平衡时,NH3的体积分数随压强的变化示意图

①随压强增大,NH3的体积分数增大的原因是
②比较b点和a点:平衡常数K(a)
③计算b点的平衡常数Kp=
您最近半年使用:0次
2023-06-07更新
|
789次组卷
|
2卷引用:广东省华南师范大学附属中学2022-2023学年高二上学期1月期末化学试题
名校
解题方法
9 . 二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g) CH3COOCH3(g)△H1<0
CH3COOCH3(g)△H1<0
反应Ⅱ:CH3COOCH3(g)+2H2(g) CH3CH2OH(g)+CH3OH(g)△H2<0
CH3CH2OH(g)+CH3OH(g)△H2<0
在固定 CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ, 平衡时各物质的物质的量分数随温度的变化如图所示。下列说法正确的是
反应Ⅰ:CO(g)+CH3OCH3(g)
 CH3COOCH3(g)△H1<0
CH3COOCH3(g)△H1<0反应Ⅱ:CH3COOCH3(g)+2H2(g)
 CH3CH2OH(g)+CH3OH(g)△H2<0
CH3CH2OH(g)+CH3OH(g)△H2<0在固定 CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ, 平衡时各物质的物质的量分数随温度的变化如图所示。下列说法正确的是

| A.曲线 B 表示 H2的物质的量分数随温度的变化 |
| B.600 K 后升高温度,CH3COOCH3的物质的量分数降低原因是反应Ⅱ平衡右移 |
| C.测得 X 点 CH3CH2OH 的物质的量分数是 10%,则 X 点反应Ⅱ有:v 正>v 逆 |
| D.其他条件不变,延长反应时间能提高平衡混合物中乙醇含量 |
您最近半年使用:0次
2023-04-15更新
|
278次组卷
|
4卷引用:江苏省连云港市赣榆区2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
10 . 在容积不变的密闭容器中, 和
和 发生反应:
发生反应: 。温度分别为
。温度分别为 和
和 时,
时, 的体积分数
的体积分数 随时间的变化如图所示,下列说法正确的是
随时间的变化如图所示,下列说法正确的是

 和
和 发生反应:
发生反应: 。温度分别为
。温度分别为 和
和 时,
时, 的体积分数
的体积分数 随时间的变化如图所示,下列说法正确的是
随时间的变化如图所示,下列说法正确的是
A.该反应的 |
B.温度为 时, 时, 的平衡转化率为80% 的平衡转化率为80% |
C.加入适当的催化剂,目的是加快反应速率,提高 的产率 的产率 |
D.温度为 时的化学平衡常数 时的化学平衡常数 大于 大于 时的化学平衡常数 时的化学平衡常数 |
您最近半年使用:0次
2023-02-18更新
|
582次组卷
|
13卷引用:湖南省湖湘名校联盟2021-2022学年高二上学期期末考试化学试题
湖南省湖湘名校联盟2021-2022学年高二上学期期末考试化学试题湖南省湘潭县2021-2022学年高二上学期期末考试化学试题(已下线)专题25 关于化学平衡的计算-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)广西玉林市普通高中2021-2022学年高二上学期期末考试理科综合化学试题(已下线)2.2.3 化学反应速率与平衡图像专题 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)广东省江门市培英高级中学2022-2023学年高二上学期期中考试化学试题浙江省金华市横店高中2022-2023学年高二上学期10月份检测化学试题吉林省长春市农安县教师进修学校2022-2023学年高二上学期期末考试化学试题广东省汕尾市2022-2023学年高二上学期期末考试化学试题广东省华南师范大学附属中学2022-2023学年高二上学期期中考试化学试题广东省广州市实验外语学校2023-2024学年高二上学期11月期中考试化学试题广东省广州市第四十一中学2023-2024学年高二上学期期中考试化学试题江西省抚州市2022-2023学年高二上学期学生学业质量监测化学试题



