解题方法
1 . 一定条件下,在水溶液中1molCl-、ClOx-(x=1、2、3、4)的能量(kJ)相对大小如图所示。下列说法正确的是( )
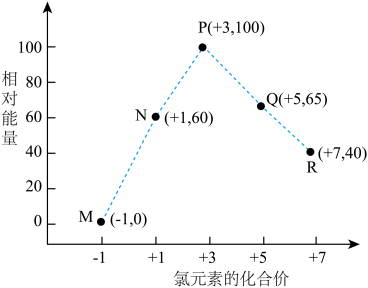

| A.P点对应的微粒最稳定 |
| B.R点微粒氧化性最强 |
| C.由N点到M点的焓变为60kJ·mol-1 |
| D.P点微粒发生歧化反应转化为N点和Q点微粒属于自发过程 |
您最近一年使用:0次
真题
2 . 下列说法不正确的是
| A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
B.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的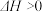 |
| C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
D.相同条件下,溶液中 、 、 、 、 的氧化性依次减弱 的氧化性依次减弱 |
您最近一年使用:0次
2019-01-30更新
|
101次组卷
|
6卷引用:09~10年南京六中高二下学期期末考试
名校
3 . (1)用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

①该实验探究的是___ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是___ >___ (填实验序号)。
②若实验I在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO )=
)=___ mol·L-1(假设混合溶液的体积为50mL)。
③除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___ 来比较化学反应速率。
④小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:___ ,产物Mn2+是反应的催化剂。
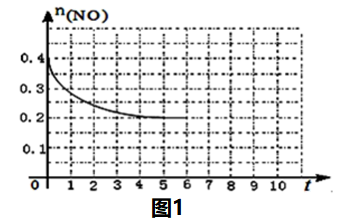
(2)①在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。则该反应在(填“高温”“低温”或“任何温度”)
N2(g)+2CO2(g) ΔH<0。则该反应在(填“高温”“低温”或“任何温度”)___ 下能自发进行。
②在某温度下,2L密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图1所示,5min末反应达到平衡。第6min继续加入0.2mol NO、0.2mol CO、0.2mol CO2和0.3mol N2,请在图1中画出到9min末反应达到平衡NO的物质的量随时间的变化曲线___ 。
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
| 实验序号 | A溶液 | B溶液 |
| I | 20mL 0.1mol/L H2C2O4溶液 | 30mL 0.01mol/L KMnO4溶液 |
| II | 20mL 0.2mo/L H2C2O4溶液 | 30mL 0.01mol/L KMnO4溶液 |
①该实验探究的是
②若实验I在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO
 )=
)=③除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
④小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
(2)①在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH<0。则该反应在(填“高温”“低温”或“任何温度”)
N2(g)+2CO2(g) ΔH<0。则该反应在(填“高温”“低温”或“任何温度”)②在某温度下,2L密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图1所示,5min末反应达到平衡。第6min继续加入0.2mol NO、0.2mol CO、0.2mol CO2和0.3mol N2,请在图1中画出到9min末反应达到平衡NO的物质的量随时间的变化曲线

您最近一年使用:0次
14-15高三上·江苏盐城·期中
名校
4 . 下列有关说法正确的是
| A.电解精炼铜时,粗铜与外接电源的负极相连 |
| B.2Na2O2 + 2CO2 = 2Na2CO3 + O2在常温下能自发进行,则该反应的△H>0 |
| C.由PbO2 +4HCl(浓)= PbCl2 + Cl2↑+2H2O 可确定氧化性:PbO2>Cl2 |
| D.常温下,用蒸馏水不断稀释醋酸,溶液中c(CH3COO-)/c(CH3COOH)的值不变 |
您最近一年使用:0次
2016-08-19更新
|
159次组卷
|
5卷引用:2015-2016学年山东省苍山二中高二下6月月考化学试卷
名校
5 . 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
(1)该反应的离子方程式为_______ 。
(2)探究温度对化学反应速率影响的实验编号是________ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________ 。
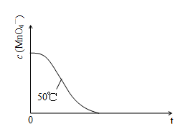
(3)已知50 ℃时c(MnO4—)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4—)~t的变化曲线示意图_____ 。
(4)在25 ℃、101 kPa时,1 g CH4完全燃烧生成液态水时放出的热量是55.0kJ,则表示甲烷燃烧热的热化学方程式是____________________________ 。
(5)已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示。该反应是一个______________ (填“熵增”或“熵减”)的反应。下列有关该反应的叙述中正确的是______ 。
A.该反应是放热反应
B.该反应的ΔH=-(E1-E2) kJ· mol-1
C.该反应中反应物的键能总和大于生成物的键能总和
D.由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为
(2)探究温度对化学反应速率影响的实验编号是
(3)已知50 ℃时c(MnO4—)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4—)~t的变化曲线示意图

(4)在25 ℃、101 kPa时,1 g CH4完全燃烧生成液态水时放出的热量是55.0kJ,则表示甲烷燃烧热的热化学方程式是
(5)已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示。该反应是一个
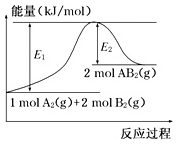
A.该反应是放热反应
B.该反应的ΔH=-(E1-E2) kJ· mol-1
C.该反应中反应物的键能总和大于生成物的键能总和
D.由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
您最近一年使用:0次



