解题方法
1 . 在强碱中氢氧化铁可被一些氧化剂氧化为高铁酸根离子(FeO ),FeO
),FeO 在酸性条件下氧化性极强且不稳定, Fe3O4 中铁元素有2、3价;H2O2可在催化剂Fe2O3或Fe3O4作用下产生OH,OH能将烟气中的NO、SO2氧化。OH产生机理如下:
在酸性条件下氧化性极强且不稳定, Fe3O4 中铁元素有2、3价;H2O2可在催化剂Fe2O3或Fe3O4作用下产生OH,OH能将烟气中的NO、SO2氧化。OH产生机理如下:
反应Ⅰ: Fe3 H2O2 = Fe2 + OOH H (慢反应)
反应Ⅱ:Fe2 H2O2 = Fe3 OH OH- (快反应)
对于H2O2 脱除SO2反应:SO2 g H2O2 l =H2SO4 l ,下列有关说法不正确 的是
 ),FeO
),FeO 在酸性条件下氧化性极强且不稳定, Fe3O4 中铁元素有2、3价;H2O2可在催化剂Fe2O3或Fe3O4作用下产生OH,OH能将烟气中的NO、SO2氧化。OH产生机理如下:
在酸性条件下氧化性极强且不稳定, Fe3O4 中铁元素有2、3价;H2O2可在催化剂Fe2O3或Fe3O4作用下产生OH,OH能将烟气中的NO、SO2氧化。OH产生机理如下: 反应Ⅰ: Fe3 H2O2 = Fe2 + OOH H (慢反应)
反应Ⅱ:Fe2 H2O2 = Fe3 OH OH- (快反应)
对于H2O2 脱除SO2反应:SO2 g H2O2 l =H2SO4 l ,下列有关说法
| A.该反应能自发进行,则该反应的ΔH 0 |
| B.加入催化剂 Fe2O3,可提高SO2 的脱除效率 |
| C.向固定容积的反应体系中充入氦气,反应速率加快 |
| D.与Fe2O3作催化剂相比,相同条件下Fe3O4作催化剂时SO2 脱除效率可能更高 |
您最近一年使用:0次
解题方法
2 . 碳、氮化合物在生产、生活中具有重要作用。回答下列问题:
(1)已知在298K和101KPa条件下,有如下反应:
反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
①汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),其反应热ΔH=______ ,该反应能自发进行的条件是______ (填“低温”或“高温”)。
②在恒容密闭容器中发生Ⅳ的反应,下列有关该反应的说法中正确的是____ (填字母)。
A.升高温度,平衡常数减小
B.体系达到平衡后,加入催化剂,平衡正向移动
C.增大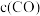 ,平衡逆向移动,NO的转化率降低
,平衡逆向移动,NO的转化率降低
D.其他条件不变,向平衡体系充入CO2气体,K值减小
E.该反应过程中,气体的密度始终保持不变
(2)氮的一种氢化物是HN3,其水溶液酸性与醋酸相似,常温下,将a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N ),则该混合物溶液呈
),则该混合物溶液呈_____ (填“酸”“碱”或“中”)性,混合液中c(HN3)=_____ mol·L-1。
(3)利用电解法可以消除废水溶液中CN-,其原理为:碱性条件下,阳极Cl-先转化为ClO-,再将CN-氧化为两种无污染的气体。
①阳极电极反应式为_____ 。
②阳极附近溶液中除去CN-的离子方程式为______ 。
(1)已知在298K和101KPa条件下,有如下反应:
反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
①汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),其反应热ΔH=
②在恒容密闭容器中发生Ⅳ的反应,下列有关该反应的说法中正确的是
A.升高温度,平衡常数减小
B.体系达到平衡后,加入催化剂,平衡正向移动
C.增大
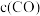 ,平衡逆向移动,NO的转化率降低
,平衡逆向移动,NO的转化率降低D.其他条件不变,向平衡体系充入CO2气体,K值减小
E.该反应过程中,气体的密度始终保持不变
(2)氮的一种氢化物是HN3,其水溶液酸性与醋酸相似,常温下,将a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N
 ),则该混合物溶液呈
),则该混合物溶液呈(3)利用电解法可以消除废水溶液中CN-,其原理为:碱性条件下,阳极Cl-先转化为ClO-,再将CN-氧化为两种无污染的气体。
①阳极电极反应式为
②阳极附近溶液中除去CN-的离子方程式为
您最近一年使用:0次
解题方法
3 . 某化学兴趣小组为了研究部分ⅥA族元素及其化合物的部分性质,查阅资料如下:
①酸性: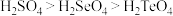 ;
;
②O、S、 与
与 的化合越来越难,
的化合越来越难, 与
与 不能直接化合;
不能直接化合;
③由不同元素的单质生成等物质的量的氢化物的焓变情况如图所示。
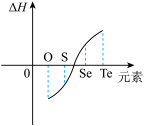
请回答下列问题:
(1)S与 的化合反应
的化合反应_________ (填“吸收”或“放出”)热量。
(2)已知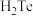 的分解反应的
的分解反应的 ,请解释
,请解释 与
与 不能直接化合的原因
不能直接化合的原因______________ 。
(3)题述信息中能说明S的非金属性强于 的是
的是_________ (填序号)。
①酸性:
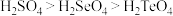 ;
;②O、S、
 与
与 的化合越来越难,
的化合越来越难, 与
与 不能直接化合;
不能直接化合;③由不同元素的单质生成等物质的量的氢化物的焓变情况如图所示。

请回答下列问题:
(1)S与
 的化合反应
的化合反应(2)已知
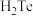 的分解反应的
的分解反应的 ,请解释
,请解释 与
与 不能直接化合的原因
不能直接化合的原因(3)题述信息中能说明S的非金属性强于
 的是
的是
您最近一年使用:0次
2020-09-16更新
|
505次组卷
|
4卷引用:鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第1节 化学反应的方向
鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第1节 化学反应的方向(已下线)2.2.1 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)2.3 化学反应进行的方向——同步学习必备知识作业(九) 化学反应的方向
名校
解题方法
4 . 一定条件下用甲烷可以消除氮氧化物(NOx)的污染。
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
下列选项正确的是
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
下列选项正确的是
| A.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-867 kJ·mol-1 |
| B.若把反应①设计为燃料电池,在碱性条件下负极的电极反应式为:CH4-8e-+8OH-=CO2+6H2O |
| C.反应①在任何温度下都能自发进行 |
| D.在其他条件不变的情况下,增大压强有利于提高氮氧化物的消除率 |
您最近一年使用:0次
名校
5 . 完成下列填空
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=−534 kJ∙mol−1
H2O2(l)=H2O(l)+ O2(g) ΔH=−98 kJ∙mol−1
O2(g) ΔH=−98 kJ∙mol−1
H2O(l)=H2O(g) ΔH=44 kJ∙mol−1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式:_______ 。
(2)反应的自发性由焓变和熵变两个因素决定。N2(g)+O2(g)=2NO(g),已知N≡N的键能为946 kJ∙mol−1,O=O键的键能为498 kJ∙mol−1,N≡O的键能为630 kJ∙mol−1;该反应的ΔH=_______ ,其反应自发的原因是_______ 。
(3)以纯铜作阴极,以石墨作阳极,电解某浓度的硫酸铜溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入16.0gCuO固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)_______ L。
(4)科学家设计利用电化学原理回收CO2达到减排的目的,实验装置如图所示。
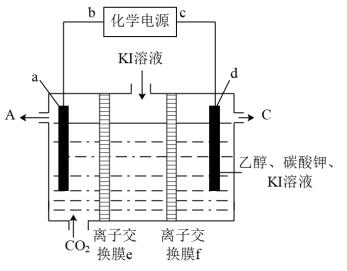
已知在碱性条件下,卤素单质可以和乙醇反应。假设理想状态下,该装置能将a电极的CO2全部转化成HCOO-。
①则b为_______ 极(填“正”或“负”),a电极的电极反应式为_______ 。
②标准状况下,当有4mol电子转移时,回收的 CO2为_______ L。
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=−534 kJ∙mol−1
H2O2(l)=H2O(l)+
 O2(g) ΔH=−98 kJ∙mol−1
O2(g) ΔH=−98 kJ∙mol−1H2O(l)=H2O(g) ΔH=44 kJ∙mol−1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式:
(2)反应的自发性由焓变和熵变两个因素决定。N2(g)+O2(g)=2NO(g),已知N≡N的键能为946 kJ∙mol−1,O=O键的键能为498 kJ∙mol−1,N≡O的键能为630 kJ∙mol−1;该反应的ΔH=
(3)以纯铜作阴极,以石墨作阳极,电解某浓度的硫酸铜溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入16.0gCuO固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)
(4)科学家设计利用电化学原理回收CO2达到减排的目的,实验装置如图所示。

已知在碱性条件下,卤素单质可以和乙醇反应。假设理想状态下,该装置能将a电极的CO2全部转化成HCOO-。
①则b为
②标准状况下,当有4mol电子转移时,回收的 CO2为
您最近一年使用:0次
6 . 含氮化合物对工业生产有多种影响,化学工作者设计了如下再利用的方案:
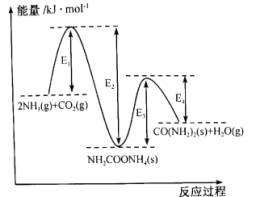
(1)以NH3和CO2为原料合成化肥-尿素 ,两步反应的能量变化如图:
,两步反应的能量变化如图:
①该反应在_______ (填“高温”“低温”或“任何温度”)下能自发进行。
②已知第二步反应决定了生产尿素的快慢,可推测
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③该反应达到化学平衡后,下列措施能提高NH3转化率的是_______ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)氨的催化氧化过程可发生以下两种反应,该过程易受催化剂选择性影响。
I:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H<0;
II: ;
;
在容积固定的密闭容器中充入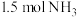 和
和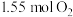 ,一定时间段内,在催化剂作用下发生上述反应。生成物NO和
,一定时间段内,在催化剂作用下发生上述反应。生成物NO和 的物质的量随温度的变化曲线如图。
的物质的量随温度的变化曲线如图。
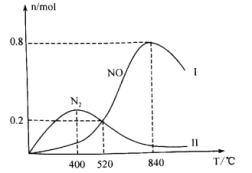
①当温度处于400℃~840℃时, 的物质的量减少,NO的物质的量增加,其原因是
的物质的量减少,NO的物质的量增加,其原因是_______ 。
②840℃时, 的转化率为
的转化率为_______ 。(保留小数点后2位,下同);若520℃时起始压强为p0,恒温下反应II的平衡常数
_______ 。( 为以分压表示的平衡常数)
为以分压表示的平衡常数)
(3)肼(N2H4)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式:_______ 。假设使用肼-空气燃料电池电解精炼铜,阴极质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气_______ L(假设空气中氧气体积分数为20%)。

(1)以NH3和CO2为原料合成化肥-尿素
 ,两步反应的能量变化如图:
,两步反应的能量变化如图:①该反应在
②已知第二步反应决定了生产尿素的快慢,可推测

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③该反应达到化学平衡后,下列措施能提高NH3转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)氨的催化氧化过程可发生以下两种反应,该过程易受催化剂选择性影响。
I:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H<0;
II:
 ;
;在容积固定的密闭容器中充入
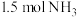 和
和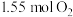 ,一定时间段内,在催化剂作用下发生上述反应。生成物NO和
,一定时间段内,在催化剂作用下发生上述反应。生成物NO和 的物质的量随温度的变化曲线如图。
的物质的量随温度的变化曲线如图。
①当温度处于400℃~840℃时,
 的物质的量减少,NO的物质的量增加,其原因是
的物质的量减少,NO的物质的量增加,其原因是②840℃时,
 的转化率为
的转化率为
 为以分压表示的平衡常数)
为以分压表示的平衡常数)(3)肼(N2H4)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式:
您最近一年使用:0次
7 . 为节约资源,许多重要的化工产品可以进行联合生产。如氯碱工业、金属钛的冶炼工业、甲醇的合成工业可以进行联合生产。联合生产时的物质转化如下图所示:
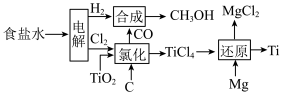
部分反应的热化学方程式为:
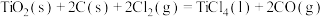
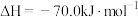



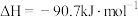
下列关于联合生产的有关说法正确的是

部分反应的热化学方程式为:
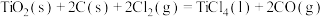
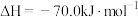



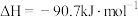
下列关于联合生产的有关说法正确的是
A.通过电解 溶液可以实现镁的再生 溶液可以实现镁的再生 |
| B.电解饱和食盐水时,阴极附近溶液pH升高 |
C.甲醇与氧气在碱性环境下形成的燃料电池中,正极的电极反应式为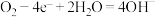 |
D.反应 在任何条件下均不能自发进行 在任何条件下均不能自发进行 |
您最近一年使用:0次
名校
8 . 一定条件下,在水溶液中1molCl-、ClO (x=1、2、3、4)的能量(kJ)相对大小如图所示。下列说法正确的是
(x=1、2、3、4)的能量(kJ)相对大小如图所示。下列说法正确的是
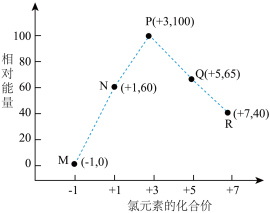
 (x=1、2、3、4)的能量(kJ)相对大小如图所示。下列说法正确的是
(x=1、2、3、4)的能量(kJ)相对大小如图所示。下列说法正确的是
| A.P点对应的微粒最稳定 |
| B.R点微粒化合价最高,氧化性最强 |
C. 反应的焓变为 ΔH=-20kJ· mol-1 反应的焓变为 ΔH=-20kJ· mol-1 |
| D.P点微粒发生歧化反应转化为N点和Q点微粒属于非自发过程 |
您最近一年使用:0次
2023-12-14更新
|
121次组卷
|
3卷引用:安徽省黄山市屯溪第一中学2022-2023学年高二上学期期中质量检测(选择性考试) 化学试题
9 . Ⅰ.铁触媒催化合成氨经历下图所示①至⑥步基元反应(从状态Ⅰ至状态Ⅶ):
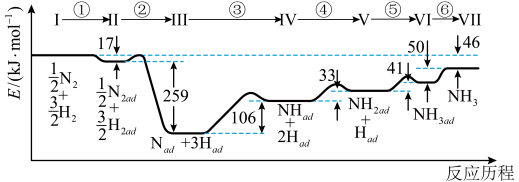
上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=___________ 。
(2)上述反应的ΔS___ 0(填“>”“<”或“=”)。已知:反应N2(g)+3H2(g) 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是____ (填标号)。
A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。
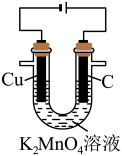
以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH______ (填“升高”“降低”或“不变”)。
(4)铜极、石墨极能否互换并简述理由:___________ 。
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中_______ (填离子符号)向左烧杯迁移。
(6)石墨极的电极反应式为_______ 。实验结论是氧化性:
___  (填>”“<”或“=”)。
(填>”“<”或“=”)。

上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g)
 2NH3(g) ΔH=
2NH3(g) ΔH=(2)上述反应的ΔS
 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。

以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH
(4)铜极、石墨极能否互换并简述理由:
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中
(6)石墨极的电极反应式为

 (填>”“<”或“=”)。
(填>”“<”或“=”)。
您最近一年使用:0次
2024-02-02更新
|
144次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题
名校
10 . 下列叙述正确的是
A.在浓硫酸中滴加浓盐酸,产生 的原因是升温促进平衡 的原因是升温促进平衡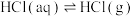 向右移动 向右移动 |
| B.从海水中提取溴,通入氯气之前用硫酸酸化的目的是增强氯气的氧化性 |
C.在高温下,CO分解生成 和 和 能自发进行 能自发进行 |
| D.铝和硫酸反应生成氢气,硫酸浓度越大,氢气生成速率越快 |
您最近一年使用:0次
2023-11-22更新
|
63次组卷
|
2卷引用:山东省部分名校2023-2024学年高二上学期11月期中调研考试化学试题



