名校
1 . 下列内容与结论对应关系正确的是
| 选项 | 内容 | 结论 |
| A | H2O(l)变成H2O(g) | 该过程的△S>0 |
| B | NaOH固体溶于水时体系温度升高 | NaOH电离时△H<0 |
| C | 一个反应的△H<0,△S>0 | 该反应在任何条件均能发生 |
| D | I2(g)+H2(g)=2HI(g) △H=-9.48kJ•mol-1 | 该反应△S=0,但因△H<0,所以在一定温度下可自发进行 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-15更新
|
123次组卷
|
2卷引用:浙江省A9协作体2021-2022学年高二上学期期中联考化学试题
名校
解题方法
2 . I.工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,反应为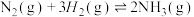
 ,
,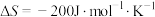 。请回答下列问题:
。请回答下列问题:
(1)常温下,合成氨反应________ (填“能”或“不能”)自发进行,其平衡常数表达式K=________ 。
(2)________ 温(填“高”或“低”)有利于提高反应速率,________ 温(填“高”或“低”)有利于提高平衡转化率,综合考虑催化剂活性等因素,工业常采用400∼500℃。
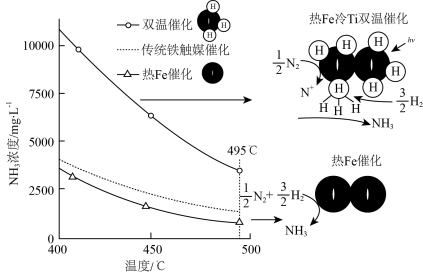
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2·xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2·xHy的温度为415℃)。(纵坐标为反应达平衡时NH3的浓度)________________ 。
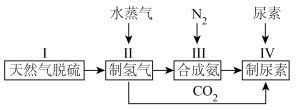
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下: ,
, ,恒容容器中,对于以上反应,能加快反应速率的是
,恒容容器中,对于以上反应,能加快反应速率的是________ 。
A.升高温度 B.充入He C.加入催化剂
(5)已知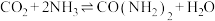 ,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成
,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成________ 吨尿素。
Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:________ ;
(7)在b点,溶液中各离子浓度由大到小的排列顺序是________ ;
(8)在cd段发生反应的离子方程式为________ 。
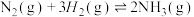
 ,
,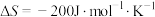 。请回答下列问题:
。请回答下列问题:(1)常温下,合成氨反应
(2)
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2·xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2·xHy的温度为415℃)。(纵坐标为反应达平衡时NH3的浓度)
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:
 ,
, ,恒容容器中,对于以上反应,能加快反应速率的是
,恒容容器中,对于以上反应,能加快反应速率的是A.升高温度 B.充入He C.加入催化剂
(5)已知
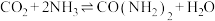 ,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成
,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
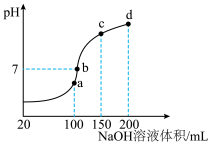
(7)在b点,溶液中各离子浓度由大到小的排列顺序是
(8)在cd段发生反应的离子方程式为
您最近一年使用:0次
3 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
直接氯化:
反应Ⅰ:
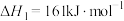
碳氯化:
反应Ⅱ: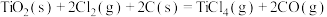
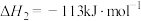
反应Ⅲ:

(1)直接氯化可以在___________ 下自发进行。
(2)反应Ⅳ 的
的 为
为___________ 
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
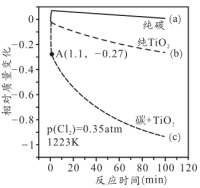
①用纯碳实验时,质量稍微有所增长,生成了含___________ 键的物质。
②用纯 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为___________ ;该反应的活化能___________ (填“高”或“低”)。
③按照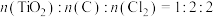 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=___________ 。
④1.1min之后,光气( )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:

决速步骤的反应方程式为___________ ,1.1min之后发生的总反应方程式为___________ 。
(4)按照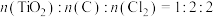 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
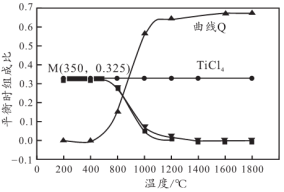
①曲线Q是___________ (填化学式)的变化图像。
②M点所发生的化学方程式是___________ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。直接氯化:
反应Ⅰ:

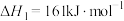
碳氯化:
反应Ⅱ:
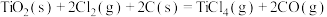
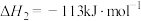
反应Ⅲ:


(1)直接氯化可以在
(2)反应Ⅳ
 的
的 为
为
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压
 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
①用纯碳实验时,质量稍微有所增长,生成了含
②用纯
 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为③按照
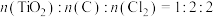 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=④1.1min之后,光气(
 )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:
决速步骤的反应方程式为
(4)按照
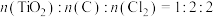 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
①曲线Q是
②M点所发生的化学方程式是
您最近一年使用:0次
名校
解题方法
4 . 硫酸有着广泛的用途。硫酸工业在国民经济中占有重要地位。
(1)实验室可用铜与浓硫酸反应制备少量 :
: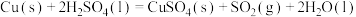
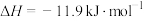 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由___________ 。
(2)我国古籍记载了硫酸的制备方法—“炼石胆( )取精华法”。
)取精华法”。
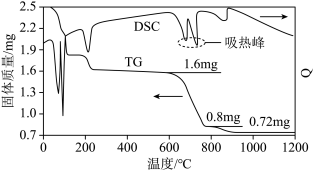
①借助现代仪器分析,该制备过程中 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有___________ 、___________ (填化学式)和 。
。
②已知下列热化学方程式:
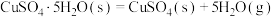



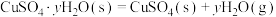

则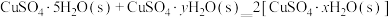 的△H=
的△H=__________  。
。
(3)接触法制硫酸的关键反应为 的催化氧化:
的催化氧化: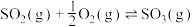
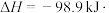

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率( )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是__________ 。
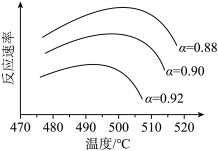
A.温度越高,反应速率越大 B.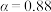 的曲线代表平衡转化率
的曲线代表平衡转化率
C. 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度
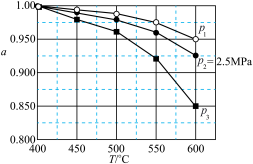
②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=__________ 。
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为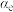 ,则上述催化氧化反应
,则上述催化氧化反应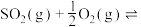
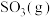 的
的
_____________ (用含p和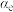 的代数式表示)。
的代数式表示)。
(1)实验室可用铜与浓硫酸反应制备少量
 :
: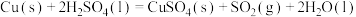
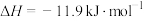 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由(2)我国古籍记载了硫酸的制备方法—“炼石胆(
 )取精华法”。
)取精华法”。①借助现代仪器分析,该制备过程中
 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有 。
。
②已知下列热化学方程式:
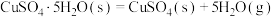



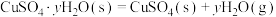

则
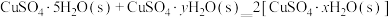 的△H=
的△H= 。
。(3)接触法制硫酸的关键反应为
 的催化氧化:
的催化氧化: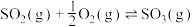
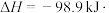

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率(
 )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
A.温度越高,反应速率越大 B.
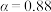 的曲线代表平衡转化率
的曲线代表平衡转化率C.
 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到
 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数
 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为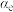 ,则上述催化氧化反应
,则上述催化氧化反应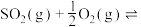
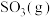 的
的
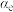 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
5 . Ⅰ.认识反应条件对化学反应方向,限度及快慢的影响,有利于运用这些规律解决实际问题。
(1)下列有关说法正确的是__________
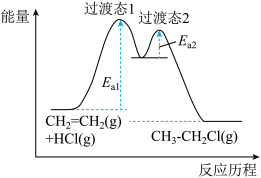
(2) 与
与 的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
(3)一定条件下 在催化剂表面与水发生反应
在催化剂表面与水发生反应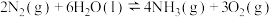 ,
, ,如果反应的平衡常数K值变大,该反应__________
,如果反应的平衡常数K值变大,该反应__________
(4)下列有关可逆反应: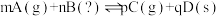 的分析中,一定正确的是__________
的分析中,一定正确的是__________
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将 转化为
转化为 ,再进一步还原得到钛。工业上将
,再进一步还原得到钛。工业上将 转化为
转化为 的方法为:
的方法为:
碳氯化法:
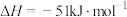
(5)平衡常数表达式
___________ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是___________ 。
A.混合气体的压强保持不变 B.
C.混合气体的密度保持不变 D. 和
和 物质的量相等
物质的量相等
(6)若反应容器的容积为 ,
, 后,测得固体的质量减少
后,测得固体的质量减少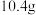 ,则
,则 的平均反应速率为
的平均反应速率为___________ 。从碰撞理论解释升高温度反应速率加快的原因:___________ 。
Ⅲ.工业上将 转化为
转化为 的方法为还有直接氯化法:
的方法为还有直接氯化法:
直接氯化法:
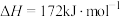
(7)从 和
和 的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:
的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:___________ 。
(8)由 冶炼钛方法有:900℃,
冶炼钛方法有:900℃,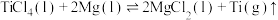 ;从平衡移动角度解释上述冶炼金属钛的反应原理
;从平衡移动角度解释上述冶炼金属钛的反应原理___________ 。
(1)下列有关说法正确的是__________
A.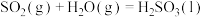 ,该过程熵值增大 ,该过程熵值增大 |
B.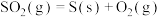 , , ,该反应一定能自发进行 ,该反应一定能自发进行 |
C.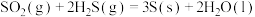 ,该过程熵值增大 ,该过程熵值增大 |
D. , , , , ,此反应低温自发 ,此反应低温自发 |
 与
与 的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
| A.决速步骤是第一步 | B.总反应为吸热反应 |
| C.总能量:反应物低于生成物 | D.过渡态1比过渡态2更稳定 |
 在催化剂表面与水发生反应
在催化剂表面与水发生反应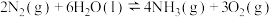 ,
, ,如果反应的平衡常数K值变大,该反应__________
,如果反应的平衡常数K值变大,该反应__________| A.在平衡移动时正反应速率先减小后增大 | B.一定向正反应方向移动 |
| C.在平衡移动时逆反应速率先增大后减小 | D.一定向逆反应方向移动 |
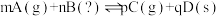 的分析中,一定正确的是__________
的分析中,一定正确的是__________A.增大压强,平衡不移动,则 |
| B.升高温度,A的转化率诚小,则正反应是吸热反应 |
| C.保持容器体积不变,移走C,平衡正向移动,正反应速率增大 |
| D.保持容器体积不变,加入B,容器中D的质量增加,则B是气体 |
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将
 转化为
转化为 ,再进一步还原得到钛。工业上将
,再进一步还原得到钛。工业上将 转化为
转化为 的方法为:
的方法为:碳氯化法:

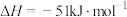
(5)平衡常数表达式

A.混合气体的压强保持不变 B.

C.混合气体的密度保持不变 D.
 和
和 物质的量相等
物质的量相等(6)若反应容器的容积为
 ,
, 后,测得固体的质量减少
后,测得固体的质量减少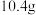 ,则
,则 的平均反应速率为
的平均反应速率为Ⅲ.工业上将
 转化为
转化为 的方法为还有直接氯化法:
的方法为还有直接氯化法:直接氯化法:

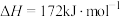
(7)从
 和
和 的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:
的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:(8)由
 冶炼钛方法有:900℃,
冶炼钛方法有:900℃,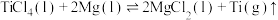 ;从平衡移动角度解释上述冶炼金属钛的反应原理
;从平衡移动角度解释上述冶炼金属钛的反应原理
您最近一年使用:0次
2023-04-30更新
|
349次组卷
|
2卷引用:上海市第二中学2022-2023学年高二下学期期中考试等级考化学试题
6 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+172kJ•mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2=-51kJ•mol-1,Kp2=1.2×1012Pa
①对于直接氯化反应:增大压强,平衡______ 移动(填“向左”“向右”或“不”);温度升高,平衡转化率______ (填“变大”“变小”或“不变”)。
②直接氯化的反应趋势远小于碳氯化,其原因是______ 。
(2)在1.0×105Pa,将TiO2、C、Cl2按物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
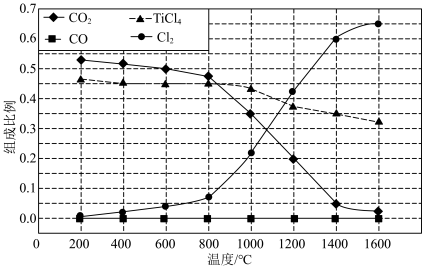
①反应 C(s)+
C(s)+ CO2(g)
CO2(g) CO(g)的平衡常数Kp(1400℃)=
CO(g)的平衡常数Kp(1400℃)=______ Pa(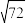 ≈8.5)。
≈8.5)。
②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是______ 。
(3)TiO2直接氯化和碳氯化都属于“气—固”反应,工业生产中有利于“气—固”充分接触的措施是______ 。
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+172kJ•mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2=-51kJ•mol-1,Kp2=1.2×1012Pa
①对于直接氯化反应:增大压强,平衡
②直接氯化的反应趋势远小于碳氯化,其原因是
(2)在1.0×105Pa,将TiO2、C、Cl2按物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①反应
 C(s)+
C(s)+ CO2(g)
CO2(g) CO(g)的平衡常数Kp(1400℃)=
CO(g)的平衡常数Kp(1400℃)=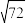 ≈8.5)。
≈8.5)。②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
(3)TiO2直接氯化和碳氯化都属于“气—固”反应,工业生产中有利于“气—固”充分接触的措施是
您最近一年使用:0次
7 . 随着农业发展和军工生产的需要,科学家们先后研究并实现了氨的工业生产,今日粮食的产量之高也离不开合成氨工业的发展。除了氨气外,含氮物质在生活中也随处可见。
(1)下列关于NH3性质的解释合理的是______ (单选)。
(2)合成氨工业先驱哈伯(P•Haber)利用N2和H2在Fe催化作用下最早人工合成氨气,请根据表中键能的相关数据,计算合成氨反应的热效应:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=______ kJ•mol-1。
(3)下列关于合成氨工艺的下列理解,正确的是______ (单选)。
(4)尿素(NH2CONH2)又称碳酰胺,是含氮量最高的氮肥,同时也是一种重要的化工产品,有很多用途。工业上利用二氧化碳和氨气在一定条件下合成尿素,涉及的反应如下:
反应Ⅰ:2NH3(g)+CO2(g)=H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ•mol-1
反应Ⅱ:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=138kJ•mol-1
写出二氧化碳和氨气合成尿素固体和水蒸气的总热化学方程式______ 。
(5)上述反应自发进行的条件是______ (填“低温”、“高温”或“任意条件”)。
(6)化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种气体,一种是空气的主要成分,另一种是温室气体的主要成分,同时溶液pH降低,该反应的化学方程式______ 。
(7)利用NO2与NH3的反应构成电池的方法(产物中一种是无毒气体,且在空气中占比较大),既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
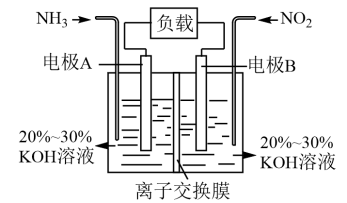
其中A电极的电极反应式为______ 。
(8)下列关于该电池的说法正确的是______ (不定项)。
(1)下列关于NH3性质的解释合理的是
| A.NH3分子中氮原子的杂化方式是sp2,空间构型是平面三角形 |
| B.NH3分子中氮原子的价层电子对数为3 |
| C.8NH3+3Cl2=N2+6NH4Cl中氧化剂与还原剂的物质的量之比为3:2 |
D.氨水中存在NH ,因为NH3•H2O是离子化合物 ,因为NH3•H2O是离子化合物 |
 2NH3(g) ΔH=
2NH3(g) ΔH=| 化学键 | HH | NH | N≡N |
| 键能/( kJ•mol-1) | 436 | 391 | 945 |
| A.当温度、压强一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率 |
| B.增大体系的压强能增大活化分子的百分数,从而加快反应速率 |
| C.合成氨反应选择在高温条件下进行时为了使平衡向正反应方向 |
| D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生 |
反应Ⅰ:2NH3(g)+CO2(g)=H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ•mol-1
反应Ⅱ:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=138kJ•mol-1
写出二氧化碳和氨气合成尿素固体和水蒸气的总热化学方程式
(5)上述反应自发进行的条件是
(6)化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种气体,一种是空气的主要成分,另一种是温室气体的主要成分,同时溶液pH降低,该反应的化学方程式
(7)利用NO2与NH3的反应构成电池的方法(产物中一种是无毒气体,且在空气中占比较大),既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。

其中A电极的电极反应式为
(8)下列关于该电池的说法正确的是
| A.电子从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阳离子交换膜 |
| C.反应的总方程是6NO2+8NH3=7N2+12H2O |
| D.当有4.48LNO2(标准状况下)被处理时,转移电子物质的量为0.8mol |
您最近一年使用:0次
8 . 金属钛( )在航空航天、医疗器械等工业领域有着重要用途。回答下列问题:
)在航空航天、医疗器械等工业领域有着重要用途。回答下列问题:
(1)目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原
,再进一步还原 得到钛。
得到钛。 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在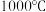 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:
直接氯化: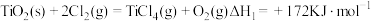 ,
,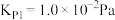
碳氯化: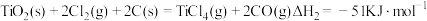 ,
,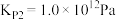
运用以上数据分析,你认为以上两个方法更优越的是__________ ,理由是__________ 。
(2)已知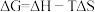 ,
, 和
和 类似,只取决于反应体系的始态和终态。根据如图回答问题。
类似,只取决于反应体系的始态和终态。根据如图回答问题。

①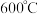 时,反应
时,反应
________ 自发进行(填“能”或“不能”)。
②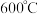 时,
时,
________ 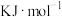 。
。
(3)钛酸锂是一种理想的嵌入型电极材料。某新型钛酸锂电池与普通石墨烯锂电池相比,电位比较高,安全性相较好,工作原理如图所示。
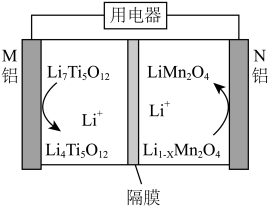
①电池的正极为______ (填“M”或“N”)
②放电时, 通过隔膜向
通过隔膜向______ 极(填“M”或“N”)移动。
③放电时,电极N的电极反应式为______ 。
 )在航空航天、医疗器械等工业领域有着重要用途。回答下列问题:
)在航空航天、医疗器械等工业领域有着重要用途。回答下列问题:(1)目前生产钛的方法之一是将金红石(
 )转化为
)转化为 ,再进一步还原
,再进一步还原 得到钛。
得到钛。 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在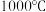 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:直接氯化:
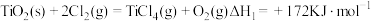 ,
,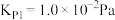
碳氯化:
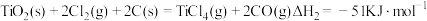 ,
,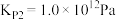
运用以上数据分析,你认为以上两个方法更优越的是
(2)已知
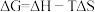 ,
, 和
和 类似,只取决于反应体系的始态和终态。根据如图回答问题。
类似,只取决于反应体系的始态和终态。根据如图回答问题。
①
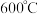 时,反应
时,反应
②
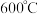 时,
时,
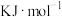 。
。(3)钛酸锂是一种理想的嵌入型电极材料。某新型钛酸锂电池与普通石墨烯锂电池相比,电位比较高,安全性相较好,工作原理如图所示。

①电池的正极为
②放电时,
 通过隔膜向
通过隔膜向③放电时,电极N的电极反应式为
您最近一年使用:0次
名校
解题方法
9 . 过氧化氢( )有广泛的用途。回答下列问题:
)有广泛的用途。回答下列问题:
(1)已知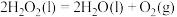
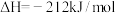

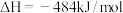

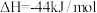
①请写出 与
与 反应生成
反应生成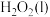 的热化学方程式
的热化学方程式_______ 。
②请分析该反应在_______ 条件下能自发进行(填“高温”或“低温”)。
(2)工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理为:
 ,
, 水解得
水解得
回答下列问题:
①电解硫酸氢铵溶液时,阳极的电极反应式为:_______ 。
②请写出 水解生成
水解生成 的离子方程式
的离子方程式_______ ,把 从产物中分离出来的操作名称为
从产物中分离出来的操作名称为_______ 。
 )有广泛的用途。回答下列问题:
)有广泛的用途。回答下列问题:(1)已知
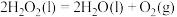
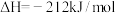

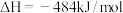

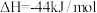
①请写出
 与
与 反应生成
反应生成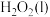 的热化学方程式
的热化学方程式②请分析该反应在
(2)工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理为:
 ,
, 水解得
水解得
回答下列问题:
①电解硫酸氢铵溶液时,阳极的电极反应式为:
②请写出
 水解生成
水解生成 的离子方程式
的离子方程式 从产物中分离出来的操作名称为
从产物中分离出来的操作名称为
您最近一年使用:0次
2022-11-11更新
|
239次组卷
|
2卷引用:山东省菏泽市郓城第一中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
10 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I.氨热分解法制氢气
相关化学键的键能数据
在一定温度下,利用催化剂将NH3分解为N2和H2。回答下列问题:
(1)反应2NH3(g) N2(g)+3H2(g) ∆H=
N2(g)+3H2(g) ∆H=___________ kJ/mol;
(2)已知该反应的∆S=198.9J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填标号);(T(K)=t(℃)+273.15)
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
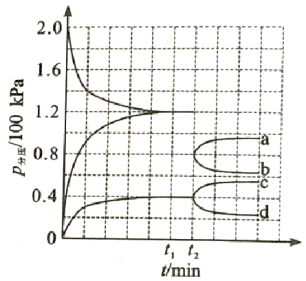
①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~ t1时间内的反应速率v(H2)=___________ mol·L-1·min-1 (用含t1的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________ ;
③在该温度下,反应的标准平衡常数KΘ=___________ 。
(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g)
gG(g)+hH(g)
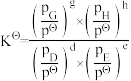 ,其中pΘ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pΘ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
(4)NH3用途广泛,写出基于其物理性质的一种用途:___________ 。
方法I.氨热分解法制氢气
相关化学键的键能数据
| 化学键 | N≡N | H-H | N-H |
| 键能E/(kJ·mol-1) | 946 | 436.0 | 390.8 |
(1)反应2NH3(g)
 N2(g)+3H2(g) ∆H=
N2(g)+3H2(g) ∆H=(2)已知该反应的∆S=198.9J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填标号);(T(K)=t(℃)+273.15)
| A.25℃ | B.125℃ | C.225℃ | D.325℃ |

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~ t1时间内的反应速率v(H2)=
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
③在该温度下,反应的标准平衡常数KΘ=
(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)
 gG(g)+hH(g)
gG(g)+hH(g)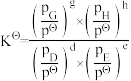 ,其中pΘ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pΘ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。(4)NH3用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
2021-11-05更新
|
183次组卷
|
4卷引用:广东省河源正德中学2021-2022学年高二上学期第一次段考化学试题



