1 . 我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。研发 资源化利用技术,降低空气中
资源化利用技术,降低空气中 含量成为世界各国研究热点。
含量成为世界各国研究热点。
(1) 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。

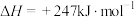
①该反应
___________ 0(填“>”或“<”)
②有传闻 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?___________ (填“正确”或“错误”),并写出原因___________ 。
③若让此反应能自发进行,你认为应选择___________ (填“高温”或“低温”)。
(2)工业上用 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: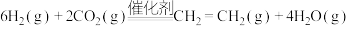

已知:①
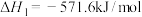
②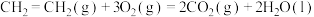
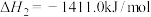
③
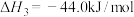
则
___________ ,该反应能够自发进行的条件是___________ (填“低温”、“高温”或“任何温度”)。
(3)电化学法也可还原二氧化碳制乙烯,原理如图所示。
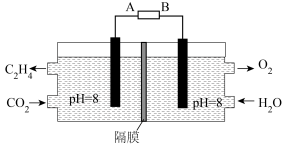
该电池的阴极电极反应式为:___________ 。
 资源化利用技术,降低空气中
资源化利用技术,降低空气中 含量成为世界各国研究热点。
含量成为世界各国研究热点。(1)
 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。
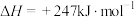
①该反应

②有传闻
 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?③若让此反应能自发进行,你认为应选择
(2)工业上用
 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: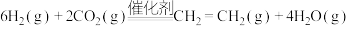

已知:①

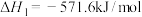
②
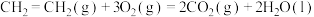
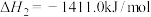
③

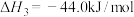
则

(3)电化学法也可还原二氧化碳制乙烯,原理如图所示。

该电池的阴极电极反应式为:
您最近一年使用:0次
名校
2 . 我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。研发利用二氧化碳技术,降低空气中二氧化碳含量成为重要的任务。
(1)倡导绿色低碳的生活方式,下列措施与节能减碳矛盾的是_____
(2) 加氢合成
加氢合成 的反应为
的反应为 。
。
①下列说法正确的是_____
A.调控反应条件不能改变反应限度
B.投入 和
和 能得到
能得到
C.当 的消耗速率等于其生成速率时,该反应已停止
的消耗速率等于其生成速率时,该反应已停止
D.该反应在一定温度下能自发进行,则
②一般认为,该反应经过如下步骤来实现:
反应Ⅰ: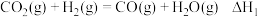 ;
;
反应Ⅱ: 。
。
则总反应的焓变
___________ (用包含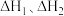 的代数式表示)。若某温度下,反应Ⅰ的平衡常数为
的代数式表示)。若某温度下,反应Ⅰ的平衡常数为 ,反应Ⅱ的平衡常数为
,反应Ⅱ的平衡常数为 ,则总反应的平衡常数
,则总反应的平衡常数
___________ (用包含 的代数式表示)
的代数式表示)
(3)二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应: ;
;
①写出主反应的平衡常数表达式:___________
②某容器中加入一定量的 和
和 ,保持温度和压强不变的情况下,达平衡后再向该容器中注入
,保持温度和压强不变的情况下,达平衡后再向该容器中注入 稀释,主反应的化学平衡将
稀释,主反应的化学平衡将___________ (填“正向移动”、“逆向移动”或“不移动”),达到新平衡后, 的体积分数将
的体积分数将___________ (填“增大”、“减小”或“不变”)
(4) 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线:
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线: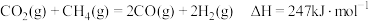
①该反应
___________ 0(填“>”或“<”)
②有传闻 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?___________ (填“正确”或“错误”),并写出原因___________ 。
(1)倡导绿色低碳的生活方式,下列措施与节能减碳矛盾的是_____
| A.购物时使用环保袋 | B.就餐时践行光盘行动 |
| C.使用节能灯代替白炽灯 | D.为食品保鲜,冰箱温度越低越好 |
 加氢合成
加氢合成 的反应为
的反应为 。
。①下列说法正确的是
A.调控反应条件不能改变反应限度
B.投入
 和
和 能得到
能得到
C.当
 的消耗速率等于其生成速率时,该反应已停止
的消耗速率等于其生成速率时,该反应已停止D.该反应在一定温度下能自发进行,则

②一般认为,该反应经过如下步骤来实现:
反应Ⅰ:
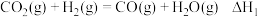 ;
;反应Ⅱ:
 。
。则总反应的焓变

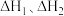 的代数式表示)。若某温度下,反应Ⅰ的平衡常数为
的代数式表示)。若某温度下,反应Ⅰ的平衡常数为 ,反应Ⅱ的平衡常数为
,反应Ⅱ的平衡常数为 ,则总反应的平衡常数
,则总反应的平衡常数
 的代数式表示)
的代数式表示)(3)二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:
 ;
;①写出主反应的平衡常数表达式:
②某容器中加入一定量的
 和
和 ,保持温度和压强不变的情况下,达平衡后再向该容器中注入
,保持温度和压强不变的情况下,达平衡后再向该容器中注入 稀释,主反应的化学平衡将
稀释,主反应的化学平衡将 的体积分数将
的体积分数将(4)
 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线:
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线: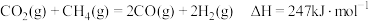
①该反应

②有传闻
 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
您最近一年使用:0次
名校
3 . 研究碳、氮等元素化合物的性质或转化对体会化学与生活有重要意义。
Ⅰ.以CO2和NH3为原料合成尿素总反应为:CO2 (g)+ 2NH3 (g) CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
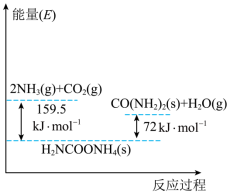
(1)总反应的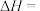
______  ,该反应在
,该反应在______ (填“高温”或“低温”或“任何条件都不”)可以自发进行。
(2)若该反应在恒容密闭容器中进行,判断该反应达到化学平衡状态的依据是________ (填字母序号)。
(3)在恒温、体积为1L的恒容装置中通入CO2和NH3各1mol 、1.5mol,达平衡时CO2的转化率为50%,平衡常数的值为_______ 。
Ⅱ.亚硝酸钠(NaNO2)是肉制品生产中常使用的一种食品添加剂,外观与食盐极为相似,具有较强毒性,误食可能造成死亡。已知常温下 Ka(HNO2)=1.75×10-4,Ka(CH3COOH)=1.8×10-5。
(4)常温下,pH=4的HNO2溶液中,由水电离出的c(H+)约为______ mol·L-1,浓度均为 0.1mol/L 的 NaNO2和 CH3COONa 的混合溶液中各离子浓度由大到小的关系为__________ 。
(5)高锰酸钾常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100 mL溶液。
②取25.00 mL溶液于锥形瓶中,用0.02000 mol·L-1 KMnO4标准溶液(酸性)进行滴定,反应离子方程式是: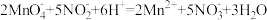 ,滴定结束后消耗KMnO4溶液VmL。
,滴定结束后消耗KMnO4溶液VmL。
进行滴定操作时无需另加指示剂,达到滴定终点时的现象是_______ ,测得该样品中NaNO2的质量分数为_______ 。(写出计算式)
Ⅰ.以CO2和NH3为原料合成尿素总反应为:CO2 (g)+ 2NH3 (g)
 CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
(1)总反应的
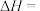
 ,该反应在
,该反应在(2)若该反应在恒容密闭容器中进行,判断该反应达到化学平衡状态的依据是________ (填字母序号)。
| A.反应速率2 v(CO2) = v(NH3) | B.混合气体中 CO2的浓度保持不变 |
| C.混合气体密度不变 | D.消耗2 mol NH3的同时生成 1 mol H2O |
(3)在恒温、体积为1L的恒容装置中通入CO2和NH3各1mol 、1.5mol,达平衡时CO2的转化率为50%,平衡常数的值为
Ⅱ.亚硝酸钠(NaNO2)是肉制品生产中常使用的一种食品添加剂,外观与食盐极为相似,具有较强毒性,误食可能造成死亡。已知常温下 Ka(HNO2)=1.75×10-4,Ka(CH3COOH)=1.8×10-5。
(4)常温下,pH=4的HNO2溶液中,由水电离出的c(H+)约为
(5)高锰酸钾常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100 mL溶液。
②取25.00 mL溶液于锥形瓶中,用0.02000 mol·L-1 KMnO4标准溶液(酸性)进行滴定,反应离子方程式是:
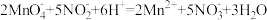 ,滴定结束后消耗KMnO4溶液VmL。
,滴定结束后消耗KMnO4溶液VmL。进行滴定操作时无需另加指示剂,达到滴定终点时的现象是
您最近一年使用:0次
名校
4 . 含氮化合物对工业生产有多种影响,化学工作者设计了如下再利用的方案:
I.以 和
和 为原料合成化肥-尿素
为原料合成化肥-尿素 ,两步反应的能量变化如图:
,两步反应的能量变化如图:

(1)该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行。
(2)已知第二步反应决定了生产尿素的快慢,可推测
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)下列措施能提高该反应 的平衡转化率的是_______。
的平衡转化率的是_______。
II.氨的催化氧化过程发生以下两种反应,该过程易受催化剂选择性的影响。
①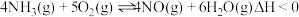
②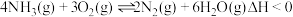
在容积固定的密闭容器中充入 和
和 ,一定时间内,在催化剂作用下发生上述反应。生成物和的物质的量随温度的变化曲线如图。
,一定时间内,在催化剂作用下发生上述反应。生成物和的物质的量随温度的变化曲线如图。
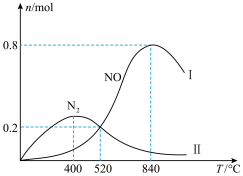
(4)当温度低于400℃时, 的物质的量增大的幅度高于
的物质的量增大的幅度高于 ,其原因是
,其原因是_______ 。
(5)840℃时, 的转化率约为
的转化率约为_______ 若520℃时平衡压强为 ,列出520℃反应②平衡常数
,列出520℃反应②平衡常数 的计算式
的计算式
_______ (无需化简)。
I.以
 和
和 为原料合成化肥-尿素
为原料合成化肥-尿素 ,两步反应的能量变化如图:
,两步反应的能量变化如图:
(1)该反应在
(2)已知第二步反应决定了生产尿素的快慢,可推测

 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。(3)下列措施能提高该反应
 的平衡转化率的是_______。
的平衡转化率的是_______。| A.选用更有效的催化剂 | B.升高反应体系的温度 |
| C.降低反应体系的温度 | D.缩小容器的体积 |
II.氨的催化氧化过程发生以下两种反应,该过程易受催化剂选择性的影响。
①
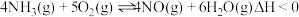
②
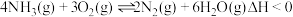
在容积固定的密闭容器中充入
 和
和 ,一定时间内,在催化剂作用下发生上述反应。生成物和的物质的量随温度的变化曲线如图。
,一定时间内,在催化剂作用下发生上述反应。生成物和的物质的量随温度的变化曲线如图。
(4)当温度低于400℃时,
 的物质的量增大的幅度高于
的物质的量增大的幅度高于 ,其原因是
,其原因是(5)840℃时,
 的转化率约为
的转化率约为 ,列出520℃反应②平衡常数
,列出520℃反应②平衡常数 的计算式
的计算式
您最近一年使用:0次
解题方法
5 . 液态的 可作制冷剂,
可作制冷剂, 还可用于制造铵态(
还可用于制造铵态( )氮肥和硝态(
)氮肥和硝态( )氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在
)氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在 Pa、550°C的条件下以
Pa、550°C的条件下以 和
和 为原料合成了
为原料合成了 :
:
 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。对于反应
。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。对于反应 ,下列说法正确的是
,下列说法正确的是
 可作制冷剂,
可作制冷剂, 还可用于制造铵态(
还可用于制造铵态( )氮肥和硝态(
)氮肥和硝态( )氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在
)氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在 Pa、550°C的条件下以
Pa、550°C的条件下以 和
和 为原料合成了
为原料合成了 :
:
 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。对于反应
。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。对于反应 ,下列说法正确的是
,下列说法正确的是| A.高温条件,有利于反应的自发进行 |
| B.升高温度,反应的化学平衡常数K增大 |
| C.增大压强,活化分子百分数增多,反应速率加快 |
D.若反应放出92.4kJ热量,则过程中有3mol 被氧化 被氧化 |
您最近一年使用:0次
6 . 含氮化合物对工业生产有多种影响,化学工作者设计了如下再利用的方案:
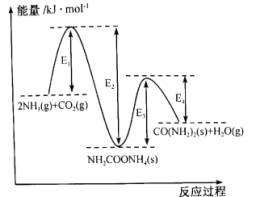
(1)以NH3和CO2为原料合成化肥-尿素 ,两步反应的能量变化如图:
,两步反应的能量变化如图:
①该反应在_______ (填“高温”“低温”或“任何温度”)下能自发进行。
②已知第二步反应决定了生产尿素的快慢,可推测
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③该反应达到化学平衡后,下列措施能提高NH3转化率的是_______ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)氨的催化氧化过程可发生以下两种反应,该过程易受催化剂选择性影响。
I:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H<0;
II: ;
;
在容积固定的密闭容器中充入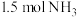 和
和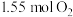 ,一定时间段内,在催化剂作用下发生上述反应。生成物NO和
,一定时间段内,在催化剂作用下发生上述反应。生成物NO和 的物质的量随温度的变化曲线如图。
的物质的量随温度的变化曲线如图。
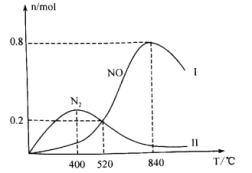
①当温度处于400℃~840℃时, 的物质的量减少,NO的物质的量增加,其原因是
的物质的量减少,NO的物质的量增加,其原因是_______ 。
②840℃时, 的转化率为
的转化率为_______ 。(保留小数点后2位,下同);若520℃时起始压强为p0,恒温下反应II的平衡常数
_______ 。( 为以分压表示的平衡常数)
为以分压表示的平衡常数)
(3)肼(N2H4)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式:_______ 。假设使用肼-空气燃料电池电解精炼铜,阴极质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气_______ L(假设空气中氧气体积分数为20%)。

(1)以NH3和CO2为原料合成化肥-尿素
 ,两步反应的能量变化如图:
,两步反应的能量变化如图:①该反应在
②已知第二步反应决定了生产尿素的快慢,可推测

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③该反应达到化学平衡后,下列措施能提高NH3转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)氨的催化氧化过程可发生以下两种反应,该过程易受催化剂选择性影响。
I:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H<0;
II:
 ;
;在容积固定的密闭容器中充入
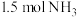 和
和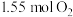 ,一定时间段内,在催化剂作用下发生上述反应。生成物NO和
,一定时间段内,在催化剂作用下发生上述反应。生成物NO和 的物质的量随温度的变化曲线如图。
的物质的量随温度的变化曲线如图。
①当温度处于400℃~840℃时,
 的物质的量减少,NO的物质的量增加,其原因是
的物质的量减少,NO的物质的量增加,其原因是②840℃时,
 的转化率为
的转化率为
 为以分压表示的平衡常数)
为以分压表示的平衡常数)(3)肼(N2H4)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式:
您最近一年使用:0次
7 . Ⅰ.为了探究一种固体化合物甲(仅含3种元素)的组成和性质,设计并完成如下实验:(气体体积已经换算成标准状况下的体积)
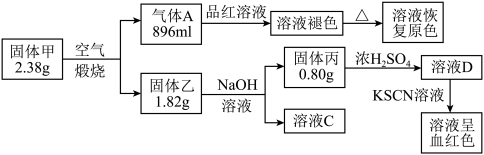
请回答:
(1)写出化合物甲的化学式________ 。
(2)写出形成溶液C的化学方程式:_____________ 。
(3)写出气体A通入溶液D中,发生反应的离子反应方程式__________ 。
Ⅱ.近年来化学家又研究开发出了用 H2和CH3COOH 为原料合成乙醇(反应Ⅰ),同时会发生副反应Ⅱ。
反应Ⅰ.CH3COOH(g)+2H2(g) CH3CH2OH(g) +H2O(g) △H1
CH3CH2OH(g) +H2O(g) △H1
反应Ⅱ. CH3COOH(g)+H2(g) CO(g)+CH4(g)+H2O(g) △H2>0
CO(g)+CH4(g)+H2O(g) △H2>0
已知:乙醇选择性是转化的乙酸中生成乙醇的百分比。请回答:
(1)反应Ⅰ一定条件下能自发进行,则△H1___ 0。(填“>”或“<”)
(2)某实验中控制 CH3COOH 和 H2初始投料比为 1∶1.5,在相同压强下,经过相同反应时间测得如下实验数据:
①有利于提高CH3COOH转化为CH3 CH2OH平衡转化率的措施有______ 。
A 使用催化剂甲 B 使用催化剂乙
C 降低反应温度 D 投料比不变,增加反应物的浓度
E 增大CH3COOH和H2的初始投料比
②673K甲催化剂作用下反应Ⅰ已达平衡状态,测得乙酸的转化率为50%,乙醇的选择性40%,若此时容器体积为 1.0L,CH3COOH 初始加入量为2.0mol,则反应Ⅰ的平衡常数 K=_____ 。
③表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成CH3CH2OH的选择性有显著的影响,其原因是_________________ 。
(3)在图中分别画出I在催化剂甲和催化剂乙两种情况下“反应过程-能量”示意图 。_____


请回答:
(1)写出化合物甲的化学式
(2)写出形成溶液C的化学方程式:
(3)写出气体A通入溶液D中,发生反应的离子反应方程式
Ⅱ.近年来化学家又研究开发出了用 H2和CH3COOH 为原料合成乙醇(反应Ⅰ),同时会发生副反应Ⅱ。
反应Ⅰ.CH3COOH(g)+2H2(g)
 CH3CH2OH(g) +H2O(g) △H1
CH3CH2OH(g) +H2O(g) △H1反应Ⅱ. CH3COOH(g)+H2(g)
 CO(g)+CH4(g)+H2O(g) △H2>0
CO(g)+CH4(g)+H2O(g) △H2>0已知:乙醇选择性是转化的乙酸中生成乙醇的百分比。请回答:
(1)反应Ⅰ一定条件下能自发进行,则△H1
(2)某实验中控制 CH3COOH 和 H2初始投料比为 1∶1.5,在相同压强下,经过相同反应时间测得如下实验数据:
| 温度(K) | 催化剂 | 乙酸的转化率(%) | 乙醇选择性(%) |
| 573 | 甲 | 40 | 50 |
| 573 | 乙 | 30 | 60 |
| 673 | 甲 | 55 | 35 |
| 673 | 乙 | 40 | 50 |
①有利于提高CH3COOH转化为CH3 CH2OH平衡转化率的措施有
A 使用催化剂甲 B 使用催化剂乙
C 降低反应温度 D 投料比不变,增加反应物的浓度
E 增大CH3COOH和H2的初始投料比
②673K甲催化剂作用下反应Ⅰ已达平衡状态,测得乙酸的转化率为50%,乙醇的选择性40%,若此时容器体积为 1.0L,CH3COOH 初始加入量为2.0mol,则反应Ⅰ的平衡常数 K=
③表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成CH3CH2OH的选择性有显著的影响,其原因是
(3)在图中分别画出I在催化剂甲和催化剂乙两种情况下“反应过程-能量”

您最近一年使用:0次
2010·江苏扬州·模拟预测
解题方法
8 . 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
CH4的转化率与温度、压强的关系如图。
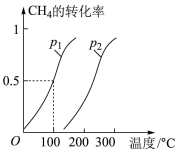
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为_______ 。
②图中的P1_______ P2(填“<”、“>”或“=”),100℃时平衡常数为_______ 。
③在其它条件不变的情况下降低温度,逆反应速率将_______ (填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g) ……Ⅱ
CH3OH(g) ……Ⅱ
④该反应的△H_______ 0,△S_______ 0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_______ 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.请在上表空格中填入剩余的实验条件数据_______ 。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强_______ 。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……ⅠCH4的转化率与温度、压强的关系如图。
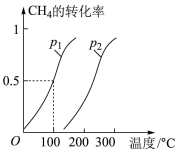
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1
③在其它条件不变的情况下降低温度,逆反应速率将
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g) ……Ⅱ
CH3OH(g) ……Ⅱ④该反应的△H
⑤若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| ⅰ | 150 | 1/3 | 0.1 |
| ⅱ | 5 | ||
| ⅲ | 350 | 5 |
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强

您最近一年使用:0次
9 . Ⅰ.中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果由国际知名学术期刊《科学》在线发表。 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” 、
、 ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为: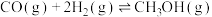
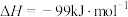
(1)若要该反应自发进行,_____ (填“高温”或“低温”)更有利。
(2)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_____ (填字母序号)。
A.反应物的物质的量的比值不变
B.混合气体的密度不再变化
C. 的百分含量不再变化
的百分含量不再变化
D.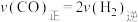
E.混合气体的平均相对分子质量不再变化
(3)把 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:
①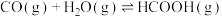
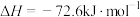
②

③
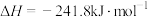
则 与
与 合成
合成 反应的热化学方程式:
反应的热化学方程式:_____
(4)受绿色植物光合作用的启示,太阳能固碳装置被设计出来,则固碳电极反应为_____ 。
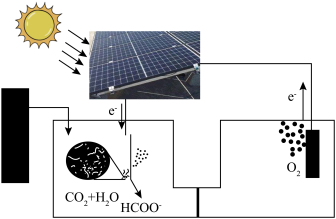
Ⅱ.我国学者结合实验与计算机模拟结果,研究了 的反应历程。在催化剂作用下,此反应为
的反应历程。在催化剂作用下,此反应为  l可有效降低汽车尾气污染物排放。
l可有效降低汽车尾气污染物排放。
(5)探究温度、压强(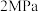 ,
,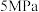 )对反应
)对反应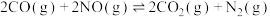 的影响,如图所示,表示
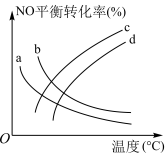
的影响,如图所示,表示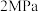 的是
的是_____ (填标号)。
(6)一定温度下,向一容积为1L的恒容密闭容器按体积3∶2比例充入CO和NO,压强为5MPa发生上述反应,当反应达到平衡时容器内压强变为起始时的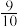 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数 =
=_____ ( 为压强平衡常数)。
为压强平衡常数)。
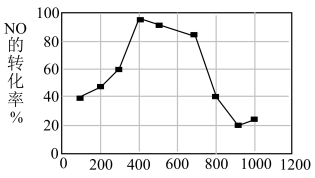
(7)若在相同时间内测得NO的转化率随温度的变化曲线如图,解释NO的转化率随温度的升高由上升到下降、下降由缓到急的主要原因是_____ 。
 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” 、
、 ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为: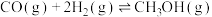
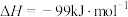
(1)若要该反应自发进行,
(2)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是
A.反应物的物质的量的比值不变
B.混合气体的密度不再变化
C.
 的百分含量不再变化
的百分含量不再变化D.
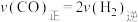
E.混合气体的平均相对分子质量不再变化
(3)把
 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:①
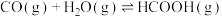
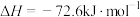
②


③

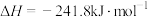
则
 与
与 合成
合成 反应的热化学方程式:
反应的热化学方程式:(4)受绿色植物光合作用的启示,太阳能固碳装置被设计出来,则固碳电极反应为

Ⅱ.我国学者结合实验与计算机模拟结果,研究了
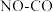 的反应历程。在催化剂作用下,此反应为
的反应历程。在催化剂作用下,此反应为  l可有效降低汽车尾气污染物排放。
l可有效降低汽车尾气污染物排放。(5)探究温度、压强(
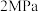 ,
,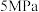 )对反应
)对反应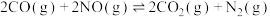 的影响,如图所示,表示
的影响,如图所示,表示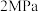 的是
的是
(6)一定温度下,向一容积为1L的恒容密闭容器按体积3∶2比例充入CO和NO,压强为5MPa发生上述反应,当反应达到平衡时容器内压强变为起始时的
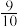 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数 =
= 为压强平衡常数)。
为压强平衡常数)。
(7)若在相同时间内测得NO的转化率随温度的变化曲线如图,解释NO的转化率随温度的升高由上升到下降、下降由缓到急的主要原因是
您最近一年使用:0次
解题方法
10 . 碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分,写出该反应的热化学方程式___________ 。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=—112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=—234kJ/mol
(2)N2O5的分解反应2N2O5(g) 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___________ mol•L-1•min-1。
(3)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示:
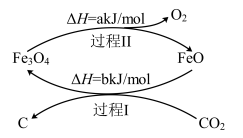
①在转化过程中起催化作用的物质是___________ 。
②写出总反应的化学方程式___________ 。
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应分两步进行:
CO(NH2)2(l)+H2O(l),该反应分两步进行:
①2NH3(g)+CO2(g) NH4COONH2(s)
NH4COONH2(s)
②NH4COONH2(s) =CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白:
①已知该反应可以自发进行,则△H___________ 0(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为
=x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为___________ 。

③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体物质的量变为起始时气体物质的量的 时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=
时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=_______ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分,写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=—112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=—234kJ/mol
(2)N2O5的分解反应2N2O5(g)
 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(3)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示:

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l),该反应分两步进行:
CO(NH2)2(l)+H2O(l),该反应分两步进行:①2NH3(g)+CO2(g)
 NH4COONH2(s)
NH4COONH2(s)②NH4COONH2(s) =CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白:
①已知该反应可以自发进行,则△H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为
=x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体物质的量变为起始时气体物质的量的
 时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=
时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=
您最近一年使用:0次



