1 . 水煤气(CO和 )是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得
)是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得

 。
。
(1)该反应的平衡常数的表达式为_______ 。
(2)上述反应达到平衡后,将体系中的C(s)部分移走,正反应速率__ (填“不变、增大”或“减小”)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有_______ (填字母)。
A.压强固定不变化
B.气体平均相对分子质量不再变化
C.消耗 (g)的速率与消耗CO的速率相等
(g)的速率与消耗CO的速率相等
D. (g)、CO、
(g)、CO、 的浓度相等
的浓度相等
E.固定容积下气体密度不再变化
F.
(4)某温度下,将4mol (g)和足量的碳充入2L的密闭容器中,发生如下反应
(g)和足量的碳充入2L的密闭容器中,发生如下反应
 达到平衡时测得K=1,则此温度下
达到平衡时测得K=1,则此温度下 (g)的转化率为
(g)的转化率为_____ 。已知对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)可得压强平衡常数(记作 ),分压=总压×物质的量分数。若平衡时容器内的压强为p,则
),分压=总压×物质的量分数。若平衡时容器内的压强为p,则
_______ 。
(5)已知反应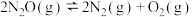 在任意温度下均能自发进行,则该反应为
在任意温度下均能自发进行,则该反应为_______ (填“吸热”或“放热”)反应。
 )是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得
)是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得

 。
。(1)该反应的平衡常数的表达式为
(2)上述反应达到平衡后,将体系中的C(s)部分移走,正反应速率
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有
A.压强固定不变化
B.气体平均相对分子质量不再变化
C.消耗
 (g)的速率与消耗CO的速率相等
(g)的速率与消耗CO的速率相等D.
 (g)、CO、
(g)、CO、 的浓度相等
的浓度相等E.固定容积下气体密度不再变化
F.

(4)某温度下,将4mol
 (g)和足量的碳充入2L的密闭容器中,发生如下反应
(g)和足量的碳充入2L的密闭容器中,发生如下反应
 达到平衡时测得K=1,则此温度下
达到平衡时测得K=1,则此温度下 (g)的转化率为
(g)的转化率为 ),分压=总压×物质的量分数。若平衡时容器内的压强为p,则
),分压=总压×物质的量分数。若平衡时容器内的压强为p,则
(5)已知反应
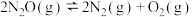 在任意温度下均能自发进行,则该反应为
在任意温度下均能自发进行,则该反应为
您最近一年使用:0次
解题方法
2 . CH3OH和CH3CH2OH均是重要的有机合成原料、溶剂、燃料等。Cu2O可催化CH3OCH3制备CH3OH和CH3CH2OH。已知:
反应1:CH3OCH3(g)+CO(g) CH3COOCH3(g) △H1=akJ ·mol-1
CH3COOCH3(g) △H1=akJ ·mol-1
反应2: CH3COOCH3(g)+H2(g)
CH3COOCH3(g)+H2(g) 
 CH3OH(g)+
CH3OH(g)+  CH3CH2OH(g) △H2=b kJ·mol-1
CH3CH2OH(g) △H2=b kJ·mol-1
(1)CH3OCH3(g) +CO(g) +2H2(g) CH3OH(g) +CH3CH2OH(g)△H=。
CH3OH(g) +CH3CH2OH(g)△H=。 _______ (用含a、b的代数式表示)kJ·mol-1。
(2)在某恒容容器中发生反应1和反应2,达到平衡时,体系中物质的百分含量与温度的关系如图所示。由此推知,△H1_______ (填“>”、“<”或“=”,下同)0,△H2_______ 0。
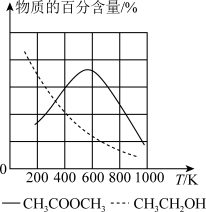
(3)T1 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3(g)、1 molCO(g)、2 mol H2(g) ,发生反应:CH3OCH3(g)+CO(g) +2H2(g) CH3OHg)+CH3CH2OH(g),10 min时反应达到平衡,此时CH3OH(g)的体积分数为
CH3OHg)+CH3CH2OH(g),10 min时反应达到平衡,此时CH3OH(g)的体积分数为 ,容器内压强为p MPa。
,容器内压强为p MPa。
①0~10 min内,v(CH3OCH3)=_______ mol·L-1·min-1,平衡后,c(CH3CH2OH) = _______ mol·L-1,Kp=_______ MPa-2(分压=总压×物质的量分数)。
②若将该反应置于温度为T2K下进行,Kp2>Kp1则T2_______ (填“>”或“<”)T1,该反应在_______ (填“ 高温”“低温”或“任意温度”)条件下更有利于自发进行。
③下到说法能判断该反应达到平衡状态的是_______ (填标号)。
A.消耗1molCO时,生成1mol CH3OH
B.CH3CH2OH的浓度不再发生改变
C.混合气体的密度不变
D.容器压强不变
反应1:CH3OCH3(g)+CO(g)
 CH3COOCH3(g) △H1=akJ ·mol-1
CH3COOCH3(g) △H1=akJ ·mol-1反应2:
 CH3COOCH3(g)+H2(g)
CH3COOCH3(g)+H2(g) 
 CH3OH(g)+
CH3OH(g)+  CH3CH2OH(g) △H2=b kJ·mol-1
CH3CH2OH(g) △H2=b kJ·mol-1(1)CH3OCH3(g) +CO(g) +2H2(g)
 CH3OH(g) +CH3CH2OH(g)△H=。
CH3OH(g) +CH3CH2OH(g)△H=。 (2)在某恒容容器中发生反应1和反应2,达到平衡时,体系中物质的百分含量与温度的关系如图所示。由此推知,△H1

(3)T1 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3(g)、1 molCO(g)、2 mol H2(g) ,发生反应:CH3OCH3(g)+CO(g) +2H2(g)
 CH3OHg)+CH3CH2OH(g),10 min时反应达到平衡,此时CH3OH(g)的体积分数为
CH3OHg)+CH3CH2OH(g),10 min时反应达到平衡,此时CH3OH(g)的体积分数为 ,容器内压强为p MPa。
,容器内压强为p MPa。①0~10 min内,v(CH3OCH3)=
②若将该反应置于温度为T2K下进行,Kp2>Kp1则T2
③下到说法能判断该反应达到平衡状态的是
A.消耗1molCO时,生成1mol CH3OH
B.CH3CH2OH的浓度不再发生改变
C.混合气体的密度不变
D.容器压强不变
您最近一年使用:0次
2022-07-10更新
|
225次组卷
|
2卷引用:湖南省衡阳市部分校2021-2022学年高二下学期期末考试化学试题
3 . 甲酸(HCOOH)是重要的液态储氢原料。将温室气体 转化为甲酸既具有经济技术意义,又具有环保意义。
转化为甲酸既具有经济技术意义,又具有环保意义。
(1)已知 CO2
CO2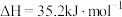 。该反应在理论上属于原子经济性100%的绿色工艺,但是该反应不能自发进行,判断依据是
。该反应在理论上属于原子经济性100%的绿色工艺,但是该反应不能自发进行,判断依据是___________ 。
(2)在实践中, 制备甲酸的一种流程如下:
制备甲酸的一种流程如下:

①写出过程II的离子方程式___________ 。
②过程II中,其他条件不变, 转化为
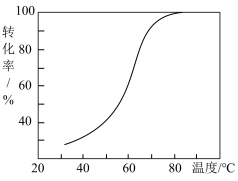
转化为 的转化率如图所示。则在40℃~80℃范围内转化率迅速上升,其主要原因可能是
的转化率如图所示。则在40℃~80℃范围内转化率迅速上升,其主要原因可能是___________ 。
(3)近期,天津大学化学团队以 与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图所示。
与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图所示。

①在 电极上发生的电极反应式为:
电极上发生的电极反应式为:___________ 。
②工作一段时间后,右侧电极室内辛胺溶液pH显著降低,原因为___________ 。
 转化为甲酸既具有经济技术意义,又具有环保意义。
转化为甲酸既具有经济技术意义,又具有环保意义。(1)已知
 CO2
CO2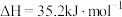 。该反应在理论上属于原子经济性100%的绿色工艺,但是该反应不能自发进行,判断依据是
。该反应在理论上属于原子经济性100%的绿色工艺,但是该反应不能自发进行,判断依据是(2)在实践中,
 制备甲酸的一种流程如下:
制备甲酸的一种流程如下:
①写出过程II的离子方程式
②过程II中,其他条件不变,
 转化为
转化为 的转化率如图所示。则在40℃~80℃范围内转化率迅速上升,其主要原因可能是
的转化率如图所示。则在40℃~80℃范围内转化率迅速上升,其主要原因可能是
(3)近期,天津大学化学团队以
 与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图所示。
与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图所示。
①在
 电极上发生的电极反应式为:
电极上发生的电极反应式为:②工作一段时间后,右侧电极室内辛胺溶液pH显著降低,原因为
您最近一年使用:0次
名校
4 . 二氧化碳的捕获、利用是实现碳中和的一个重要战略方向。回答下列问题:
(1)已知:常温下,反应CaO(s)+CO2(g) CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为____ (填“吸热”或“放热”)反应;上述反应达到平衡后,若其他条件不变,增大CaO的用量,CO2的转化率将____ (填“增大”“减小”或“不变”)。
(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
反应II.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1
①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1____ (填“>”“=”或“<”)p2,推断的依据是____ 。
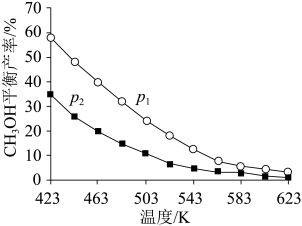
②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为_____ (用分数表示)。
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO ):c(CO
):c(CO )=1:
)=1:____ :____ 。(用Ka1、Ka2表示)
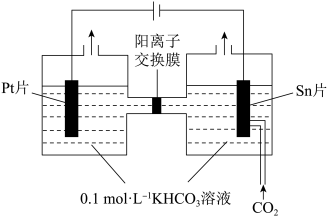
(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:____ 。
(1)已知:常温下,反应CaO(s)+CO2(g)
 CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1

②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO
 ):c(CO
):c(CO )=1:
)=1:(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:

您最近一年使用:0次
2022-07-14更新
|
109次组卷
|
3卷引用:辽宁省朝阳市建平县2021-2022学年高二下学期期末考试化学试题
名校
解题方法
5 . 我国“十四五”规划提出要制定2030年前碳达峰行动方案,努力争取2060年前实现碳中和。为此,研发CO2转化利用技术成为重要科技目标。
(1)以CO2为原料加氢可以合成甲醇,将n(H2)/n(CO2)=3的混合气体充入体积为V L的密闭容器中,在催化剂存在的条件下进行以下两个反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1<0
CH3OH(g)+H2O(g) △H1<0
CO2(g)+H2(g) CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0
测得温度与转化率、产物选择性的关系如图所示。
CH3OH选择性=

①270°C以后CO2转化率随温度升高而增大的原因可能是___________ 。
②有利于提高CH3OH选择性的反应条件可以是___________ (填标号)。
A.降低温度 B.使用更合适的催化剂
C.增大压强 D.原料气中掺入适量的CO
③控制温度240°C,测得混合气体流速为a L· h-1(已换算为标准状况),则CO2的反应速率___________ mol·L-1·min-1(写出计算式)。
(2)以CO2和NH3为原料合成尿素。在尿素合成塔中的主要反应可表示如下:
i: 2NH3(g)+CO2(g) NH2CO2NH4(s) △H=- 1 59.5kJ·mol-1
NH2CO2NH4(s) △H=- 1 59.5kJ·mol-1
ii: NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H= +72.5kJ·mol-1
CO(NH2)2(s)+H2O(g) △H= +72.5kJ·mol-1
iii: 2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H
CO(NH2)2(s)+H2O(g) △H
④反应iii的△H=___________ kJ·mol-1。3个反应的△G(自由能变化)随温度的变化关系如图所示,图中对应于反应iii的线是___________ (填字母)。

⑤一定条件下的恒容容器中,充入原料气3molNH3和1molCO2,平衡时CO2的转化率为0.5,则平衡时NH3和CO2的物质的量比为___________ ,已知反应ii的Kp=p,测得平衡时容器内总压为ap,则反应iii的平衡常数Kp=___________ 。
(1)以CO2为原料加氢可以合成甲醇,将n(H2)/n(CO2)=3的混合气体充入体积为V L的密闭容器中,在催化剂存在的条件下进行以下两个反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1<0
CH3OH(g)+H2O(g) △H1<0CO2(g)+H2(g)
 CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0测得温度与转化率、产物选择性的关系如图所示。
CH3OH选择性=


①270°C以后CO2转化率随温度升高而增大的原因可能是
②有利于提高CH3OH选择性的反应条件可以是
A.降低温度 B.使用更合适的催化剂
C.增大压强 D.原料气中掺入适量的CO
③控制温度240°C,测得混合气体流速为a L· h-1(已换算为标准状况),则CO2的反应速率
(2)以CO2和NH3为原料合成尿素。在尿素合成塔中的主要反应可表示如下:
i: 2NH3(g)+CO2(g)
 NH2CO2NH4(s) △H=- 1 59.5kJ·mol-1
NH2CO2NH4(s) △H=- 1 59.5kJ·mol-1ii: NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) △H= +72.5kJ·mol-1
CO(NH2)2(s)+H2O(g) △H= +72.5kJ·mol-1iii: 2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H
CO(NH2)2(s)+H2O(g) △H④反应iii的△H=

⑤一定条件下的恒容容器中,充入原料气3molNH3和1molCO2,平衡时CO2的转化率为0.5,则平衡时NH3和CO2的物质的量比为
您最近一年使用:0次
2022-06-15更新
|
475次组卷
|
3卷引用:浙江省余姚中学2023-2024学年高二上学期第一次月考化学试题
解题方法
6 . 以 、
、 为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量(
为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量( )变化如图所示,下列说法正确的是
)变化如图所示,下列说法正确的是
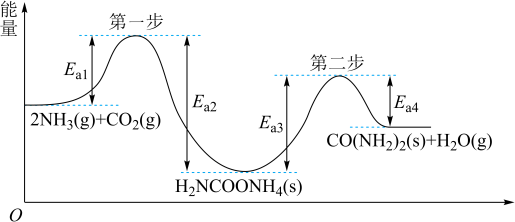
 、
、 为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量(
为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量(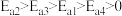 )变化如图所示,下列说法正确的是
)变化如图所示,下列说法正确的是
A.由图知 和 和 在一定条件下发生有效碰撞直接生成了 在一定条件下发生有效碰撞直接生成了 和 和 |
| B.第二步反应是合成尿素的决速步骤 |
| C.该过程的总反应在高温条件下有利于自发进行 |
D.合成尿素的热化学方程式为  |
您最近一年使用:0次
2022-05-16更新
|
178次组卷
|
2卷引用:安徽省示范高中培优联盟 2021-2022学年高二下学期春季联赛化学试题
名校
7 . 以煤为原料可合成一系列燃料。回答下列问题:
(1)向1L恒容密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g) CH3OCH3(l)+H2O(l) △H=+71kJ·mol-l
CH3OCH3(l)+H2O(l) △H=+71kJ·mol-l
①该反应_______ 自发进行(填“能”、“不能”或“无法判断”);
②下列叙述能说明此反应达到平衡状态的是_______ 。
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H 键断裂
(2)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0,在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g) △H<0,在一定条件下,某反应过程中部分数据如下表:
①0~10min内,用H2O(g)表示的化学反应速率v(H2O)=_______ mol/(L ·min)。
②T1℃,该反应的平衡常数K=_______ (用分数表示),平衡时H2的转化率是_______ 。
③在其它条件不变的情况下,若30min时改变温度为T2℃,再次平衡时H2的物质的量为3.2mol,则T1_______ T2(填“>”“<”或“=”),理由是_______ ; 在其他条件不变的情况下,若30min时向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡_______ 移动(填“正向”、“逆向”或“不”)。
(1)向1L恒容密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)
 CH3OCH3(l)+H2O(l) △H=+71kJ·mol-l
CH3OCH3(l)+H2O(l) △H=+71kJ·mol-l①该反应
②下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H 键断裂
(2)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H<0,在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g) △H<0,在一定条件下,某反应过程中部分数据如下表:| 反应条件 | 反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol |
| 恒温恒容(T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 |
②T1℃,该反应的平衡常数K=
③在其它条件不变的情况下,若30min时改变温度为T2℃,再次平衡时H2的物质的量为3.2mol,则T1
您最近一年使用:0次
名校
8 .  在工业生产中具有重要作用。
在工业生产中具有重要作用。
(1)
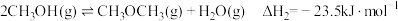
①已知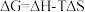 ,反应
,反应 的
的 随温度的变化是图1中的
随温度的变化是图1中的___________ (填“ ”或“
”或“ ”)。
”)。
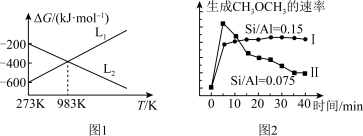
②工业以 为原料合成
为原料合成 是在一定温度和压强下,以
是在一定温度和压强下,以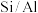 混合物作为催化剂,向反应炉中匀速通入
混合物作为催化剂,向反应炉中匀速通入 ,不同硅铝比
,不同硅铝比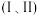 与生成
与生成 的速率关系如图2所示。下列说法正确的是
的速率关系如图2所示。下列说法正确的是___________ 。
A.温度越低越有利于工业合成
B.合适的硅铝比为0.15
C.在原料气 中混入适量的惰性气体对
中混入适量的惰性气体对 的生成速率无影响
的生成速率无影响
D.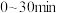 内,
内, 的产量
的产量
(2)已知在催化剂M作用下,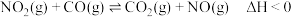 。
。
①一定温度下,假设正逆反应速率与浓度关系为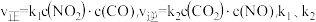 只与温度相关,则反应的平衡常数
只与温度相关,则反应的平衡常数
___________ (用含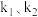 的式子表示)。
的式子表示)。
②催化剂M活性随温度变化情况如图3所示,相同时间测得 的转化率随反应温度变化情况如图4所示,写出
的转化率随反应温度变化情况如图4所示,写出 的转化率出现上述变化的可能原因(写出两点):
的转化率出现上述变化的可能原因(写出两点):___________ 。
③在图4中画出,其他条件不变,增大压强(催化剂不失活)情况下, 的转化率随温度变化图
的转化率随温度变化图___________ 。
(3)已知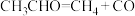 ,用
,用 催化该反应,若
催化该反应,若 首先在
首先在 催化下生成
催化下生成 和
和 及另一种无机化合物,用两个化学方程式表示该催化反应历程(反应机理):步骤i:
及另一种无机化合物,用两个化学方程式表示该催化反应历程(反应机理):步骤i:___________ ;步骤ⅱ:___________ 。
 在工业生产中具有重要作用。
在工业生产中具有重要作用。(1)

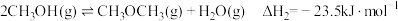
①已知
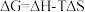 ,反应
,反应 的
的 随温度的变化是图1中的
随温度的变化是图1中的 ”或“
”或“ ”)。
”)。
②工业以
 为原料合成
为原料合成 是在一定温度和压强下,以
是在一定温度和压强下,以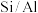 混合物作为催化剂,向反应炉中匀速通入
混合物作为催化剂,向反应炉中匀速通入 ,不同硅铝比
,不同硅铝比 与生成
与生成 的速率关系如图2所示。下列说法正确的是
的速率关系如图2所示。下列说法正确的是A.温度越低越有利于工业合成

B.合适的硅铝比为0.15
C.在原料气
 中混入适量的惰性气体对
中混入适量的惰性气体对 的生成速率无影响
的生成速率无影响D.
 内,
内, 的产量
的产量
(2)已知在催化剂M作用下,
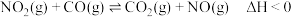 。
。①一定温度下,假设正逆反应速率与浓度关系为
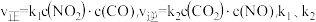 只与温度相关,则反应的平衡常数
只与温度相关,则反应的平衡常数
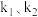 的式子表示)。
的式子表示)。②催化剂M活性随温度变化情况如图3所示,相同时间测得
 的转化率随反应温度变化情况如图4所示,写出
的转化率随反应温度变化情况如图4所示,写出 的转化率出现上述变化的可能原因(写出两点):
的转化率出现上述变化的可能原因(写出两点):
③在图4中画出,其他条件不变,增大压强(催化剂不失活)情况下,
 的转化率随温度变化图
的转化率随温度变化图(3)已知
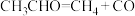 ,用
,用 催化该反应,若
催化该反应,若 首先在
首先在 催化下生成
催化下生成 和
和 及另一种无机化合物,用两个化学方程式表示该催化反应历程(反应机理):步骤i:
及另一种无机化合物,用两个化学方程式表示该催化反应历程(反应机理):步骤i:
您最近一年使用:0次
2022-03-29更新
|
760次组卷
|
4卷引用:浙江乐清市知临中学2022-2023学年高二上学期期中考试化学试题
浙江乐清市知临中学2022-2023学年高二上学期期中考试化学试题浙江省普通高中强基联盟2021-2022学年高三下学期3月统测化学试题(已下线)化学-2022年高考押题预测卷02(浙江卷)(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)
解题方法
9 .  是重要的化工原料,经一系列反应可得到
是重要的化工原料,经一系列反应可得到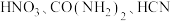 等产品。以NH3和CO2为原料生产尿素的反应如下:
等产品。以NH3和CO2为原料生产尿素的反应如下:
反应Ⅰ:2NH3(l)+CO2(g)=NH2COONH4(l) △H1= a
反应Ⅱ:NH2COONH4(l) =NH2CONH2(l)+H2O(l) △H2= b
(1)已知: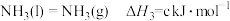 。
。
反应2NH3(g)+CO2(g)=NH2CONH2(l)+H2O(l) △H4=_______  (用含a、b、c的式子表示),该反应在一定温度下能自发进行,则
(用含a、b、c的式子表示),该反应在一定温度下能自发进行,则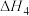
_______ 0(填“>”或“<”)。
(2)一定条件下,在一容积为0.5 L密闭容器中投入4 molNH3和1 molCO2,测得各组分物质的量随时间变化如图所示。

①下列说法正确的是_______ (填序号)。
A.选择合适的碳氮比有利于提高产率
B.过量氨气可以与反应生成的水结合,有利于尿素合成
C.气体物质的量不再变化时,反应达到平衡状态
②反应Ⅰ的活化能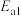
_______ 反应Ⅱ的活化能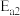 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
③反应Ⅰ的平衡常数=_______ (保留一位小数)。(写出计算过程)
 是重要的化工原料,经一系列反应可得到
是重要的化工原料,经一系列反应可得到 等产品。以NH3和CO2为原料生产尿素的反应如下:
等产品。以NH3和CO2为原料生产尿素的反应如下:反应Ⅰ:2NH3(l)+CO2(g)=NH2COONH4(l) △H1= a

反应Ⅱ:NH2COONH4(l) =NH2CONH2(l)+H2O(l) △H2= b

(1)已知:
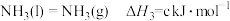 。
。反应2NH3(g)+CO2(g)=NH2CONH2(l)+H2O(l) △H4=
 (用含a、b、c的式子表示),该反应在一定温度下能自发进行,则
(用含a、b、c的式子表示),该反应在一定温度下能自发进行,则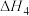
(2)一定条件下,在一容积为0.5 L密闭容器中投入4 molNH3和1 molCO2,测得各组分物质的量随时间变化如图所示。

①下列说法正确的是
A.选择合适的碳氮比有利于提高产率
B.过量氨气可以与反应生成的水结合,有利于尿素合成
C.气体物质的量不再变化时,反应达到平衡状态
②反应Ⅰ的活化能
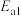
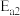 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。③反应Ⅰ的平衡常数=
您最近一年使用:0次
解题方法
10 . 氯气是一种重要的化工原料。
(1)工业生产氯化物通常用由氧化物经氯化作用生成的方法,例如工业上常采用“加碳氯化”的方法以高钛渣(主要成分为 )为原料生产
)为原料生产 。
。
已知:
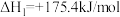 ;
;
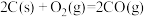
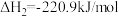 。
。
沸腾炉中“加碳氯化”生成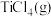 和
和 的热化学方程式:
的热化学方程式:___________ 。
(2) 合成有机物时会产生副产物
合成有机物时会产生副产物 。利用反应
。利用反应 可实现氯的循环利用。
可实现氯的循环利用。
①该反应的
___________ 0(填“>”“<”或“=”)。
②若反应物按物质的量 (
(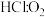 )在体积不变的密闭容器中发生该反应,下列叙述正确的是
)在体积不变的密闭容器中发生该反应,下列叙述正确的是___________ (填字母)。
A.当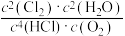 不变时,说明反应已达到平衡状态
不变时,说明反应已达到平衡状态
B.当 时,说明反应已达到平衡状态
时,说明反应已达到平衡状态
C.平衡后,继续按 的物质的量之比投入
的物质的量之比投入 和
和 ,再次达到新平衡时,
,再次达到新平衡时, 的转化率增大
的转化率增大
D.平衡后,分离出 ,可以提高
,可以提高 的平衡产率,并加快正反应速率
的平衡产率,并加快正反应速率
③下图是在两个不同温度 和
和 下,改变
下,改变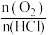 时
时 在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是
在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是___________ (填字母)。

A.a点未达到平衡,c点一定已经平衡
B.平衡常数: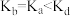
C.达到平衡时 的转化率大小为a>b>c
的转化率大小为a>b>c
D.若平衡常数K值变大,达新平衡前 始终减小
始终减小
(3)在一定温度下,以 为催化剂,氯苯(
为催化剂,氯苯(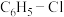 )和
)和 在
在 中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:
中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:
i.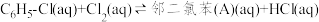
ii.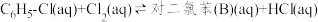
向盛有 含有
含有 的
的 的容器中加入
的容器中加入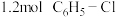 和
和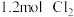 发生反应,忽略
发生反应,忽略 溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。

①该温度下,反应ii的化学平衡常数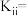
___________ 。
②工业生产上,提高生成邻二氯苯(A)反应选择性的关键因素是选择合适的___________ 。
(1)工业生产氯化物通常用由氧化物经氯化作用生成的方法,例如工业上常采用“加碳氯化”的方法以高钛渣(主要成分为
 )为原料生产
)为原料生产 。
。已知:

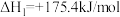 ;
;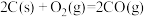
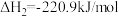 。
。沸腾炉中“加碳氯化”生成
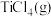 和
和 的热化学方程式:
的热化学方程式:(2)
 合成有机物时会产生副产物
合成有机物时会产生副产物 。利用反应
。利用反应 可实现氯的循环利用。
可实现氯的循环利用。①该反应的

②若反应物按物质的量
 (
(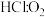 )在体积不变的密闭容器中发生该反应,下列叙述正确的是
)在体积不变的密闭容器中发生该反应,下列叙述正确的是A.当
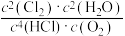 不变时,说明反应已达到平衡状态
不变时,说明反应已达到平衡状态B.当
 时,说明反应已达到平衡状态
时,说明反应已达到平衡状态C.平衡后,继续按
 的物质的量之比投入
的物质的量之比投入 和
和 ,再次达到新平衡时,
,再次达到新平衡时, 的转化率增大
的转化率增大D.平衡后,分离出
 ,可以提高
,可以提高 的平衡产率,并加快正反应速率
的平衡产率,并加快正反应速率③下图是在两个不同温度
 和
和 下,改变
下,改变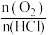 时
时 在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是
在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是
A.a点未达到平衡,c点一定已经平衡
B.平衡常数:
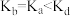
C.达到平衡时
 的转化率大小为a>b>c
的转化率大小为a>b>cD.若平衡常数K值变大,达新平衡前
 始终减小
始终减小(3)在一定温度下,以
 为催化剂,氯苯(
为催化剂,氯苯(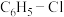 )和
)和 在
在 中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:
中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:i.
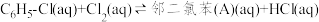
ii.
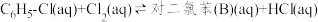
向盛有
 含有
含有 的
的 的容器中加入
的容器中加入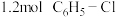 和
和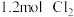 发生反应,忽略
发生反应,忽略 溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
①该温度下,反应ii的化学平衡常数
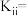
②工业生产上,提高生成邻二氯苯(A)反应选择性的关键因素是选择合适的
您最近一年使用:0次



