解题方法
1 . I.已知水在25℃和95℃时的电离平衡曲线如图所示:

(1)25℃时水的电离平衡曲线应为_______ (填“A”或“B”)。
(2)95℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______ 。
(3)25℃时,等体积的pH=12的NaOH溶液和氨水分别与0.1mol•L-1的盐酸发生中和反应,恰好完全反应时消耗盐酸的体积_______ (填“前者多”“后者多”或“一样多”)。
Ⅱ.NaOH溶液可用于多种气体的处理。
(4)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。Na2CO3俗称纯碱,因CO 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO 第一步水解的离子方程式
第一步水解的离子方程式_______ 。已知25℃时,CO 第一步水解的平衡常数Kh=2×10-4,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4,当溶液中c(HCO ):c(CO
):c(CO )=20:1时,溶液的pH=
)=20:1时,溶液的pH=_______ 。
(5)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1CH3COONa溶液,则两份溶液中c(NO )、c(NO
)、c(NO )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为_______ (已知HNO2的电离常数Ka=5.6×10-4,CH3COOH的电离常数Ka=1.75×10-5)。可使溶液A和溶液B的pH相等的方法是_______ (填字母)。
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水

(1)25℃时水的电离平衡曲线应为
(2)95℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)25℃时,等体积的pH=12的NaOH溶液和氨水分别与0.1mol•L-1的盐酸发生中和反应,恰好完全反应时消耗盐酸的体积
Ⅱ.NaOH溶液可用于多种气体的处理。
(4)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。Na2CO3俗称纯碱,因CO
 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO 第一步水解的离子方程式
第一步水解的离子方程式 第一步水解的平衡常数Kh=2×10-4,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4,当溶液中c(HCO ):c(CO
):c(CO )=20:1时,溶液的pH=
)=20:1时,溶液的pH=(5)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1CH3COONa溶液,则两份溶液中c(NO
 )、c(NO
)、c(NO )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
您最近一年使用:0次
解题方法
2 . 如图是一个化学过程的示意图,回答下列问题:

(1)甲装置中通入C3H8的电极反应式为___________ ,丙装置中D极的产物是___________ (写化学式)。
(2)一段时间,当乙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=___________ 。(已知NaCl溶液足量,假定生成的氯气完全逸出,且电解后溶液体积为200mL)。
(3)若要使乙池恢复电解前的状态,应向乙池中加入___________ (写物质化学式)。

(1)甲装置中通入C3H8的电极反应式为
(2)一段时间,当乙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=
(3)若要使乙池恢复电解前的状态,应向乙池中加入
您最近一年使用:0次
名校
3 . (1)醋酸钠水溶液pH>7,原因是(用离子方程式表示):_______ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______ 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入适量的_______ 。
(4)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于_______
(5)已知Ksp(BaSO4)=1.1×10-10,若向50mL0.008mol·L-1的BaCl2溶液中加入50mL0.01mol·L-1的硫酸,混合后溶液中的Ba2+的浓度为_______ mol·L-1,pH为_______ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入适量的
(4)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于
(5)已知Ksp(BaSO4)=1.1×10-10,若向50mL0.008mol·L-1的BaCl2溶液中加入50mL0.01mol·L-1的硫酸,混合后溶液中的Ba2+的浓度为
您最近一年使用:0次
2021-03-02更新
|
212次组卷
|
3卷引用:江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题
名校
4 . 按要求回答下列问题:
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是___ 。
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中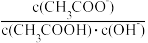 不变 D.溶液中
不变 D.溶液中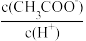 减小
减小
(2)常温下将0.15mol/L稀硫酸V1mL与0.1mol/L NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=___ (溶液体积变化忽略不计)。
(3)常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,则该溶液的pH可能是___ 。
(4)常温下,在pH=9的CH3COONa溶液中,由水电离出的OH-浓度___ 。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
已知部分弱酸的电离平衡常数如下表:
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__ ;
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)__ 。
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中
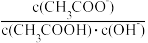 不变 D.溶液中
不变 D.溶液中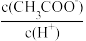 减小
减小(2)常温下将0.15mol/L稀硫酸V1mL与0.1mol/L NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=
(3)常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,则该溶液的pH可能是
(4)常温下,在pH=9的CH3COONa溶液中,由水电离出的OH-浓度
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)
您最近一年使用:0次
2019-11-26更新
|
248次组卷
|
2卷引用:江西省万载中学2019-2020学年高二12月月考化学试题
名校
5 . (1)已知常温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH=________ ,此酸的电离平衡常数K=________ ,由HA电离出的H+的浓度约为水电离出的H+的浓度的________ 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是________________ ,向其中加入少量KOH溶液时,发生反应的离子方程式是________________ 。
②现将0.04 mol·L-1 HA溶液和0.02 mol·L-1 NaOH溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)________ c(CN-)(填“<”、“=”或“>”)。
b.若HA为CH3COOH,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是____________________________ 。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是
②现将0.04 mol·L-1 HA溶液和0.02 mol·L-1 NaOH溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)
b.若HA为CH3COOH,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是
您最近一年使用:0次
2019-01-28更新
|
269次组卷
|
3卷引用:【南昌新东方】莲塘一中2020届高二11月质量检测
(已下线)【南昌新东方】莲塘一中2020届高二11月质量检测山东省菏泽市第一中学老校区2018-2019学年高二上学期期末模拟化学试题新疆北屯高级中学2020-2021学年高二上学期10月月考化学试题
12-13高二·全国·课时练习
解题方法
6 . 已知95 ℃时水的离子积KW=1×10-12,25 ℃时KW=1×10-14,回答下列问题:
(1)95 ℃时水的电离常数K(95 ℃)________ 25 ℃时水的电离常数(填“>”、“=”或“<”)。
(2)95 ℃纯水中c(H+)________ c(OH-)。(填“>”、“=”或“<”)
(3)95 ℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol/L,此时pH=________ 。
(1)95 ℃时水的电离常数K(95 ℃)
(2)95 ℃纯水中c(H+)
(3)95 ℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol/L,此时pH=
您最近一年使用:0次
2016-12-09更新
|
448次组卷
|
4卷引用:江西省临川实验学校2017-2018学年高二上学期期末质量检测化学试题
江西省临川实验学校2017-2018学年高二上学期期末质量检测化学试题(已下线)2012年人教版高中化学选修4 3.2水的电离和溶液的酸碱性练习卷【全国市级联考】甘肃省武威第五中学、武威三中、武威七中、武威十六中2017-2018学年高二下学期期末联考化学试题吉林省白城市第十四中学2021-2022学年高二上学期期中考试化学试卷题



