1 . 如图1所示,A为新型高效的甲烷燃料电池,采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。B为浸透饱和硫酸钠和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料、电解质溶液见图。

(1)甲烷燃料电池负极的电极反应式为___________ 。
(2)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向d端移动,则电源a端为_____ 极,通电一段时间后,观察到滤纸c端出现的现象是___________ 。
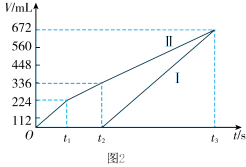
(3)D装置中有200 mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的标况下体积随时间变化的关系如图2所示,原混合溶液中NaCl的物质的量浓度_______ mol·L-1,t2时所得溶液的pH=_____ 。(电解前后溶液的体积变化关系忽略不计)
(4)若C装置中溶液为AgNO3且足量,总反应的离子方程式为___________ 。电解结束后,为了使溶液恢复原样,则可以在反应后的溶液中加入___________ (填化学式)。

(1)甲烷燃料电池负极的电极反应式为
(2)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向d端移动,则电源a端为
(3)D装置中有200 mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的标况下体积随时间变化的关系如图2所示,原混合溶液中NaCl的物质的量浓度

(4)若C装置中溶液为AgNO3且足量,总反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 回答下列问题:
(1)常温下,某溶液中由水电离出的c(OH-)=1.0×10-10mol•L-1,该溶液可以是______ (填字母)。
a.pH=4的CH3COOH b.pH=10的NaOH c.pH=2的H2SO4
(2)某温度下,向pH=6的蒸馏水中加入2.3g的金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=______ 。
(3)常温下,向pH=4的醋酸和c(H+)=1.0×10-4mol•L-1的稀硫酸中分别加入大小、质量相同的金属锌,反应刚开始时,产生H2的速率前者与后者相比是______ (填字母)。
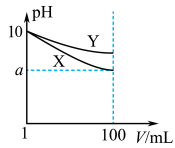
(4)常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是______ (填字母)。
(5)常温下,分别用pH为10和11的氨水中和等量的盐酸,若所需氨水的体积分别为V1和V2,则V1______ 10V2(填“>”“=”或“<”)。
(6)常温下,将pH=6的硫酸稀释1000倍,稀释后溶液中c(H+):c(SO )=
)=______ 。
(1)常温下,某溶液中由水电离出的c(OH-)=1.0×10-10mol•L-1,该溶液可以是
a.pH=4的CH3COOH b.pH=10的NaOH c.pH=2的H2SO4
(2)某温度下,向pH=6的蒸馏水中加入2.3g的金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=
(3)常温下,向pH=4的醋酸和c(H+)=1.0×10-4mol•L-1的稀硫酸中分别加入大小、质量相同的金属锌,反应刚开始时,产生H2的速率前者与后者相比是
| A.一样快 | B.前者快 | C.后者快 | D.无法比较 |
(4)常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是

| A.X、Y两种碱溶液中溶质的物质的量浓度一定相等 |
| B.稀释后,两种碱溶液中和硫酸的能力Y大于X |
| C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积Vx>VY |
| D.若8<a<10,则X、Y都是弱碱 |
(5)常温下,分别用pH为10和11的氨水中和等量的盐酸,若所需氨水的体积分别为V1和V2,则V1
(6)常温下,将pH=6的硫酸稀释1000倍,稀释后溶液中c(H+):c(SO
 )=
)=
您最近一年使用:0次
3 . 已知室温时,0.1 mol·L-1的氨水在水中有 1% 发生电离,回答下列各问题:
(1)溶液的pH=___________ 。
(2)该温度下NH3·H2O的电离平衡常数K=___________  。
。
(3)升高温度时,K将___________ (填“增大”、“减小”或“不变”),pH将___________ (填“增大”、“减小”或“不变”)。
(4)由0.1 mol·L-1的氨水电离出的c(OH-)约为水电离出的c(OH-)的___________ 倍。
(5)要使溶液中c(OH-)/c(NH3·H2O)值增大,可以采取的措施是___________ (填序号)。
①通入少量HCl ②升高温度 ③加少量NaOH固体 ④加水
(1)溶液的pH=
(2)该温度下NH3·H2O的电离平衡常数K=
 。
。(3)升高温度时,K将
(4)由0.1 mol·L-1的氨水电离出的c(OH-)约为水电离出的c(OH-)的
(5)要使溶液中c(OH-)/c(NH3·H2O)值增大,可以采取的措施是
①通入少量HCl ②升高温度 ③加少量NaOH固体 ④加水
您最近一年使用:0次
2021-05-13更新
|
938次组卷
|
5卷引用:山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题
山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题(已下线)作业07 电离平衡-2021年高二化学暑假作业(人教版2019)(已下线)3.1.2 电离平衡常数(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第17讲 溶液的酸碱性与pH的计算-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)第三章 第二节 水的电离和溶液的pH 第1课时 水的电离 溶液的酸碱性与pH
10-11高二·天津·阶段练习
名校
解题方法
4 . 在25℃时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该NaOH溶液中和,需VbLNaOH溶液,填空:
(1)若a+b=14,则Va:Vb=_________ (填数字)。
(2)若a+b=13,则Va:Vb=_________ (填数字)。
(3)若a+b>14,则Va:Vb=_________ (填表达式),且Va__________ Vb(填:>、<、=)(题中a≤6、b≥8)。
(1)若a+b=14,则Va:Vb=
(2)若a+b=13,则Va:Vb=
(3)若a+b>14,则Va:Vb=
您最近一年使用:0次
2020-05-29更新
|
282次组卷
|
13卷引用:2011-2012学年山东济宁金乡一中高二12月月考化学试卷
(已下线)2011-2012学年山东济宁金乡一中高二12月月考化学试卷(已下线)2011-2012学年天津市蓟县一中高二第二次月考化学试卷(已下线)2011-2012学年天津市蓟县一中高二第三次月考化学试卷(已下线)2012年鲁科版高中化学选修4 3.1水溶液卷练习卷2014-2015学年宁夏育才中学高二上学期期中化学试卷2015-2016学年西藏日喀则中学高二上12月月考化学试卷云南普洱市景东县第一中学2019-2020学年高二下学期期中考试化学试题(已下线)3.2.1 溶液的酸碱性(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)云南省保山第九中学2019-2020学年高二下学期期末考试化学试题广西桂林市临桂区五通中学2021-2022学年高二下学期期中考试化学试题陕西省西安市西航一中2021-2022学年高二上学期第二次月考化学试题作业(十七) 水溶液的酸碱性与pH海南省农垦中学2023-2024学年高二上学期期末考试化学试题(B卷)
名校
5 . 醋酸和一水合氨是中学化学中常见的弱电解质。
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是__ (填序号)
①配制一定量的0.10mol/LCH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质
(2)若25℃时,0.10mol/L的CH3COOH的电离度为1%,则该溶液的pH=___ ,由醋酸电离出的c(H+)约为水电离出的c(H+)的___ 倍。
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是
①配制一定量的0.10mol/LCH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质
(2)若25℃时,0.10mol/L的CH3COOH的电离度为1%,则该溶液的pH=
您最近一年使用:0次
名校
6 . (1)已知常温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH=________ ,此酸的电离平衡常数K=________ ,由HA电离出的H+的浓度约为水电离出的H+的浓度的________ 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是________________ ,向其中加入少量KOH溶液时,发生反应的离子方程式是________________ 。
②现将0.04 mol·L-1 HA溶液和0.02 mol·L-1 NaOH溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)________ c(CN-)(填“<”、“=”或“>”)。
b.若HA为CH3COOH,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是____________________________ 。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是
②现将0.04 mol·L-1 HA溶液和0.02 mol·L-1 NaOH溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)
b.若HA为CH3COOH,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是
您最近一年使用:0次
2019-01-28更新
|
269次组卷
|
3卷引用:山东省菏泽市第一中学老校区2018-2019学年高二上学期期末模拟化学试题
山东省菏泽市第一中学老校区2018-2019学年高二上学期期末模拟化学试题(已下线)【南昌新东方】莲塘一中2020届高二11月质量检测新疆北屯高级中学2020-2021学年高二上学期10月月考化学试题
7 . 某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下水的离子积为______ 。
(2)该温度下0.01 mol/L NaOH溶液的pH为____ 。
(3)该温度下,将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,混合溶液呈中性,则Va﹕Vb=_______

(1)该温度下水的离子积为
(2)该温度下0.01 mol/L NaOH溶液的pH为
(3)该温度下,将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,混合溶液呈中性,则Va﹕Vb=
您最近一年使用:0次
10-11高二上·山东济南·阶段练习
8 . 25℃时,0.1 mol/LHCl溶液中,[Cl-] =__________ ,[ OH-] =___________ ,Kw=______________ ;
若向15mL此溶液中加入15mL 0.3 mol/L NaOH溶液,则混合液pH=________ 。
若向15mL此溶液中加入15mL 0.3 mol/L NaOH溶液,则混合液pH=
您最近一年使用:0次



