名校
1 . 滴定分析法是物质检验与含量测定的重要方法之一,在实际生产中应用广泛。

(1) 时,利用
时,利用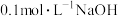 溶液滴定未知浓度的
溶液滴定未知浓度的 溶液,取
溶液,取 溶液进行实验,滴定过程中溶液的
溶液进行实验,滴定过程中溶液的 随滴加
随滴加 溶液体积的变化如图所示,a点为滴定的化学计量点。
溶液体积的变化如图所示,a点为滴定的化学计量点。
①以下哪种指示剂可用于本次滴定实验___________ (括号中为指示剂变色的 范围)。
范围)。
a.酚酞(8.2-10.0) b.甲基橙(3.1-4.4) c.甲基红(4.4-6.2)
② 溶液的浓度为
溶液的浓度为___________  。
。
③滴定过程中,加入 的体积为
的体积为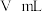 时,测得溶液
时,测得溶液 ,此时溶液中的溶质为
,此时溶液中的溶质为___________ (填物质的化学式),溶液中
___________  (用含V的计算式表示)。
(用含V的计算式表示)。
(2)在酸碱滴定中,还可以通过溶液的电导率判断化学计量点。 时,利用
时,利用 的
的 溶液滴定
溶液滴定 溶液,取
溶液,取 溶液进行实验,滴定过程中溶液电导率随滴加
溶液进行实验,滴定过程中溶液电导率随滴加 溶液体积的变化如图所示,测得
溶液体积的变化如图所示,测得 溶液的浓度为
溶液的浓度为 。
。

①到达滴定终点时,溶液电导率不为0,原因是___________ 。
②b点溶液的
___________ 。

(1)
 时,利用
时,利用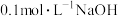 溶液滴定未知浓度的
溶液滴定未知浓度的 溶液,取
溶液,取 溶液进行实验,滴定过程中溶液的
溶液进行实验,滴定过程中溶液的 随滴加
随滴加 溶液体积的变化如图所示,a点为滴定的化学计量点。
溶液体积的变化如图所示,a点为滴定的化学计量点。①以下哪种指示剂可用于本次滴定实验
 范围)。
范围)。a.酚酞(8.2-10.0) b.甲基橙(3.1-4.4) c.甲基红(4.4-6.2)
②
 溶液的浓度为
溶液的浓度为 。
。③滴定过程中,加入
 的体积为
的体积为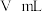 时,测得溶液
时,测得溶液 ,此时溶液中的溶质为
,此时溶液中的溶质为
 (用含V的计算式表示)。
(用含V的计算式表示)。(2)在酸碱滴定中,还可以通过溶液的电导率判断化学计量点。
 时,利用
时,利用 的
的 溶液滴定
溶液滴定 溶液,取
溶液,取 溶液进行实验,滴定过程中溶液电导率随滴加
溶液进行实验,滴定过程中溶液电导率随滴加 溶液体积的变化如图所示,测得
溶液体积的变化如图所示,测得 溶液的浓度为
溶液的浓度为 。
。
①到达滴定终点时,溶液电导率不为0,原因是
②b点溶液的

您最近一年使用:0次
名校
解题方法
2 . 已知:25℃时,CH3COOH和NH3•H2O的电离平衡常数近似相等。
(1)关于0.1mol•L-1CH3COOH溶液,回答下列问题。
①25℃时,测得0.1mol•L-1CH3COOH溶液的pH=3,则由水电离出的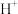 的浓度为
的浓度为_____ mol•L-1。
②CH3COONa溶液显_____ (填“酸性”、“碱性”或“中性”),用离子方程式表示其原因:_____ 。
(2)关于0.1mol•L-1氨水,回答下列问题。
①NH3•H2O的电离方程式为_____ ,NH3•H2O的电离平衡常数表达式:Kb=_____ 。
②25℃时,0.1mol•L-1氨水的pH=_____ 。
③25℃时,向10mL0.1mol•L-1氨水中加入同体积同浓度的盐酸。下列说法正确的是_____ 。
a.c(Cl-)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
b.c(Cl-)=c(NH )+c(NH3•H2O)
)+c(NH3•H2O)
(1)关于0.1mol•L-1CH3COOH溶液,回答下列问题。
①25℃时,测得0.1mol•L-1CH3COOH溶液的pH=3,则由水电离出的
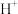 的浓度为
的浓度为②CH3COONa溶液显
(2)关于0.1mol•L-1氨水,回答下列问题。
①NH3•H2O的电离方程式为
②25℃时,0.1mol•L-1氨水的pH=
③25℃时,向10mL0.1mol•L-1氨水中加入同体积同浓度的盐酸。下列说法正确的是
a.c(Cl-)>c(NH
 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)b.c(Cl-)=c(NH
 )+c(NH3•H2O)
)+c(NH3•H2O)
您最近一年使用:0次
2023-01-07更新
|
382次组卷
|
4卷引用:北京市西城区2022-2023学年高二上学期1月期末考试化学试题
3 . 磷的含氧酸及其盐是一类重要的化工产品,广泛用于食品、肥料、去油去污、防腐蚀、防锈、锅炉水处理等。请回答下列问题:
(1)次磷酸(H3PO2)是一种精细化工产品。向10 mL0.02 mol • L-1H3PO2溶液中加入20 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有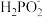 、OH-两种阴离子,则H3PO2是
、OH-两种阴离子,则H3PO2是_______ (填“一元酸”、“二元酸”或“三元酸”)。
(2)已知25℃时K(H3PO2) =1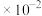 ,该H3PO2溶液的PH为
,该H3PO2溶液的PH为__________ 。
(3)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数K1= 5.0 × 10-2、K2=2.6 ×10-3。
①电离常数K只与温度有关,当温度升高时,K值_____ (填“增大”或“减小”)。
②试从电离平衡移动的角度解释K1、K2数据的差异:____________ 。
(4)25℃时,已知HF的电离常数= 3.6×10-4(H3PO4的电离常数K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为________ 。
(1)次磷酸(H3PO2)是一种精细化工产品。向10 mL0.02 mol • L-1H3PO2溶液中加入20 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有
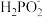 、OH-两种阴离子,则H3PO2是
、OH-两种阴离子,则H3PO2是(2)已知25℃时K(H3PO2) =1
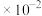 ,该H3PO2溶液的PH为
,该H3PO2溶液的PH为(3)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数K1= 5.0 × 10-2、K2=2.6 ×10-3。
①电离常数K只与温度有关,当温度升高时,K值
②试从电离平衡移动的角度解释K1、K2数据的差异:
(4)25℃时,已知HF的电离常数= 3.6×10-4(H3PO4的电离常数K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为
您最近一年使用:0次
2020-10-19更新
|
508次组卷
|
3卷引用:北京市中关村中学2021-2022学年高二上学期期中考试化学试题
4 . 常温下,有 0.1 mol/L 的四种溶液:①HCl ②CH3COOH ③NaOH ④Na2CO3
(1)用化学用语解释溶液①呈酸性的原因:_________ 。
(2)溶液③的 pH=_________ 。
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①_________ ②(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:_________ 。
(5)常温下,下列关于溶液②的判断正确的是_________ 。
a.c(CH3COO−) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO−) > c(OH −)
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
(1)用化学用语解释溶液①呈酸性的原因:
(2)溶液③的 pH=
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①
(4)溶液④加热后碱性增强,结合化学用语解释原因:
(5)常温下,下列关于溶液②的判断正确的是
a.c(CH3COO−) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO−) > c(OH −)
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
您最近一年使用:0次
5 . 常温下,有0.1mol·L−1的四种溶液:①CH3COOH②NH3·H2O③HCl④FeCl3
(1)用化学用语解释②呈碱性的原因:______ 。
(2)溶液③的pH=______ 。
(3)加热、蒸干、灼烧④后所得的产物是______ 。
(4)25℃时,向20mL①中不断滴入0.1mol·L−1的NaOH溶液,混合溶液pH变化如图所示:

①a点水电离出的c(H+)______ 10-7mol·L−1(填“大于”“小于”或“等于”)
②b点发生反应的离子方程式是______ 。
③c点溶液中存在的离子 的浓度大小关系是______ 。
(1)用化学用语解释②呈碱性的原因:
(2)溶液③的pH=
(3)加热、蒸干、灼烧④后所得的产物是
(4)25℃时,向20mL①中不断滴入0.1mol·L−1的NaOH溶液,混合溶液pH变化如图所示:

①a点水电离出的c(H+)
②b点发生反应的离子方程式是
③c点溶液中存在的
您最近一年使用:0次
名校
解题方法
6 . 25℃时,如图烧杯中各盛有20mL的溶液。
甲. 0.100mol/L盐酸 乙.
0.100mol/L盐酸 乙.  0.100mol/L氨水 丙.
0.100mol/L氨水 丙.  0.100mol/LNH4Cl
0.100mol/LNH4Cl
(1)甲溶液的pH=_____________ 。
(2)若将甲全部倒入乙中,所得溶液的pH_____________ 丙溶液的pH(填“>”、“=”或“<”)。
(3)若将一部分乙倒入丙中,所得的混合溶液呈中性,所得混合溶液中离子浓度大小关系是_____________ 。
甲.
 0.100mol/L盐酸 乙.
0.100mol/L盐酸 乙.  0.100mol/L氨水 丙.
0.100mol/L氨水 丙.  0.100mol/LNH4Cl
0.100mol/LNH4Cl(1)甲溶液的pH=
(2)若将甲全部倒入乙中,所得溶液的pH
(3)若将一部分乙倒入丙中,所得的混合溶液呈中性,所得混合溶液中离子浓度大小关系是
您最近一年使用:0次
7 . 常温下,有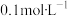 的四种溶液:①
的四种溶液:① ②
②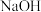 ③
③ ④
④
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:__________ .
(2)溶液②的
_____________ 。
(3)溶液②、③等体积混合后,溶液中
________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:______________ 。
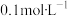 的四种溶液:①
的四种溶液:① ②
②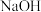 ③
③ ④
④
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:
(2)溶液②的

(3)溶液②、③等体积混合后,溶液中

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)溶液④加热后碱性增强,结合化学用语解释原因:
您最近一年使用:0次
2019-03-09更新
|
292次组卷
|
2卷引用:【区级联考】北京市西城区2018-2019学年高二上学期期末考试化学试题
8 . 25℃时,下图烧杯中各盛有40 mL的溶液。
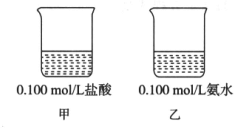
(1)甲溶液pH=___________ ,水电离的c(OH-)=___________ mol/L。
(2)若分别取20 mL甲溶液和乙溶液充分混合,所得的混合溶液丙的pH=6,水电离的c(H+)=___________ mol/L;溶液中离子浓度大小顺序是___________ 。
(3)若将剩余的乙溶液全部倒入上述混合溶液丙中,所得的混合溶液pH>7,该溶液中离子浓度大小顺序是___________ 。

(1)甲溶液pH=
(2)若分别取20 mL甲溶液和乙溶液充分混合,所得的混合溶液丙的pH=6,水电离的c(H+)=
(3)若将剩余的乙溶液全部倒入上述混合溶液丙中,所得的混合溶液pH>7,该溶液中离子浓度大小顺序是
您最近一年使用:0次



