25℃时,如图烧杯中各盛有20mL的溶液。
甲. 0.100mol/L盐酸 乙.
0.100mol/L盐酸 乙.  0.100mol/L氨水 丙.
0.100mol/L氨水 丙.  0.100mol/LNH4Cl
0.100mol/LNH4Cl
(1)甲溶液的pH=_____________ 。
(2)若将甲全部倒入乙中,所得溶液的pH_____________ 丙溶液的pH(填“>”、“=”或“<”)。
(3)若将一部分乙倒入丙中,所得的混合溶液呈中性,所得混合溶液中离子浓度大小关系是_____________ 。
甲.
 0.100mol/L盐酸 乙.
0.100mol/L盐酸 乙.  0.100mol/L氨水 丙.
0.100mol/L氨水 丙.  0.100mol/LNH4Cl
0.100mol/LNH4Cl(1)甲溶液的pH=
(2)若将甲全部倒入乙中,所得溶液的pH
(3)若将一部分乙倒入丙中,所得的混合溶液呈中性,所得混合溶液中离子浓度大小关系是
更新时间:2020-04-03 10:46:02
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中由水电离出的c(H+)=10-9mol·L-1,则该电解质可能是___________ (填序号)。
A.CuSO4 B.Na2CO3 C.HCl D.NaOH E.K2SO4
(2)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。
①c(OH-)=1.0×10-3mol·L-1的氨水bL;
②浓度为1.0×10-3mol·L-1的氨水cL;
③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液dL。
则a、b、c、d之间的关系是___________ 。
(3)已知室温时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
①该溶液的pH=___________ 。
②升高温度时,K将______ (填“增大”、“减小”或“不变”),pH将_______ (填“增大”、“减小”或“不变”)。
③由HA电离出的c(H+)约为水电离出的c(H+)的_________ 倍。
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中由水电离出的c(H+)=10-9mol·L-1,则该电解质可能是
A.CuSO4 B.Na2CO3 C.HCl D.NaOH E.K2SO4
(2)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。
①c(OH-)=1.0×10-3mol·L-1的氨水bL;
②浓度为1.0×10-3mol·L-1的氨水cL;
③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液dL。
则a、b、c、d之间的关系是
(3)已知室温时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
①该溶液的pH=
②升高温度时,K将
③由HA电离出的c(H+)约为水电离出的c(H+)的
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】研究表明,我国酸雨区域占国土面积的40%以上,我国农业每年因遭受酸雨而造成经济损失高达15亿多元,酸雨的防治迫在眉睫。
(1) 是形成酸雨的主要物质之一,模仿示例图“
是形成酸雨的主要物质之一,模仿示例图“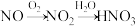 ”,画出由
”,画出由 形成硫酸型酸雨的可能的过程
形成硫酸型酸雨的可能的过程___________ 。
(2)某地降雨经检验,除 和
和 外,还含有
外,还含有 、
、 、
、 、
、 它们的浓度如下:
它们的浓度如下:
则该降雨的pH为___________ ,该降雨___________ (选填“是”或“不是”)酸雨。
(3)常温下,下列三种溶液:
①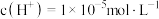 ②
②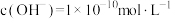 ③
③
按溶液酸性由强到弱的顺序排列为___________ 。
(4)为了减少酸雨产生的途径,你认为可采取的措施为___________。
(1)
 是形成酸雨的主要物质之一,模仿示例图“
是形成酸雨的主要物质之一,模仿示例图“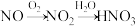 ”,画出由
”,画出由 形成硫酸型酸雨的可能的过程
形成硫酸型酸雨的可能的过程(2)某地降雨经检验,除
 和
和 外,还含有
外,还含有 、
、 、
、 、
、 它们的浓度如下:
它们的浓度如下:| 微粒 |  |  |  |  |  |  |
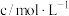 | ? |  |  |  | 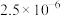 | 很小,可忽略 |
(3)常温下,下列三种溶液:
①
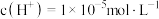 ②
②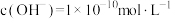 ③
③
按溶液酸性由强到弱的顺序排列为
(4)为了减少酸雨产生的途径,你认为可采取的措施为___________。
| A.把工厂烟囱造高 | B.在汽车排气管上安装汽车尾气催化转化器 |
| C.化石燃料脱硫 | D.在已酸化的土壤中加石灰 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
请回答下列问题:
(1)25℃时,0.10mol·L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)_______ ;
(2)常温下,将20mL0.10mol·L-1CH3COOH溶液和 20mL0.10mol·L-1HNO2溶液分别与 20mL 0.10mol·L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v (CH3COOH )_______ v (HNO2)(填“>”、“<”或“=”)。
②充分反应后。两溶液中c(CH3COO-)_______ c(NO2-)(填“>”、“<”或“=”)。
(3)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的PH=6,则混合
液中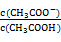 =
=_________ ;
(4)常温下,下列方法可以使0.1mol • L-1CH3COOH的电离程度增大的是_____________ 。
Ⅱ.常温时向一定体积pH= 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的ph=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积之比是____________________ 。
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
请回答下列问题:
(1)25℃时,0.10mol·L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)
(2)常温下,将20mL0.10mol·L-1CH3COOH溶液和 20mL0.10mol·L-1HNO2溶液分别与 20mL 0.10mol·L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v (CH3COOH )
②充分反应后。两溶液中c(CH3COO-)
(3)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的PH=6,则混合
液中
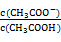 =
=(4)常温下,下列方法可以使0.1mol • L-1CH3COOH的电离程度增大的是
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释 d.加入少量冰醋酸
Ⅱ.常温时向一定体积pH= 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的ph=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积之比是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
(1)由上表判断NaHSO3溶液显_____ 性,试解释原因______ 。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______ 0.1mol•L-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______ 。
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m______ n(填“<”、“>”或“=”)
| n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显
(2)pH=8.2的吸收液中由水电离出的c(OH-)
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】25℃时,0.1mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L的醋酸溶液中加入少量下列物质中的___ (填写编号),然后测定溶液的pH(已知25℃时CH3COONH4溶液呈中性)。
A. 固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若___ (填“甲”或“乙”)的解释正确,溶液的pH应___ (填“增大”“减小”或“不变”)。
(3)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。其中有两种粒子的物质的量之和一定等于0.01mol,它们是__ 和___ (用离子式和分子式表示)。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L的醋酸溶液中加入少量下列物质中的
A. 固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若
(3)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。其中有两种粒子的物质的量之和一定等于0.01mol,它们是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】FeCl3可通过反应 3FeCl2+HNO3+3HCl→3FeC13+NO↑+2H2O 制得。
完成下列填空:
(1)上述反应式中由三原子组成的极性分子,其电子式为____________ 。
(2)限于上述反应式,原子最外层有3个未成对电子的主族元素是__________ (填写名称);与它同周期、非金属性比它强的元素有_________ (填写元素符号),非金属性较强的理由是___________________________________ (请运用原子结构的知识解释)。
(3)上述反应中若有0.12mol电子发生转移,则可生成NO气体__________ L(标准状况)。
(4)FeCl3浓溶液可用于蚀刻金属铜制作电路板。写出该反应的化学反应方程式。_____________________ ,实验室里,某同学将FeCl3(s)置于烧杯中,加水溶解配制溶液,为了加速固体溶解,边搅拌边加热,发现烧杯中出现浑浊。请用平衡移动原理解释出现浑浊的原因。_______________________________
完成下列填空:
(1)上述反应式中由三原子组成的极性分子,其电子式为
(2)限于上述反应式,原子最外层有3个未成对电子的主族元素是
(3)上述反应中若有0.12mol电子发生转移,则可生成NO气体
(4)FeCl3浓溶液可用于蚀刻金属铜制作电路板。写出该反应的化学反应方程式。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】在室温下,下列五种溶液,请根据要求填写下列空白:
①0.1mol•L-1NH4Cl溶液;②0.1mol•L-1CH3COONH4溶液;③0.1mol•L-1NH4HSO4溶液;④0.1mol•L-1NH3·H2O和0.1mol•L-1NH4Cl混合液;⑤0.1mol•L-1氨水
(1)溶液①呈___ (填“酸”、“碱”或“中”)性,其原因是___ (用离子方程式表示)。
(2)溶液①至⑤中,c(NH )从大到小的顺序是
)从大到小的顺序是___ 。
(3)在溶液④中___ (填离子符号)的浓度为0.1mol/L;NH3·H2O和___ (填离子符号)的浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度___ (填“>”、“<”或“=”,下同)NH 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-)___ c(NH )。
)。
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:___ 。
②若溶液M由10mL2mol•L-1NaHA溶液与10mL2mol•L-1NaOH溶液混合而得,则溶液M的pH___ (填“>”、“<”或“=”)7。
①0.1mol•L-1NH4Cl溶液;②0.1mol•L-1CH3COONH4溶液;③0.1mol•L-1NH4HSO4溶液;④0.1mol•L-1NH3·H2O和0.1mol•L-1NH4Cl混合液;⑤0.1mol•L-1氨水
(1)溶液①呈
(2)溶液①至⑤中,c(NH
 )从大到小的顺序是
)从大到小的顺序是(3)在溶液④中
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度
 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-) )。
)。(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:
②若溶液M由10mL2mol•L-1NaHA溶液与10mL2mol•L-1NaOH溶液混合而得,则溶液M的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】常温下,某水溶液X中存在的离子有Na+、A2-、HA-、H+、OH-,只存在一种分子。根据题意回答下列问题:
(1)常温下,若X为20 mL1 mol·L-1Na2A溶液,则溶液X的pH_______ (填“>”“=”或“<”)7,溶液中离子浓度由大到小的顺序为_______ ;向该溶液中加入10 mL1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为_______ mol·L-1[已知Ksp(BaA)=1.8×10-10]。
(2)若有三种溶液:①0.01 mol·L-1 H2A溶液、②0.01 mol·L-1 NaHA溶液、③0.02 mol·L-1盐酸与0.04 mol·L-1 Na2A溶液等体积混合,则三种溶液中c(A2-)最大的是_______ (填序号,下同);pH由小到大的顺序为_______ 。
(1)常温下,若X为20 mL1 mol·L-1Na2A溶液,则溶液X的pH
(2)若有三种溶液:①0.01 mol·L-1 H2A溶液、②0.01 mol·L-1 NaHA溶液、③0.02 mol·L-1盐酸与0.04 mol·L-1 Na2A溶液等体积混合,则三种溶液中c(A2-)最大的是
您最近一年使用:0次

 、
、 随pH的分布如图所示:
随pH的分布如图所示: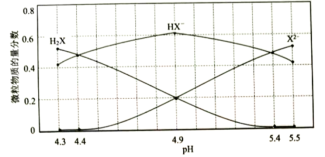
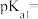
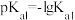 )
)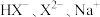 物质的量浓度大小关系可表示为
物质的量浓度大小关系可表示为

