名校
解题方法
1 . 用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是
| A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定 |
| C.用蒸馏水洗净锥形瓶后,加入10.00mLNaOH溶液,再加入适量蒸馏水进行滴定 |
| D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸 |
您最近一年使用:0次
2024-01-03更新
|
130次组卷
|
52卷引用:云南省玉溪市景东一中2018-2019学年高二6月份考试化学试题
云南省玉溪市景东一中2018-2019学年高二6月份考试化学试题(已下线)2011-2012学年云南省昆明三中高二下学期期末考试化学试卷(已下线)2014~2015学年黑龙江省哈六中高二上学期期中化学试卷2015-2016学年甘肃省永昌一中高二上学期期末化学试卷2015-2016学年黑龙江大庆一中高二下假期验收化学试卷2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷2015-2016学年新疆农业大学附中高二下学期期中化学试卷2016-2017学年西藏拉萨北京实验中学高二上期末化学卷河北省深州中学2016-2017学年高二下学期期末考试化学试题黑龙江省大庆中学2017-2018学年高二上学期期末考试化学试题山东省滨州市2017-2018学年高二年级上学期期末考试化学试题北京师范大学附属中学2017-2018学年高二上学期期末考试化学试题山东省菏泽市第一中学老校区2018-2019学年高二上学期期末模拟化学试题福建省晋江市季延中学2018-2019学年高二上学期期末考试化学试题【校级联考】河南省商丘市九校2018-2019学年高二上学期期末联考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(普通班)上学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(实验班)上学期期末考试化学试题【全国百强校】贵州省遵义航天高级中学2018-2019学年高二下学期第一次(3月)月考化学试题(已下线)2019年10月12日 《每日一题》选修4-周末培优河北省鸡泽县第一中学2019-2020学年高二10月月考化学试题吉林省汪清县第六中学2019-2020学年高二上学期期中考试化学试题湖南省长沙市长郡中学2019-2020学年高二上学期期中考试化学试题甘肃省白银市会宁县第四中学2019-2020学年高二上学期期末期末考试化学试题湖南省张家界市2019-2020学年高二上学期期末考试化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期末考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题湖南省衡阳市欧阳遇实验中学2018-2019学年高二下学期期末考试化学试题北京市中央民族大学附属中学2019-2020学年高二下学期期末考试化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期9月月考化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评安徽涡阳县育萃中学2020-2021学年高二上学期第二次月考化学试题(已下线)3.2.2 酸碱中和滴定(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)河南省焦作市博爱县英才学校2020-2021学年高二上学期11月月考化学试题内蒙古包头市第一中学2020-2021学年高二上学期期中考试化学试题河南省名校联盟2020-2021学年高二下学期开学考试化学试题青海省西宁市普通高中五校2020-2021学年高二上学期期末联考化学试题(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)云南省玉溪市峨山一中2021—2022学年高二下学期3月月考化学试题(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题山东省滨州市沾化区实验高级中学2022-2023学年高三上学期开学考试化学试题江苏省徐州市沛县树恩高级中学2021-2022学年高二下学期期中测试化学试题河南新密市实验高级中学2022-2023学年高二上学期第七次段考化学试题 中国人民大学附属中学2022-2023学年高二上学期限时练习 2(12月考题)化学试题第3课时 酸碱中和滴定西省西安市铁一中学2023-2024学年高二上学期期中质量检测化学试题广东省湛江市第二十一中学2023-2024学年高二上学期期中考试化学试题湖北省恩施土家族苗族自治州高级中学2023-2024学年高二上学期期中考试化学试题天津市耀华中学2023-2024学年高二上学期11月期中化学试题山东省淄博市沂源县第一中学2023-2024学年高二上学期期中考试化学试题河北省石家庄市辛集市2023-2024学年高二上学期2月期末考试化学试题
名校
解题方法
2 . 用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
| A.盛装标准液的滴定管未用标准液润洗 |
| B.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定前无气泡,滴定到终点时,发现尖嘴处有气泡 |
您最近一年使用:0次
名校
解题方法
3 . 草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。某草酸亚铁样品(不含结晶水)中含有少量草酸,现用滴定法测定该样品中FeC2O4的含量。实验方案如下:
①将准确称量的0.20 g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃ 左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。
试回答下列问题:
(1)高锰酸钾标准液用___________ 滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为_________ 。
(3)在步骤②中,下列操作会引起测定结果偏高的是___________ 。
A、滴定管在盛装高锰酸钾前未润洗 B、滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
C、滴定前读数正确,滴定终点时俯视读数 D、滴定前读数正确,滴定终点时仰视读数
(4)0.20 g样品中FeC2O4的质量分数为___________ 。(不考虑步骤②中的损耗)
①将准确称量的0.20 g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃ 左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。
试回答下列问题:
(1)高锰酸钾标准液用
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为
(3)在步骤②中,下列操作会引起测定结果偏高的是
A、滴定管在盛装高锰酸钾前未润洗 B、滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
C、滴定前读数正确,滴定终点时俯视读数 D、滴定前读数正确,滴定终点时仰视读数
(4)0.20 g样品中FeC2O4的质量分数为
您最近一年使用:0次
2021-04-22更新
|
92次组卷
|
2卷引用:云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
4 . 某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有______ 、______ 量筒、烧杯、玻璃棒。
(2)盛装0.2000 mol/L盐酸标准液应该用______ 式滴定管。(填“酸”或“碱”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_________ ,直到加入一滴盐酸后,溶液由_________ ,即到终点。
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:_________ 。
(5)有关数据记录如下:
则NaOH溶液的物质的量浓度为__________ mol/L。
(6)若滴定时锥形瓶未干燥,则测定结果____________ ;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值_________ 。(填“无影响”、“偏高”或“偏低”)。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有
(2)盛装0.2000 mol/L盐酸标准液应该用
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:
(5)有关数据记录如下:
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.60 | 20.70 |
| 2 | 20.00 | 6.00 | 25.90 |
| 3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为
(6)若滴定时锥形瓶未干燥,则测定结果
您最近一年使用:0次
2020-06-06更新
|
108次组卷
|
2卷引用:云南省普洱市2017-2018学年高二下学期期末考试理科综合化学试题
名校
解题方法
5 . Ⅰ.下列有关实验操作中,合理的是_________ (选填字母)。
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36ml盐酸
C.用酸式滴定管量取21.20ml0.10mol·L-1H2SO4溶液
D.用200ml容量瓶配制100ml0.1mol·L-1NaCl溶液
Ⅱ.现用物质的量浓度为amol·L-1的标准盐酸去测定VmLNaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_________ 。
(2)如图是酸式滴定管中液面在滴定前后的读数:
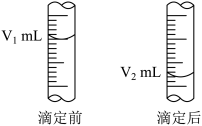
c(NaOH)=_________ mol/L。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度_________ 。(选填“偏大”、“偏小”、“无影响”)
III.t℃时,某稀硫酸溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知:a+b=12。
(4)该温度下水的离子积常数KW的数值为_________ 。
(5)该温度下(t℃),将100mL0.1mol·L-1的稀H2SO4与100mL0.4mol·L-1的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=_________ 。
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36ml盐酸
C.用酸式滴定管量取21.20ml0.10mol·L-1H2SO4溶液
D.用200ml容量瓶配制100ml0.1mol·L-1NaCl溶液
Ⅱ.现用物质的量浓度为amol·L-1的标准盐酸去测定VmLNaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是
(2)如图是酸式滴定管中液面在滴定前后的读数:

c(NaOH)=
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度
III.t℃时,某稀硫酸溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知:a+b=12。
(4)该温度下水的离子积常数KW的数值为
(5)该温度下(t℃),将100mL0.1mol·L-1的稀H2SO4与100mL0.4mol·L-1的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=
您最近一年使用:0次
名校
6 . 化学学习小组进行实验测定H2C2O4·xH2O 中x值。已知:M(H2C2O4)=90 g·mol-1
①称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适量稀H2SO4;
③用浓度为 0.05 000 mol·L-1的 KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式__________ 。
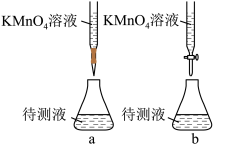
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是__________ (选填 a、b)。
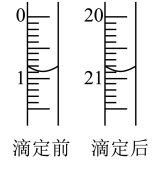
(3)由图可知消耗KMnO4溶液体积为_______ mL。
(4)滴定过程中眼睛应注视________ 。
(5)通过上述数据,求得x=______ 。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果______ (偏大、偏小或没有影响) 。
①称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适量稀H2SO4;
③用浓度为 0.05 000 mol·L-1的 KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是

(3)由图可知消耗KMnO4溶液体积为

(4)滴定过程中眼睛应注视
(5)通过上述数据,求得x=
您最近一年使用:0次
2020-02-05更新
|
92次组卷
|
2卷引用:云南省普洱市普洱第二中学2019—2020学年高二上学期期末考试化学试题
名校
7 . 草酸又名乙二酸,广泛存在于植物源食品中,它的用途非常广泛。测定某草酸晶体(组成为H2C2O4·nH2O)中H2C2O4的质量分数,进行下列实验:①取 w g 草酸晶体配成 250mL 溶液;②取 25.00mL 所配草酸溶液置于锥形瓶中, 加入适量稀H2SO4 后,在锥形瓶底部垫一张白纸,用浓度为 0.100mol·L-1KMnO4 溶液滴定。滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
请回答下列问题:
(1)上述反应的还原剂是_____ (填化学式)。
(2)步骤①中为配制准确浓度的草酸溶液,所需用到的仪器有:天平(含砝码)、烧杯、药匙、250ml 容量瓶和___________ 、_______________ 。
(3)在锥形瓶底部垫一张白纸的作用是_____ 。
(4)滴定管应选用_______ 式滴定管(填“酸”或“碱”),判断滴定结束的标准是_________ 。
(5)三次滴定所用 KMnO 溶液体积平均为 20.00mL,则实验测得所配草酸溶液的物质的量浓度为______________ mol·L-1;草酸晶体中 H2C2O4 的质量分数为_______________ ;在实验过程中,锥形瓶用蒸馏水洗净之后,再用草酸溶液润洗,对测定结果造成的影响是_______ (填“偏大”、“偏小”或“无影响)
请回答下列问题:
(1)上述反应的还原剂是
(2)步骤①中为配制准确浓度的草酸溶液,所需用到的仪器有:天平(含砝码)、烧杯、药匙、250ml 容量瓶和
(3)在锥形瓶底部垫一张白纸的作用是
(4)滴定管应选用
(5)三次滴定所用 KMnO 溶液体积平均为 20.00mL,则实验测得所配草酸溶液的物质的量浓度为
您最近一年使用:0次
2019-12-11更新
|
90次组卷
|
2卷引用:云南省普洱市西盟佤族自治县第一中学2021-2022学年高二上学期12月月考化学试题
名校
8 . 下列有关实验操作的叙述正确的是
| A.中和滴定实验中指示剂不宜加入过多,通常控制量在1 mL ~2mL |
| B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液 |
| C.用量筒量取5.00mL1.00mol·L-1盐酸 |
| D.中和滴定实验中的锥形瓶用待测液润洗 |
您最近一年使用:0次
2019-09-04更新
|
651次组卷
|
6卷引用:云南省普洱市西盟佤族自治县第一中学2021-2022学年高二上学期12月月考化学试题
名校
9 . 某兴趣小组对NaOH溶液和稀盐酸混合后的有关问题进行了如下探究:查阅资料:下表是实验室里盐酸、NaOH试剂瓶标签上的部分说明:
实验探究:
(1)配制溶液:甲同学配制100 mL 1.5 mol·L-1NaOH溶液,乙同学取20 mL 36.5%的盐酸稀释到200 mL。甲为了证明NaOH溶液与稀盐酸能发生化学反应,设计并完成了如下图所示的实验。
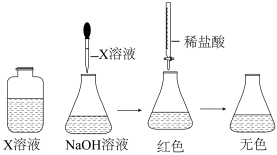
X溶液滴入的量一般为______ ,使用酸式滴定管前要检查活塞是否漏水的操作方法是________ 。
(2)乙设计完成了另一个实验,以证明NaOH溶液与盐酸能够发生反应。他在盛有20 mL稀盐酸的锥形瓶里,用碱式滴定管滴入NaOH溶液,不断振荡溶液,同时用pH计测定溶液的pH,直到NaOH溶液过量。则在滴定过程中,滴定终点附近的操作是_______ 。
(3)你认为甲、乙两位同学的实验中,______ (填“甲”、“乙”或“甲和乙”)的实验能充分证明NaOH与盐酸发生了反应。
(4)丙同学为了测定上述36.5%盐酸的物质的量浓度,进行了如下实验:在锥形瓶中加入已稀释的盐酸,用碱式滴定管滴入甲配制的NaOH溶液,测定的结果如下表:
据此通过计算可知实验测定的盐酸浓度与标签说明的浓度相比_____ (填“偏高”、“偏低”或“相等”)。
| 化学式 | 相对分子质量 | ||
| 盐酸 | HCl | 36.5 | 密度: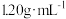 , ,质量分数:36.5%, 无色易挥发 |
| 氢氧化钠 | NaOH | 40 | 俗名:烧碱、火碱、苛 性钠,易潮解的固体 |
(1)配制溶液:甲同学配制100 mL 1.5 mol·L-1NaOH溶液,乙同学取20 mL 36.5%的盐酸稀释到200 mL。甲为了证明NaOH溶液与稀盐酸能发生化学反应,设计并完成了如下图所示的实验。

X溶液滴入的量一般为
(2)乙设计完成了另一个实验,以证明NaOH溶液与盐酸能够发生反应。他在盛有20 mL稀盐酸的锥形瓶里,用碱式滴定管滴入NaOH溶液,不断振荡溶液,同时用pH计测定溶液的pH,直到NaOH溶液过量。则在滴定过程中,滴定终点附近的操作是
(3)你认为甲、乙两位同学的实验中,
(4)丙同学为了测定上述36.5%盐酸的物质的量浓度,进行了如下实验:在锥形瓶中加入已稀释的盐酸,用碱式滴定管滴入甲配制的NaOH溶液,测定的结果如下表:
| 测定次数 | 盐酸的体积/mL | 氢氧化钠溶液的体积 | |
| 测定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
您最近一年使用:0次
2019-07-01更新
|
102次组卷
|
2卷引用:云南省玉溪市景东一中2018-2019学年高二6月份考试化学试题
名校
10 . 某同学用邻苯二甲酸氢钾溶液来滴定NaOH溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是________ ,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是________ ,选用指示剂是________ 。
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是__________ 。
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作__________ ;滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________ (填“偏大”、“偏小”或“无影响”)。
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
| 滴定次数实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作
您最近一年使用:0次
2019-03-21更新
|
90次组卷
|
2卷引用:云南省景东一中2018-2019学年高二下学期开学考试化学试题



