名校
解题方法
1 . 在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响。草酸的学名叫乙二酸,是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料。常温下0.01mL的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示:
(1)草酸(H2C2O4)是一种二元弱酸。写出它在水中的电离方程式:_____ 。
(2)将0.1mol/L草酸溶液中[H2C2O4]、[HC2O ]、[C2O
]、[C2O ]按照由大到小的顺序排列:
]按照由大到小的顺序排列:_____ 。
(3)在H2C2O4溶液稀释过程中,下列物理量始终增大的是_____ 。
(4)KHC2O4溶液中c(H2C2O4)_____ c(C2O )(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O
)(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O 电离出来的c(H+)
电离出来的c(H+)_____ amol/L
(5)写出草酸钾(K2C2O4)溶液中的电荷守恒关系式_____ ,及物料守恒关系式_____ 。
| 物质 | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.1 | 3.1 | 8.1 |
(2)将0.1mol/L草酸溶液中[H2C2O4]、[HC2O
 ]、[C2O
]、[C2O ]按照由大到小的顺序排列:
]按照由大到小的顺序排列:(3)在H2C2O4溶液稀释过程中,下列物理量始终增大的是
A. | B.c(H+)•c(C2O ) ) |
C.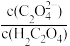 | D.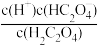 |
 )(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O
)(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O 电离出来的c(H+)
电离出来的c(H+)(5)写出草酸钾(K2C2O4)溶液中的电荷守恒关系式
您最近一年使用:0次
2 . 导电性实验可以作为研究电解质电离本质及反应机理的有效方法。
(1)在如下图所示的装置里,若灯泡亮,广口瓶内的物质A 可以是_______ (填序号)。

①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥ 氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)写出一水合氨的电离方程式_______ 。
(3)在电解质溶液的导电性装置(如下图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是_______ (填字母),并写出发生反应的离子方程式_______ 。
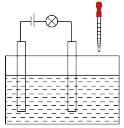
A.盐酸中逐滴加入食盐溶液 B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸 D.硫酸中逐滴加入氢氧化钡溶液
(4)已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且 Ca(HCO3)2易溶于水。若在(3)题图中,电解质溶液为 Ca(OH)2溶液,向溶液中逐渐通入 CO2。则:下列四个图中,_______(填字母)能比较准确地反映出溶液的导电能力和通入CO2 气体量的关系(x 轴表示 CO2通入的量,y 轴表示导电能力)。
(1)在如下图所示的装置里,若灯泡亮,广口瓶内的物质A 可以是

①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥ 氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)写出一水合氨的电离方程式
(3)在电解质溶液的导电性装置(如下图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是

A.盐酸中逐滴加入食盐溶液 B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸 D.硫酸中逐滴加入氢氧化钡溶液
(4)已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且 Ca(HCO3)2易溶于水。若在(3)题图中,电解质溶液为 Ca(OH)2溶液,向溶液中逐渐通入 CO2。则:下列四个图中,_______(填字母)能比较准确地反映出溶液的导电能力和通入CO2 气体量的关系(x 轴表示 CO2通入的量,y 轴表示导电能力)。
A. | B.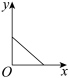 | C.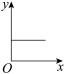 | D.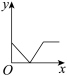 |
您最近一年使用:0次
解题方法
3 . 中国政府承诺:力争 的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。
的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。 的捕集与利用成为当前研究的热点。
的捕集与利用成为当前研究的热点。
Ⅰ.“氨法”捕集二氧化碳是实现“碳中和”的重要途径之一
反应的化学方程式为: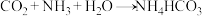 。
。
完成下列填空:
(1)写出氮原子的核外电子排布式_______ ,写出 分子的电子式
分子的电子式_______ 。
(2)用方程式表示二氧化碳溶于水溶液呈现酸性的原因_______ 。
(3)组成 的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是
的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是_______ (写出一种,下同);由其中任意三种元素组成的离子化合物可以是_______ 。
(4)上述氨法吸收废气中 时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。
时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。_______
Ⅱ.我国化学家研究在铜基催化剂作用下将 高效转化为甲酸,合成铜基催化剂时有一步反应为:
高效转化为甲酸,合成铜基催化剂时有一步反应为: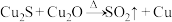 (未配平)。
(未配平)。
(5)配平上述化学方程式_______ 。若反应中转移 电子,则生成气体在标准状态下的体积为
电子,则生成气体在标准状态下的体积为_______ L。
 的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。
的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。 的捕集与利用成为当前研究的热点。
的捕集与利用成为当前研究的热点。Ⅰ.“氨法”捕集二氧化碳是实现“碳中和”的重要途径之一
反应的化学方程式为:
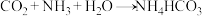 。
。完成下列填空:
(1)写出氮原子的核外电子排布式
 分子的电子式
分子的电子式(2)用方程式表示二氧化碳溶于水溶液呈现酸性的原因
(3)组成
 的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是
的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是(4)上述氨法吸收废气中
 时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。
时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。Ⅱ.我国化学家研究在铜基催化剂作用下将
 高效转化为甲酸,合成铜基催化剂时有一步反应为:
高效转化为甲酸,合成铜基催化剂时有一步反应为: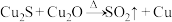 (未配平)。
(未配平)。(5)配平上述化学方程式
 电子,则生成气体在标准状态下的体积为
电子,则生成气体在标准状态下的体积为
您最近一年使用:0次
解题方法
4 . Li-SOCl2电池采用LiAlCl4的SOCl2溶液为电解质溶液,是目前比能量最高的化学电源,具有电压高.储存寿命长.工作温度范围宽.成本低等优点。
(1)该电池的工作原理为:4Li+2SOCl2=4LiCl↓+SO2↑+S↓,该反应的还原产物为__________ ,若生成标准状况下气体11.2L,则转移电子的数目为_____________ ;
(2)SOCl2可用于AlCl3·6H2O制备无水AlCl3,请结合离子方程式解释不采用直接加热晶体的方法除去结晶水的原因_____________________________________________________________ ;
(3)解释Li-SOCl2电池组装必须在无水条件下的原因_______________________________ ;
(4)工业制硫酸中,SO2的催化氧化采用常压而不是高压的原因______________________ ;
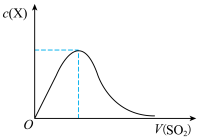
(5)向NaOH溶液中缓慢通入SO2至过量,反应过程中某微粒X的物质的量浓度随着通入SO2体积的变化如图所示,该微粒X为_____________ ,SO2过量时溶液仍然存在微粒X的原因____________________________ 。
(1)该电池的工作原理为:4Li+2SOCl2=4LiCl↓+SO2↑+S↓,该反应的还原产物为
(2)SOCl2可用于AlCl3·6H2O制备无水AlCl3,请结合离子方程式解释不采用直接加热晶体的方法除去结晶水的原因
(3)解释Li-SOCl2电池组装必须在无水条件下的原因
(4)工业制硫酸中,SO2的催化氧化采用常压而不是高压的原因
(5)向NaOH溶液中缓慢通入SO2至过量,反应过程中某微粒X的物质的量浓度随着通入SO2体积的变化如图所示,该微粒X为

您最近一年使用:0次
5 . 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验研究”的探究活动。
(1)本课题的研究对象是CH3COOH,研究目的是_____ ,研究方法是实验研究。
(2)该同学设计了如下方案:
A.先配制一定量的0.10mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质。
B.先配制0.01mol/L和0.10mol/L的CH3COOH,分别测他们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质。
C.先测0.10mol/LCH3COOH的pH,然后将其加热至100℃(不考虑醋酸挥发),再测pH,如果pH变小,则可证明醋酸是弱电解质。
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质。
你认为上述方案可行的是____ (多项选择)
(3)请回答以下两个问题:
①弱电解质的特点是____ (多项选择)
A.在水溶液中全部电离 B.在水溶液中部分电离
C.水溶液呈酸性 D.水溶液中存在电离平衡
②写出醋酸的电离方程式:____ 。
(1)本课题的研究对象是CH3COOH,研究目的是
(2)该同学设计了如下方案:
A.先配制一定量的0.10mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质。
B.先配制0.01mol/L和0.10mol/L的CH3COOH,分别测他们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质。
C.先测0.10mol/LCH3COOH的pH,然后将其加热至100℃(不考虑醋酸挥发),再测pH,如果pH变小,则可证明醋酸是弱电解质。
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质。
你认为上述方案可行的是
(3)请回答以下两个问题:
①弱电解质的特点是
A.在水溶液中全部电离 B.在水溶液中部分电离
C.水溶液呈酸性 D.水溶液中存在电离平衡
②写出醋酸的电离方程式:
您最近一年使用:0次



