名校
1 . (1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题

①NaHB溶液呈_______ (填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______ 2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______ 。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______ (填“猜想1”或“猜想2”)。

①NaHB溶液呈
②A、D、E三点溶液的pH由大到小为:
③F点溶液c(NH4+)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/LFeCl3溶液 | |
| Ⅱ | 4mL2mol/LNH4Cl溶液 |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是
您最近一年使用:0次
2020-03-12更新
|
180次组卷
|
2卷引用:海南省海口市海南中学2020届高三下学期第七次月考化学试题
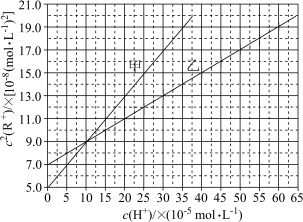
2 . HA和HB均为一元弱酸,在难溶盐RA和RB的饱和溶液中,测得25℃时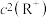 随
随 的变化关系如图所示。已知:
的变化关系如图所示。已知: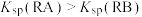 ,
, 不发生水解。下列说法错误的是
不发生水解。下列说法错误的是
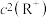 随
随 的变化关系如图所示。已知:
的变化关系如图所示。已知: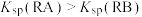 ,
,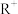 不发生水解。下列说法错误的是
不发生水解。下列说法错误的是
A.实线甲表示RB的饱和溶液中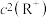 随 随 的变化 的变化 |
B.当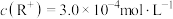 时,溶液的 时,溶液的 |
C. |
D.溶液的 时,RA和RB的饱和溶液中 时,RA和RB的饱和溶液中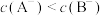 |
您最近一年使用:0次
名校
3 . 碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
 [已知
[已知 ,
, ,
, 的电离常数
的电离常数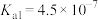 ,
, ,下列有关说法
,下列有关说法错误 的是

 [已知
[已知 ,
, ,
, 的电离常数
的电离常数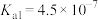 ,
, ,下列有关说法
,下列有关说法A.上层清液中存在 |
B.上层清液中含碳微粒最主要以 形式存在 形式存在 |
C.向体系中通入 气体,溶液中 气体,溶液中 增大 增大 |
D.通过加 溶液可实现 溶液可实现 向 向 的有效转化 的有效转化 |
您最近一年使用:0次
4 . 25℃时,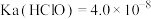 ,下列说法不正确的是
,下列说法不正确的是
A.相同温度下,等pH的 和 和 溶液中的 溶液中的 相同 相同 |
B.25℃时,  溶液中加入少量 溶液中加入少量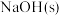 (恢复到原温度),水的电离程度减小 (恢复到原温度),水的电离程度减小 |
C.将浓度均为 的 的 和 和 溶液加热,两种溶液的pH均变大 溶液加热,两种溶液的pH均变大 |
D.25℃时 的 的 和 和 的混合溶液中, 的混合溶液中,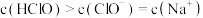 |
您最近一年使用:0次
名校
5 . 常温下,向 溶液(此时为a点)中不断加入
溶液(此时为a点)中不断加入 固体,溶液中由水电离出来的
固体,溶液中由水电离出来的 的负对数
的负对数 与
与 的变化关系如图所示。下列说法
的变化关系如图所示。下列说法错误 的是

 溶液(此时为a点)中不断加入
溶液(此时为a点)中不断加入 固体,溶液中由水电离出来的
固体,溶液中由水电离出来的 的负对数
的负对数 与
与 的变化关系如图所示。下列说法
的变化关系如图所示。下列说法
A. 的电离常数 的电离常数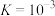 |
B.b点对应溶液中: |
C.c点对应溶液中: |
D.水的电离程度: |
您最近一年使用:0次
解题方法
6 . 25℃时,不同pH环境下H2C2O4不同形态的粒子的分布系数(δ)如图1.用0.200mol·L-1H2C2O4溶液滴定20.00mL0.400mol·L-1NaOH溶液所得滴定曲线如图2.下列说法不正确的是
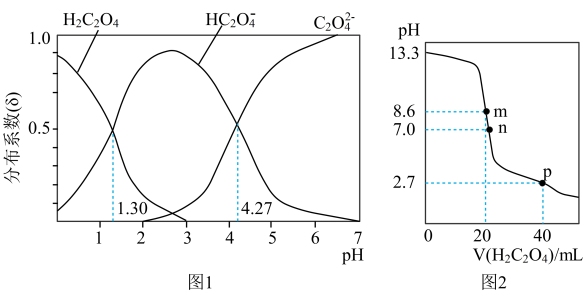

| A.H2C2O4的Ka1=1×10-1.30 |
B.点n所示溶液中:c( )+2c( )+2c( )=c(Na+) )=c(Na+) |
| C.点m到p的溶液中:水的电离程度逐渐减小 |
D.点p所示溶液中:c(Na+)>c( )>c(H2C2O4)>c( )>c(H2C2O4)>c( ) ) |
您最近一年使用:0次
2021-05-13更新
|
641次组卷
|
7卷引用:2020年海南卷化学高考真题变式题9-14
(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14福建省泉州市2021届5月高中毕业班质量检测(五)化学试题(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(练)
7 . 常温下,不同浓度的NaA溶液中c2(OH-)与c(A-)的关系如图1所示。向20 mL0.1 mol/L HA溶液中滴加等浓度的NaOH溶液,测得溶液pH与所加NaOH溶液体积关系如图2所示,下列说法错误的是
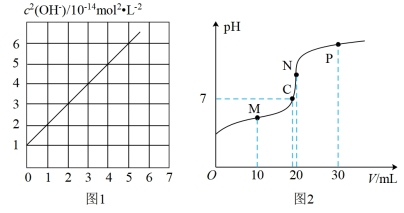

| A.Ka(HA)=1×10-5 |
| B.M点对应的溶液中:c(A-)>c(HA) |
| C.P点对应的溶液中:c(OH-)<c(A-)<2c(OH-) |
| D.N到P点间必存在一点,其对应的溶液中水的电离程度不受影响 |
您最近一年使用:0次
解题方法
8 . 25℃时,Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5。室温时,下列关于指定溶液的说法正确的是
| A.0.1mol·L-1CH3COOH溶液:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
B.0.1mol·L-1CH3COONH4溶液:c( )=c(CH3COO-)>c(H+)=c(OH-) )=c(CH3COO-)>c(H+)=c(OH-) |
C.将0.1mol·L-1CH3COOH溶液和0.1mol·L-1NH3·H2O溶液按一定体积比混合,混合溶液中:c( )+c(H+)=c(CH3COO-)+c(OH-) )+c(H+)=c(CH3COO-)+c(OH-) |
D.0.1mol·L-1CH3COOH溶液与0.1mol·L-1CH3COONH4溶液等体积混合的溶液:c( )+c(NH3·H2O)=2c(CH3COO-)+2c(CH3COOH) )+c(NH3·H2O)=2c(CH3COO-)+2c(CH3COOH) |
您最近一年使用:0次
2020-11-18更新
|
192次组卷
|
2卷引用:海南省万宁市全市2022-2023学年高三下学期2月统考B卷化学试题
名校
解题方法
9 . 已知25℃时有关弱酸的电离平衡常数如表:
下列说法不正确的是
| 弱酸 | CH3COOH | HCN | H2SO3 | H2CO3 |
| 电离平衡常数 | 1.75×10-5 | 4.9×10-10 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.3×10-7 K2=5.6×10-11 |
A.NaHCO3溶液中通少量SO2:2 +SO2=2CO2+ +SO2=2CO2+ +H2O +H2O |
| B.等体积等浓度的CH3COONa和NaCN溶液中的离子总数大小:前者>后者 |
| C.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) |
| D.amol/LHCN溶液与bmol/LNaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b |
您最近一年使用:0次
2021-01-15更新
|
786次组卷
|
6卷引用:海南省海南中学2023- 2024学年高三上学期第4次月考化学试题
名校
10 . Na2CO3溶液中存在水解平衡:CO32-+H2O  HCO3-+OH-。下列说法错误的是
HCO3-+OH-。下列说法错误的是
 HCO3-+OH-。下列说法错误的是
HCO3-+OH-。下列说法错误的是| A.加水稀释,溶液中所有离子的浓度都减小 |
| B.通入CO2,溶液pH增大 |
| C.加入NaOH固体,c(HCO3-)/c(CO32-)减小 |
| D.升高温度,平衡常数增大 |
您最近一年使用:0次



