名校
1 . (1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题

①NaHB溶液呈_______ (填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______ 2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______ 。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______ (填“猜想1”或“猜想2”)。

①NaHB溶液呈
②A、D、E三点溶液的pH由大到小为:
③F点溶液c(NH4+)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/LFeCl3溶液 | |
| Ⅱ | 4mL2mol/LNH4Cl溶液 |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是
您最近一年使用:0次
2020-03-12更新
|
180次组卷
|
2卷引用:海南省海口市海南中学2020届高三下学期第七次月考化学试题
名校
2 . 水溶液中的离子反应和平衡状态与生活、生产及环境保护等息息相关。请回答下列问题:
(1)25℃时,
___________ ;
(2)已知25℃时,HCN的 ,则NaCN溶液显
,则NaCN溶液显___________ (填“酸性”、“中性”或“碱性”),结合离子反应方程式 分析其原因是___________ 。
(3)25℃时,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为___________ 。
(4)已知25℃时, 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
___________ ,溶液中各离子物质的量浓度由大到小的顺序为___________ 。
(5)25℃时, 的①
的① ②
② ③NaCN④
③NaCN④ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是___________ (填序号)。
(6)某同学用 的NaOH溶液分别滴定
的NaOH溶液分别滴定 的HCl溶液和
的HCl溶液和 的
的 溶液,得到如图所示的两条滴定曲线,请回答有关问题:
溶液,得到如图所示的两条滴定曲线,请回答有关问题:

①NaOH溶液滴定 溶液的曲线是
溶液的曲线是___________ (填“图1”或“图2”)曲线。
②图1和图2中的a=___________ 。
(7)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各含氯元素微粒的组成分数 [
[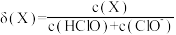 ,X为HClO或
,X为HClO或 ]与pH的关系如图所示。HClO的电离常数
]与pH的关系如图所示。HClO的电离常数 值为
值为___________ 。

(1)25℃时,

(2)已知25℃时,HCN的
 ,则NaCN溶液显
,则NaCN溶液显(3)25℃时,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(4)已知25℃时,
 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
(5)25℃时,
 的①
的① ②
② ③NaCN④
③NaCN④ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是| 电解质 |  |  | HCN |  |
| 电离常数 | 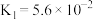  |  | 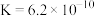 |  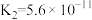 |
(6)某同学用
 的NaOH溶液分别滴定
的NaOH溶液分别滴定 的HCl溶液和
的HCl溶液和 的
的 溶液,得到如图所示的两条滴定曲线,请回答有关问题:
溶液,得到如图所示的两条滴定曲线,请回答有关问题:
①NaOH溶液滴定
 溶液的曲线是
溶液的曲线是②图1和图2中的a=
(7)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各含氯元素微粒的组成分数
 [
[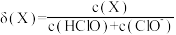 ,X为HClO或
,X为HClO或 ]与pH的关系如图所示。HClO的电离常数
]与pH的关系如图所示。HClO的电离常数 值为
值为
您最近一年使用:0次
解题方法
3 . 常温下,几种酸的电离常数如表所示:
(1)常温下,CH3COOH、HClO、H2CO3的酸性由强到弱的顺序为______ 。
(2)HCO 的电离平衡常数表达式为K=
的电离平衡常数表达式为K=______ 。
(3)常温下,实验测得某人血液中c(HCO )=2.3×10-2mol·L-1,c(H2CO3)=2.3×10-3mol·L-1,则该人血液呈
)=2.3×10-2mol·L-1,c(H2CO3)=2.3×10-3mol·L-1,则该人血液呈______ (填“酸性”“中性”或“碱性”)。
(4)常温下,pH=10的Na2CO3溶液中,由水电离的c(OH-)=______ 。
(5)常温下,等浓度的CH3COONa、NaClO、Na2CO3溶液的pH由大到小的顺序为______ (用溶质的化学式表示)。
(6)某温度下,向CH3COOH溶液中滴加NaOH溶液c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,则该温度下Ka(CH3COOH)=______ 。

| 弱酸 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.5×10-7 Ka2=4.7×10-11 |
(2)HCO
 的电离平衡常数表达式为K=
的电离平衡常数表达式为K=(3)常温下,实验测得某人血液中c(HCO
 )=2.3×10-2mol·L-1,c(H2CO3)=2.3×10-3mol·L-1,则该人血液呈
)=2.3×10-2mol·L-1,c(H2CO3)=2.3×10-3mol·L-1,则该人血液呈(4)常温下,pH=10的Na2CO3溶液中,由水电离的c(OH-)=
(5)常温下,等浓度的CH3COONa、NaClO、Na2CO3溶液的pH由大到小的顺序为
(6)某温度下,向CH3COOH溶液中滴加NaOH溶液c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,则该温度下Ka(CH3COOH)=

您最近一年使用:0次
4 . 亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298 K时,四种物质的电离平衡常数(K)如下表。
(1)下列不能说明HNO2是弱电解质的是 ______ (填序号)。
A.常温下0.1 mol/L NaNO2溶液的pH>7
B.用一定浓度HNO2溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
D.向HNO2溶液中滴入石蕊,溶液变红
(2)298K,10mL0.1mol/L的亚硝酸溶液的pH=____________ (lg7=0.85)。
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如下图所示,判断曲线Ⅰ对应的溶液为________ (填化学式)溶液。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是 _______ (用a、b、c表示,下同)。

(4)依据所提供数据回答下列问题:
①298 K时,NaHSO3溶液中HSO 水解平衡常数Kh=
水解平衡常数Kh= ________ ,由此可判断NaHSO3溶液呈 ___________ (填“酸性”“中性”或“碱性”)。
②H2SO3溶液和NaHCO3溶液主要反应的离子方程式为_______________ 。
| HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
| K | 4.9×10-4 | 1.8×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 | Ka1=1.3×10-2 Ka2=6.3×10-8 |
A.常温下0.1 mol/L NaNO2溶液的pH>7
B.用一定浓度HNO2溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
D.向HNO2溶液中滴入石蕊,溶液变红
(2)298K,10mL0.1mol/L的亚硝酸溶液的pH=
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如下图所示,判断曲线Ⅰ对应的溶液为

(4)依据所提供数据回答下列问题:
①298 K时,NaHSO3溶液中HSO
 水解平衡常数Kh=
水解平衡常数Kh= ②H2SO3溶液和NaHCO3溶液主要反应的离子方程式为
您最近一年使用:0次
2020-10-17更新
|
304次组卷
|
2卷引用:海南省琼山中学2019-2020学年高二上学期期末考试化学试题
解题方法
5 . 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。当向其中加入少量酸或碱时,溶液的酸碱性变化不大。回答下列问题:
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为______ ;另一份加入少量KOH溶液时,发生反应的离子方程式为______ 。
(2)现将0.04mol•L-1HA溶液和0.02mol•L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)______ c(CN-)。(填“<”“=”或“>”);
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是______ 。
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c( )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______ mol/L。
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为
(2)现将0.04mol•L-1HA溶液和0.02mol•L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c(
 )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=
您最近一年使用:0次



