1 . 常温下,某弱酸HA溶液中主要成分的物质的量浓度分数随pH的变化如图所示。下列有关叙述不正确的是


A.常温下,HA的电离平衡常数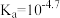 | B.若温度升高,曲线交点M会向左移动 |
C.NaA的水解平衡常数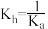 | D.某 的缓冲溶液,pH约为4 的缓冲溶液,pH约为4 |
您最近一年使用:0次
2 . 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法不正确 的是
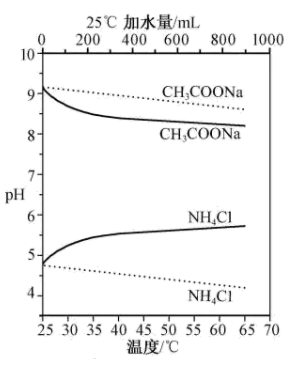

| A.图中 |
B.将NH4Cl溶液加水稀释至浓度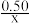 mol·L-1,溶液pH变化值小于lgx mol·L-1,溶液pH变化值小于lgx |
| C.随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 |
D.25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH ) ) |
您最近一年使用:0次
2021-01-09更新
|
9128次组卷
|
31卷引用:T12-电解质溶液
(已下线)T12-电解质溶液(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)难点7 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题15.离子反应图象-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡北京市第一○一中学2023届高三下学期三模化学试题(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 盐类的水解2021年1月新高考浙江化学高考真题湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题(已下线)2021年1月浙江高考化学试题变式题21-252021年湖北高考化学试题变式题11-19浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题山西大学附属中学校2022-2023学年高三上学期11月期中考试化学试题
名校
3 . 室温时,向20mL0.1mol·L−1的两种酸HA、HB中分别滴加0.1mol·L−1NaOH溶液,其pH变化分别对应下图中的I、II。下列说法不正确的是


| A.向NaA溶液中滴加HB可产生HA |
| B.滴加NaOH溶液至pH=7时,两种溶液中c(A-)=c(B-) |
| C.a点,溶液中微粒浓度:c(A-)>c(Na+) |
| D.滴加20mLNaOH溶液时,I中H2O的电离程度大于II中 |
您最近一年使用:0次
2020-11-06更新
|
389次组卷
|
8卷引用:北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:化学平衡 离子平衡
4 . 已知常温下,3种物质的电离平衡常数如下表:
下列说法不正确的是
| 物质 | HCOOH | CH3COOH | NH3·H2O |
| 电离平衡常数K | 1.77×10−4 | 1.75×10−5 | 1.76×10−5 |
| A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa |
| B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH) |
| C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+) |
| D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7 |
您最近一年使用:0次
2020-05-11更新
|
304次组卷
|
5卷引用:北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:化学平衡 离子平衡
(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:化学平衡 离子平衡北京市丰台区2020届高三第一次模拟考试化学试题北京市通州区2021届高三上学期摸底考试化学试题湖北省黄冈市麻城市实验高级中学2020届高三模拟(五)考试理综化学试题天津市汇文中学2022-2023学年高二上学期第二次阶段性测试化学试题
解题方法
5 . 某同学探究温度对溶液pH值影响,加热一组试液并测量pH后得到如下数据(溶液浓度均为0.1mol/L):
下列说法正确的是
| 温度(℃) | 10 | 20 | 30 | 40 |
| 纯水 | 7.30 | 7.10 | 6.95 | 6.74 |
| NaOH溶液 | 13.50 | 13.11 | 12.87 | 12.50 |
| CH3COOH溶液 | 2.90 | 2.89 | 2.87 | 2.85 |
| CH3COONa溶液 | 9.19 | 9.00 | 8.76 | 8.62 |
| A.随温度升高,纯水中的kw逐渐减小 |
| B.随温度升高,NaOH溶液pH变化主要受水电离平衡变化影响 |
| C.随温度升高,CH3COOH的电离促进了水的电离 |
| D.随温度升高,CH3COONa溶液的pH减小,说明水解程度减小,c(CH3COO-)增大 |
您最近一年使用:0次
2020-03-28更新
|
183次组卷
|
3卷引用:北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:化学平衡 离子平衡



