名校
1 . 已知相关数据如下:
下列说法正确的是
| 物质 | HF | H2CO3 | CaF2 | CaCO3 |
| 相关数据 | Ka=6.8×10−4 | Ka1=4.5×10−7 Ka2=4.7×10−11 | Ksp=3.5×10−11 | Ksp=3.4×10−9 |
| A.氟化钠溶液中存在五种微粒 |
| B.氢氟酸滴入碳酸钠溶液中,可能不产生气体 |
| C.氢氧化钙溶液与氢氟酸混合的离子方程式:2OH−+Ca2++2H++2F−=CaF2↓+2H2O |
| D.向氟化钙悬浊液中通入CO2能够发生反应:CaF2+CO2+H2O=CaCO3+2HF |
您最近一年使用:0次
2024-03-25更新
|
266次组卷
|
3卷引用:北京师范大学附属实验中学2023-2024学年高三下学期开学考化学试题
名校
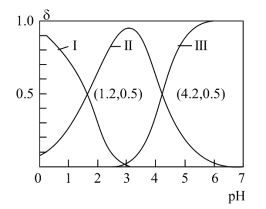
2 .  为二元酸,其电离过程为:
为二元酸,其电离过程为: ,
, 。常温时,向
。常温时,向 水溶液中逐滴滴加
水溶液中逐滴滴加 溶液,混合溶液中
溶液,混合溶液中 、
、 和
和 的物质的量分数
的物质的量分数 随pH变化的关系如图所示。下列说法正确的是
随pH变化的关系如图所示。下列说法正确的是
 为二元酸,其电离过程为:
为二元酸,其电离过程为: ,
, 。常温时,向
。常温时,向 水溶液中逐滴滴加
水溶液中逐滴滴加 溶液,混合溶液中
溶液,混合溶液中 、
、 和
和 的物质的量分数
的物质的量分数 随pH变化的关系如图所示。下列说法正确的是
随pH变化的关系如图所示。下列说法正确的是
A. 的 的 的数量级为 的数量级为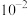 |
B.当溶液中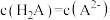 时, 时, |
C.当溶液中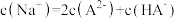 时,加入V( 时,加入V( 溶液) 溶液)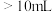 |
D.向 的溶液中继续滴加 的溶液中继续滴加 溶液,水的电离程度减小 溶液,水的电离程度减小 |
您最近一年使用:0次
名校
3 . 已知:25℃时,相关酸的电离平衡常数如下表所示,请回答下列问题:
(1) 的电离平衡常数表达式
的电离平衡常数表达式
___________ 。常温下,下列事实能说明 是弱电解质的是
是弱电解质的是___________ (填写序号)
① 与水能以任意比互溶
与水能以任意比互溶
②0.1 mol/L 溶液导电能力比0.1 mol/L盐酸弱
溶液导电能力比0.1 mol/L盐酸弱
③常温下 的
的 溶液稀释十倍后
溶液稀释十倍后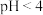
④ 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大
⑥大小相同的锌片与同体积同浓度的盐酸和 反应,产生
反应,产生 的物质的量相同
的物质的量相同
(2)25℃时,0.1 mol/L的① ②
② ③NaCN三种溶液的pH由大到小的顺序是:
③NaCN三种溶液的pH由大到小的顺序是:___________ (填写序号)。
(3)0.1 mol/L 溶液加水稀释后,
溶液加水稀释后,
___________ (填“增大”、“减小”或“不变”),
___________ (填“增大”、“减小”或“不变”)。
(4)常温下用0.10 mol/L的NaOH溶液滴定20.00 mL 0.10 mol/L的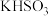 溶液,溶液pH的变化曲线如图所示(忽略空气的影响)。下列叙述中正确的是
溶液,溶液pH的变化曲线如图所示(忽略空气的影响)。下列叙述中正确的是___________ (填写序号)

①a点溶液中:
②b点溶液中:
③c点溶液中:
④d点水的电离程度大于c点
(5)向 溶液中通入
溶液中通入 ,
, 与
与 发生的主要离子反应为
发生的主要离子反应为___________ ,
___________ 。
| 酸 |  | HClO | HCN |  |  |
| 电离常数(K) |  |  | 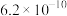 |   | 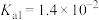 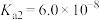 |
(1)
 的电离平衡常数表达式
的电离平衡常数表达式
 是弱电解质的是
是弱电解质的是①
 与水能以任意比互溶
与水能以任意比互溶②0.1 mol/L
 溶液导电能力比0.1 mol/L盐酸弱
溶液导电能力比0.1 mol/L盐酸弱③常温下
 的
的 溶液稀释十倍后
溶液稀释十倍后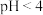
④
 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向
 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大⑥大小相同的锌片与同体积同浓度的盐酸和
 反应,产生
反应,产生 的物质的量相同
的物质的量相同(2)25℃时,0.1 mol/L的①
 ②
② ③NaCN三种溶液的pH由大到小的顺序是:
③NaCN三种溶液的pH由大到小的顺序是:(3)0.1 mol/L
 溶液加水稀释后,
溶液加水稀释后,

(4)常温下用0.10 mol/L的NaOH溶液滴定20.00 mL 0.10 mol/L的
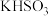 溶液,溶液pH的变化曲线如图所示(忽略空气的影响)。下列叙述中正确的是
溶液,溶液pH的变化曲线如图所示(忽略空气的影响)。下列叙述中正确的是
①a点溶液中:

②b点溶液中:

③c点溶液中:

④d点水的电离程度大于c点
(5)向
 溶液中通入
溶液中通入 ,
, 与
与 发生的主要离子反应为
发生的主要离子反应为
您最近一年使用:0次
名校
4 . 亚砷酸(H3AsO3)可用于治疗白血病,亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。不正确 的是
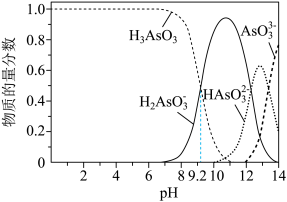
| A.人体血液的pH约为7.35-7.45,血液中所含+3价砷元素的主要微粒是H3AsO3 |
B.向H3AsO3溶液中滴加KOH溶液至pH=11的过程中,主要反应的离子方程式为:H3AsO3+OH-=H2AsO +H2O +H2O |
| C.该温度下,H3AsO3的电离平衡常数Ka1约为10-9.2 |
D.向H3AsO3溶液中滴加KOH溶液至pH=13时,溶液中存在关系:c(H2AsO )+2c(HAsO )+2c(HAsO )+3c(AsO )+3c(AsO )+c(OH-)=c(H+) )+c(OH-)=c(H+) |
您最近一年使用:0次
2024-02-23更新
|
228次组卷
|
4卷引用:北京师范大学附属中学2023-2024学年高三下学期开学考化学试题
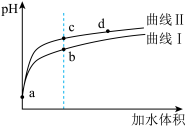
5 . 某温度下, 和
和 的电离常数分别为
的电离常数分别为 和
和 。将
。将 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是
随加水体积的变化如图所示。下列叙述正确的是
 和
和 的电离常数分别为
的电离常数分别为 和
和 。将
。将 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是
随加水体积的变化如图所示。下列叙述正确的是
A.曲线Ⅰ代表 溶液 溶液 |
| B.溶液中水的电离程度:b点>c点 |
C.从c点到d点,溶液中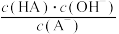 保持不变(其中 保持不变(其中 、 、 分别代表相应的酸和酸根离子) 分别代表相应的酸和酸根离子) |
D.相同体积a点的两溶液分别与 恰好中和后,溶液中 恰好中和后,溶液中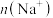 相同 相同 |
您最近一年使用:0次
2019-06-09更新
|
15368次组卷
|
100卷引用:北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷
北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷吉林省长春外国语学校2021-2022学年高二下学期期初考试化学试题黑龙江省大庆中学2021-2022学年高二下学期开学考试化学试题北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题2019年天津高考化学试题(已下线)专题10 水溶液中的离子平衡——2019年高考真题和模拟题化学分项汇编河南省驻马店市2018-2019学年高二下学期期末考试化学试题江西省上饶中学2019-2020学年高二上学期第一次月考(理科培优班)化学试题广东省揭阳市第三中学2020届高三上学期第三次月考理综化学试题贵州省遵义市南白中学2019-2020学年高二上学期期中考试化学试题(已下线)专题8.1 弱电解质的电离平衡(练)-《2020年高考一轮复习讲练测》(已下线)专题8.1 弱电解质的电离平衡(讲)-《2020年高考一轮复习讲练测》上海交通大学附中2019-2020学年高三上学期期中考试化学试题(已下线)专题8.2 水的电离和溶液的pH(练)-《2020年高考一轮复习讲练测》2020届高考化学小题狂练(全国通用版)专练15 弱电解质的电离平衡和溶液酸碱性(已下线)专题8.2 水的电离和溶液的pH(讲)-《2020年高考一轮复习讲练测》吉林省延边第二中学2019-2020学年高二12月月考化学试题湖南省邵东县第一中学2019-2020学年高二上学期第三次月考化学试题吉林省大安一中2019-2020学年高三上学期第四次月考化学试题备考突破2020高三化学专题强化集训——弱电解质溶液中的曲线问题分析夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 水解平衡常数的应用(强化练习)备考突破2020高三化学专题强化集训——电解质溶液中的曲线问题江西省赣州市南康中学、平川中学、信丰中学2019—2020学年高二上学期12月月考试题化学专题2.3 水溶液中的离子平衡(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升浙江省温州市平阳中学2020届高三下学期“居家考试”化学试题山西省太原市山西大学附属中学2019-2020学年高二上学期12月月考化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训重庆市云阳江口中学校2020届高三下学期第一次月考化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期第二次月考化学试题黑龙江省大兴安岭漠河县第一中学2019-2020学年高二上学期第二次月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第2节 弱电解质的电离盐类的水解高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测新疆哈密市第十五中学2021届高三上学期第一次质量检测化学试题(已下线)3.2.2+pH的计算及其应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 高考帮黑龙江省鹤岗市第一中学2020-2021学年高二10月月考化学试题四川省成都外国语学校2020-2021学年高二10月月考化学试题黑龙江绥化市第一中学2020-2021学年高二上学期第一次月考化学试题 鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关第26讲 水的电离和溶液的pH (精讲)-2021年高考化学一轮复习讲练测第25讲 弱电解质的电离平衡(精讲)-2021年高考化学一轮复习讲练测辽宁省开原市第二高级中学2020-2021学年高二上学期期中考试化学试题(已下线)3.2.1 水的电离和溶液的酸碱性(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99(已下线)小题必刷30 水的电离与溶液的酸碱性——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷29 弱电解质的电离平衡——2021年高考化学一轮复习小题必刷(通用版本)山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题(已下线)练习10 水的电离和溶液的pH-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)江西省吉安市2020-2021学年高二上学期期末教学质量检测化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)云南省弥勒市第一中学2020-2021学年高二下学期化学4月月考试题云南省玉溪市一中2020-2021学年高二下学期4月月考化学试题(已下线)第23讲 弱电解质的电离平衡(精练)-2022年高考化学一轮复习讲练测选择性必修1(SJ)专题3专题培优专练(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时40 水的电离与溶液的酸碱性-2022年高考化学一轮复习小题多维练(全国通用)广东省广州市真光中学2020-2021学年高二上学期期中化学试题吉林省长春市第二中学2021-2022学年高二上学期第一次月考化学试题(已下线)第22讲 水的电离与溶液的pH(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向24 弱电解质的电离平衡-备战2022年高考化学一轮复习考点微专题(已下线)第1讲 弱电解质的电离平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)重庆育才中学2021-2022学年高二上学期第三次定时练习化学试题重庆复旦中学2021-2022学年高二上学期期中考试化学试题(已下线)第07练 电离平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-讲义江苏省江阴市普通高中2021-2022学年高一下学期期末考试化学试题(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题(已下线)微专题37 强弱电解质的判断与比较-备战2023年高考化学一轮复习考点微专题(已下线)第21讲 电离平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省新民市第一高级中学2021-2022学年高二上学期10月月考化学试题新疆生产建设兵团第十师北屯高级中学2021-2022学年高二上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)江苏省海安市实验中学2021-2022高二上学期第二次学情检测化学试题湖南省临湘市第五中学2021-2022学年高二上学期第三次月考化学试题(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第47讲 水的电离和溶液的pH(已下线)题型127 电离平衡常数的应用及计算(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(讲)(已下线)专题16 水溶液中的离子平衡(已下线)T5-电解质溶液江西省宜春市宜丰中学2022-2023学年高三上学期1月期末考试化学试题(已下线)第2讲 溶液的酸碱性和pH计算第1讲 弱电解质的电离平衡四川省攀枝花市第七高级中学校2023-2024学年高二上学期期中考试化学试题福建省泉州市永春第一中学2023-2024学年高二上学期11月期中考试化学(选择性考试)试题天津市耀华中学2023-2024学年高二上学期12月月考化学试卷山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第二次月考化学试题天津市第四十二中学2023-2024学年高二上学期第二次月考化学试题辽宁省大连市第四十四中学2022-2023学年高三上学期10月考试化学试题



