名校
1 . 醋酸钠是一种常用的防腐剂和缓冲剂。某小组探究外界因素对 水解程度的影响。
水解程度的影响。
(1)写出 水解的离子方程式
水解的离子方程式___________ 。
(2)甲同学设计实验方案如下(表中溶解浓度均为 )。
)。
i.实验___________ (填序号),探究加水稀释对 水解程度的影响。
水解程度的影响。
ii.实验1和3,探究加入 对
对 水解程度的影响。
水解程度的影响。
iii.实验1和4,探究温度对 水解程度的影响,
水解程度的影响, 。
。
(3)根据甲同学的实验方案,补充数据:
___________ 。实验测得 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据___________ (填一种微粒的化学式)的浓度增大可以说明加入 能促进
能促进 的水解。
的水解。
(4) 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测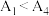 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是___________ 。
 水解程度的影响。
水解程度的影响。(1)写出
 水解的离子方程式
水解的离子方程式(2)甲同学设计实验方案如下(表中溶解浓度均为
 )。
)。i.实验
 水解程度的影响。
水解程度的影响。ii.实验1和3,探究加入
 对
对 水解程度的影响。
水解程度的影响。iii.实验1和4,探究温度对
 水解程度的影响,
水解程度的影响, 。
。| 序号 | 温度 |  |  | 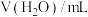 |  |
| 1 |  | 40.0 | 0 | 0 |  |
| 2 |  | 4.0 | 0 | 36.0 |  |
| 3 |  | 20.0 | 10.0 | a |  |
| 4 |  | 40.0 | 0 | 0 | 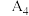 |

 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据 能促进
能促进 的水解。
的水解。(4)
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测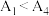 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是
您最近一年使用:0次
2 . 几种弱酸的电离常数(25℃)如下表:
(1) 的第一步电离方程式为
的第一步电离方程式为___________ 。
(2)上述三种酸的酸性由强到弱的顺序是___________ (写化学式)。
(3)对 溶液进行下列操作,能使
溶液进行下列操作,能使 的水解程度增大的是___________(填标号)。
的水解程度增大的是___________(填标号)。
(4)用实验确定HA是否为弱电解质,设计了如下实验方案:
①方案1:先量取一定体积的HA,配制成 的溶液,用pH计测出常温下该溶液的pH的值
的溶液,用pH计测出常温下该溶液的pH的值___________ ,证明HA为弱电解质。
②方案2:设计一个合理且比较容易进行的实验方案(药品可任取),并作简明扼要的表述:___________ 。
③25℃时,用pH计测定不同浓度HA溶液的pH如图所示。稀释HA溶液,水的电离程度会___________ (填“增大”或“减小”),根据图中信息,判断HA为弱电解质的依据是___________ 。

| 弱酸 |  | HClO |  |
电离常数 | 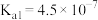  |  |  |
 的第一步电离方程式为
的第一步电离方程式为(2)上述三种酸的酸性由强到弱的顺序是
(3)对
 溶液进行下列操作,能使
溶液进行下列操作,能使 的水解程度增大的是___________(填标号)。
的水解程度增大的是___________(填标号)。| A.适当升高温度 | B.加入NaOH固体 |
| C.通入HCl气体 | D.加入 固体 固体 |
①方案1:先量取一定体积的HA,配制成
 的溶液,用pH计测出常温下该溶液的pH的值
的溶液,用pH计测出常温下该溶液的pH的值②方案2:设计一个合理且比较容易进行的实验方案(药品可任取),并作简明扼要的表述:
③25℃时,用pH计测定不同浓度HA溶液的pH如图所示。稀释HA溶液,水的电离程度会

您最近一年使用:0次
名校
3 . 铁的化合物在水溶液中呈现丰富的颜色,这与其水解平衡和配位平衡有关。
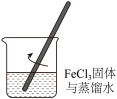
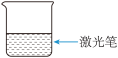
(1)下列为用氯化铁固体制备氢氧化铁胶体的相关实验,可以达到实验目的的是___________。
(2)实验室用 溶液制备
溶液制备 胶体的化学反应方程式为
胶体的化学反应方程式为___________ 。
(3)实验小组为探究溶液 对
对 水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。
水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。
已知:① 水解程度越大,颜色越深
水解程度越大,颜色越深
②颜色越深,透光率越低
①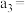
___________ ,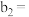
___________ 。
②由
___________  ,可证明:
,可证明: 减小,
减小, 的水解平衡逆向移动。(选填“>”“<”或“=”)
的水解平衡逆向移动。(选填“>”“<”或“=”)
③分析实验结果: ,同学甲推测原因可能是:
,同学甲推测原因可能是: (较深的黄色),并做了如下实验:
(较深的黄色),并做了如下实验:
试剂 为
为___________ ,可由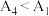 ,证实同学甲的推测。
,证实同学甲的推测。
通过对比___________ (填字母)的实验结果,证明 对
对 的水解平衡的影响。
的水解平衡的影响。
A.组别4与组别1 B.组别4与组别2 C.组别4与组别3
(4)为了探究 的热效应,同学乙设计了下列四组实验方案:
的热效应,同学乙设计了下列四组实验方案:
若实验结果为___________ ,则可证明: 为吸热反应。
为吸热反应。
(5)写出一种强酸弱碱盐(除 )及其用途:
)及其用途:___________ 。
(1)下列为用氯化铁固体制备氢氧化铁胶体的相关实验,可以达到实验目的的是___________。
| A | B | C | D |
配制 溶液 溶液 | 制备 胶体 胶体 | 观察胶体的丁达尔效应 | 分离 胶体与溶液 胶体与溶液 |
 |  |  |  |
| A.A | B.B | C.C | D.D |
 溶液制备
溶液制备 胶体的化学反应方程式为
胶体的化学反应方程式为(3)实验小组为探究溶液
 对
对 水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。
水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。已知:①
 水解程度越大,颜色越深
水解程度越大,颜色越深②颜色越深,透光率越低
| 组别 |  溶液 溶液 | 蒸馏水 | 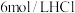 溶液 溶液 | 透光率 |
| 1 |  |  | 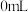 |  |
| 2 |  |  | 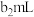 |  |
| 3 |  |  |  |  |
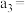
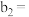
②由

 ,可证明:
,可证明: 减小,
减小, 的水解平衡逆向移动。(选填“>”“<”或“=”)
的水解平衡逆向移动。(选填“>”“<”或“=”)③分析实验结果:
 ,同学甲推测原因可能是:
,同学甲推测原因可能是: (较深的黄色),并做了如下实验:
(较深的黄色),并做了如下实验:| 组别 |  溶液 溶液 | 蒸馏水 | 试剂 | 透光率 |
| 4 |  |  |  |  |
 为
为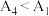 ,证实同学甲的推测。
,证实同学甲的推测。通过对比
 对
对 的水解平衡的影响。
的水解平衡的影响。A.组别4与组别1 B.组别4与组别2 C.组别4与组别3
(4)为了探究
 的热效应,同学乙设计了下列四组实验方案:
的热效应,同学乙设计了下列四组实验方案:| 组别 | 温度 | 试剂 | 透光率 |
| 5 |  |  溶液 溶液 | 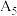 |
| 6 |  |  溶液 溶液 | 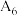 |
| 7 |  | 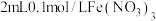 溶液 溶液 | 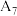 |
| 8 |  | 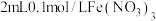 溶液 溶液 | 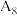 |
 为吸热反应。
为吸热反应。(5)写出一种强酸弱碱盐(除
 )及其用途:
)及其用途:
您最近一年使用:0次
2023-05-29更新
|
612次组卷
|
3卷引用:广东省华南师范大学附属中学2023届高三下学期第三次模拟考试化学试题
4 . 回答下列问题:
(1)已知,常温下几种物质的电离常数如下: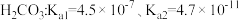 HClO:Ka=3.0×10-8。少量二氧化碳通入到次氯酸钠中的化学方程式
HClO:Ka=3.0×10-8。少量二氧化碳通入到次氯酸钠中的化学方程式___________ 。
(2)若向NaHSO3溶液中加入少量的Cl2,则溶液中pH将___________ (填“增大”“减小”或“不变”)。
(3)能证明Na2SO3溶液中存在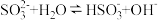 水解平衡
水解平衡 事实是___________(填序号)。
事实是___________(填序号)。
(4)已知室温下: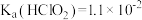 ,
,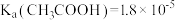 。25℃时,浓度均为0.1mol· L-1的NaClO2溶液和CH3COONa溶液,两溶液中
。25℃时,浓度均为0.1mol· L-1的NaClO2溶液和CH3COONa溶液,两溶液中
______ (填“>”“<”或“=”) 。若要使两溶液的pH相等,应
。若要使两溶液的pH相等,应_____ (填序号)。
a.向NaClO2溶液中加适量水 b.向NaClO2溶液中加适量NaOH固体
c.向CH3COONa溶液中加CH3COONa固体 d.向CH3COONa溶液中加适量的水
(5)直接加热CuCl2溶液得不到纯净的无水CuCl2固体,原因是___________ (用离子方程式表示)。
(1)已知,常温下几种物质的电离常数如下:
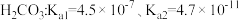 HClO:Ka=3.0×10-8。少量二氧化碳通入到次氯酸钠中的化学方程式
HClO:Ka=3.0×10-8。少量二氧化碳通入到次氯酸钠中的化学方程式(2)若向NaHSO3溶液中加入少量的Cl2,则溶液中pH将
(3)能证明Na2SO3溶液中存在
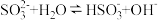 水解平衡
水解平衡 事实是___________(填序号)。
事实是___________(填序号)。| A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去 |
| B.滴入酚酞溶液变红,微热后红色加深 |
| C.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去 |
| D.滴入酚酞溶液变红,再加NaOH溶液红色加深 |
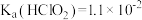 ,
,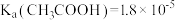 。25℃时,浓度均为0.1mol· L-1的NaClO2溶液和CH3COONa溶液,两溶液中
。25℃时,浓度均为0.1mol· L-1的NaClO2溶液和CH3COONa溶液,两溶液中
 。若要使两溶液的pH相等,应
。若要使两溶液的pH相等,应a.向NaClO2溶液中加适量水 b.向NaClO2溶液中加适量NaOH固体
c.向CH3COONa溶液中加CH3COONa固体 d.向CH3COONa溶液中加适量的水
(5)直接加热CuCl2溶液得不到纯净的无水CuCl2固体,原因是
您最近一年使用:0次
5 . 为研究FeCl3溶液的性质,某小组同学进行了如下探究实验。
I.FeCl3溶液与碱、盐的反应

(1)①中主要发生了沉淀的转化,用离子反应方程式表示为___________ 。
(2)对于反应②,同学认为其反应原理为“物质间发生互相促进的水解”,离子反应方程式为___________ 。有同学提出沉淀中可能还有碳酸盐,将沉淀过滤、洗涤后取样,___________ ,证明沉淀中含有碳酸盐。
II.FeCl3溶液与足量锌粉反应的探究
小组同学进行如下实验探究,操作及现象如下:
已知:Zn的性质与Al相似,能发生反应:Zn+2NaOH=Na2ZnO2+H2↑
(3)结合实验现象和平衡移动原理解释出现红褐色沉淀的原因___________ 。
(4)用离子方程式表示溶液为浅绿色的原因___________ 。
(5)分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的NaOH溶液,产生气泡;
iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸并加热,产生大量气泡;
iv.向iii反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是___________ 。
b.小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是___________ 。
I.FeCl3溶液与碱、盐的反应

(1)①中主要发生了沉淀的转化,用离子反应方程式表示为
(2)对于反应②,同学认为其反应原理为“物质间发生互相促进的水解”,离子反应方程式为
II.FeCl3溶液与足量锌粉反应的探究
小组同学进行如下实验探究,操作及现象如下:
| 操作 | 现象 |
| 向反应瓶中加入6.5g锌粉,然后加入50mL1.0mol·L−1的FeCl3溶液,搅拌,充分反应 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
(3)结合实验现象和平衡移动原理解释出现红褐色沉淀的原因
(4)用离子方程式表示溶液为浅绿色的原因
(5)分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的NaOH溶液,产生气泡;
iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸并加热,产生大量气泡;
iv.向iii反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是
b.小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是
您最近一年使用:0次
2022-01-14更新
|
129次组卷
|
2卷引用:北京市石景山区2021-2022学年高二上学期期末考试化学试题
2021高三·全国·专题练习
解题方法
6 . 在0.1 mol·L-1Na2SO3溶液中,加2滴酚酞溶液显红色,下列能证明Na2SO3溶液中存在 +H2O
+H2O
 +OH-水解平衡的事实是
+OH-水解平衡的事实是________ (填字母)。
A.再加入H2SO4溶液红色退去
B.再加入氯水后红色退去
C.再加入BaCl2溶液后产生沉淀且红色退去
D.再加入NaHSO4溶液后红色退去
E.再微热,溶液红色变深
 +H2O
+H2O
 +OH-水解平衡的事实是
+OH-水解平衡的事实是A.再加入H2SO4溶液红色退去
B.再加入氯水后红色退去
C.再加入BaCl2溶液后产生沉淀且红色退去
D.再加入NaHSO4溶液后红色退去
E.再微热,溶液红色变深
您最近一年使用:0次
7 . 完成下列与水解有关的问题:
(1)要求设计实验证明盐类水解是吸热过程,有四位学生分别做了以下实验,其中根据实验现象得出的结论正确的是________ (填序号)。
A.甲学生:在醋酸钠溶液中滴入酚酞试液,加热后溶液红色加深,说明盐类水解是吸热的
B.乙学生:将硝酸铵晶体溶于水,水温下降,说明硝酸铵水解是吸热的
C.丙学生:在盐酸中加入同温度的氨水,混合液的温度下降,说明盐类水解是吸热的
D.丁学生:在醋酸钠溶液中加入醋酸钠晶体,溶液温度下降,说明盐类水解是吸热的
(2)现有 的纯碱溶液试用pH试纸测定溶液的pH,其正确的操作是
的纯碱溶液试用pH试纸测定溶液的pH,其正确的操作是_____________ ;纯碱溶液呈碱性的原因是________________ (用离子方程式表示)。
(3)在纯碱溶液中滴入酚酞试液,溶液变红色,若在该溶液中再滴入过量的 溶液,所观察到的现象是
溶液,所观察到的现象是________________ ;其原因是________________ 。
(4)向纯碱溶液中加入少量氯化铁溶液,观察到的现象是________________ ;原因是________________ 。
(1)要求设计实验证明盐类水解是吸热过程,有四位学生分别做了以下实验,其中根据实验现象得出的结论正确的是
A.甲学生:在醋酸钠溶液中滴入酚酞试液,加热后溶液红色加深,说明盐类水解是吸热的
B.乙学生:将硝酸铵晶体溶于水,水温下降,说明硝酸铵水解是吸热的
C.丙学生:在盐酸中加入同温度的氨水,混合液的温度下降,说明盐类水解是吸热的
D.丁学生:在醋酸钠溶液中加入醋酸钠晶体,溶液温度下降,说明盐类水解是吸热的
(2)现有
 的纯碱溶液试用pH试纸测定溶液的pH,其正确的操作是
的纯碱溶液试用pH试纸测定溶液的pH,其正确的操作是(3)在纯碱溶液中滴入酚酞试液,溶液变红色,若在该溶液中再滴入过量的
 溶液,所观察到的现象是
溶液,所观察到的现象是(4)向纯碱溶液中加入少量氯化铁溶液,观察到的现象是
您最近一年使用:0次
8 . (NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)是一种重要的化工原料,用途广泛。完成下列填空:
(1)Fe的电子排布式为1s22s22p63s23p63d64s2,铁原子核外有___ 种能量不同的电子,占有的轨道总数是___ 个。铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第___ 周期___ 族。
(2)写出Fe与水反应的化学方程式:___ 。
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:___ 。
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等___ ?为什么?___ 。
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+___ 。
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是___ (写一条即可)。
(1)Fe的电子排布式为1s22s22p63s23p63d64s2,铁原子核外有
(2)写出Fe与水反应的化学方程式:
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是
您最近一年使用:0次
20-21高二上·江西南昌·期中
9 . (1)25℃时,浓度为0.1 mol/L的5种溶液:①HF;②HBr;③Ba(OH)2;④Na2CO3;⑤NaCl溶液,pH由小到大的顺序为_________ (填编号)。
(2)常温下,0.1mol/L HA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(A-)=________ mol/L(填精确计算结果的具体数字)。
(3)在一定条件下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-a mol/L和1.0×10-b mol/L,在此温度下,水的离子积为_____________ 。
(4)为证明盐的水解是吸热的,三位同学分别设计了如下方案,其中正确的是_______ (填序号)。
a.甲同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
b.乙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
c.丙同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的
(2)常温下,0.1mol/L HA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(A-)=
(3)在一定条件下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-a mol/L和1.0×10-b mol/L,在此温度下,水的离子积为
(4)为证明盐的水解是吸热的,三位同学分别设计了如下方案,其中正确的是
a.甲同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
b.乙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
c.丙同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的
您最近一年使用:0次
解题方法
10 . 某班同学用如下实验探究Fe2+、Fe3+的性质。
请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol·L-1的溶液.在FeCl2溶液中需加入少量铁屑,其目的是____ 。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为:___ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___ 。
(4)丙组同学取l0mL0.lmol·L-1KI溶液,加入6mL0.lmol·L-1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入lmLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:
③第三支试行中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号)___ ;实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号)____ ,由此可以证明该氧化还原反应为___ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是___ ;生成沉淀的原因是(用平衡移动原理解释)____ 。
(6)戊组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2废液中:c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为___ 。
②完成NaClO3氧化FeCl2的离子方程式:___ 。
 ClO
ClO +
+ Fe2++
Fe2++ ___=
___= Cl-+
Cl-+ Fe3++
Fe3++ ___
___
③FeCl3具有净水作用,其原理是___ 。
请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol·L-1的溶液.在FeCl2溶液中需加入少量铁屑,其目的是
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为:
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取l0mL0.lmol·L-1KI溶液,加入6mL0.lmol·L-1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入lmLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:
③第三支试行中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号)
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
(6)戊组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2废液中:c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为
②完成NaClO3氧化FeCl2的离子方程式:
 ClO
ClO +
+ Fe2++
Fe2++ ___=
___= Cl-+
Cl-+ Fe3++
Fe3++ ___
___③FeCl3具有净水作用,其原理是
您最近一年使用:0次



