2020高三·北京·专题练习
名校
解题方法
1 . 某小组同学探究 SO2 与 Fe3+盐溶液的反应,进行了如下实验:已知:Fe3++HSO3- Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)
结合上述实验,下列说法不正确的是
 Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)| 实验 | ① | ② | ③ |
| 操作 | 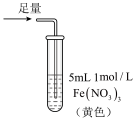 | 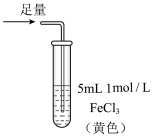 | 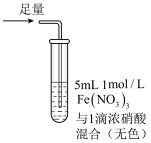 |
| 现象 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液变为浅黄色,加入铁氰化钾溶液,产生蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液几乎无色,加入铁氰化钾溶液,产生大量蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液变为黄色(比①深),加入铁氰化钾溶液,产生蓝色沉淀 |
| A.产生红棕色物质的反应速率快于SO2与Fe3+氧化还原反应的速率 |
| B.①与②对照,说明阴离子种类对SO2与Fe3+氧化还原反应的速率有影响 |
| C.Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,说明浓硝酸具有漂白性 |
| D.5h后③比①黄色更深不能证明是 NO3-浓度的增大减慢了SO2与Fe3+反应的速率 |
您最近一年使用:0次
名校
2 . 下列说法不正确的是( )
| A.Na2CO3溶液蒸干并灼烧可得无水Na2CO3 |
| B.pH相同的HA和HB溶液,分别与一定浓度的氢氧化钠溶液完全中和,HA消耗的氢氧化钠溶液体积多,则可证明酸性HA<HB |
| C.任何温度下均能自发进行2H2O2(l)=2H2O(l) +O2(g),则该反应的△H<0,△S>0 |
| D.除去MgCl2溶液中混有的少量FeCl3,可向溶液中加入足量MgCO3,过滤 |
您最近一年使用:0次
2019-12-30更新
|
124次组卷
|
3卷引用:黑龙江省哈尔滨市尚志市尚志中学2019-2020学年高二上学期第三次月考化学试题
3 . 下列说法不正确的是
| A.实验探究Zn-Cu及稀硫酸原电池工作原理,在稀硫酸溶液中加少量重铬酸钾因其有去极化作用可延长灯泡发亮时间,重铬酸钾也可用 KMnO4、MnO2等强氧化性物质代替 |
| B.一些有机溶剂(如乙醚、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 |
| C.在醋酸钠溶液中滴入酚酞试液,加热后红色加深,可证明盐类水解是吸热反应 |
| D.可使用溴水鉴别植物油和汽油 |
您最近一年使用:0次
名校
4 . 根据实验操作及现象,下列结论中正确的是
| 实验目的 | 方案设计和现象 | 结论 | |
| A | 比较KMnO4、Cl2和Fe3+的氧化性 | 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性:KMnO4>Cl2>Fe3+ |
| B | 比较Ksp(AgCl)、Ksp(AgI)的大小 | 向NaCl、NaI混合溶液中滴入少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)大于Ksp(AgI) |
| C | 检验海带中是否含有碘元素 | 将海带灰溶解过滤后,取适量滤液于试管中,酸化后加入少量双氧水,充分反应后加入1-2滴淀粉溶液 | 溶液变蓝,则证明海带中含有碘元素 |
| D | 温度对SO 水解平衡的影响 水解平衡的影响 | 将25℃0.1mol•L-1Na2SO3溶液加热到40℃,用传感器监测溶液pH变化 | pH变小,温度升高,SO 的水解平衡正向移动 的水解平衡正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-11更新
|
186次组卷
|
2卷引用:四川省成都外国语学校2023-2024学年高三上学期期末考试理科综合试题-高中化学
名校
5 . 室温下,下列实验方案能达到探究目的的是
| 选项 | 探究目的 | 探究方案 |
| A | 证明丁烯醛中含碳碳双键 | 向丁烯醛 中加入 中加入酸性高锰酸钾溶液,观察溶液颜色变化 |
| B | 比较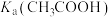 和 和 的大小 的大小 | 向 溶液中滴加 溶液中滴加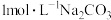 溶液,观察是否产生气泡 溶液,观察是否产生气泡 |
| C | 比较 与 与 氧化性强弱 氧化性强弱 | 向 溶液中滴入硫酸酸化的 溶液中滴入硫酸酸化的 溶液,观察溶液颜色变化 |
| D | 探究浓度对 溶液水解程度的影响 溶液水解程度的影响 | 向 的 的 溶液中滴加酚酞溶液 溶液中滴加酚酞溶液观察现象,再加入少量  固体,观察颜色变化 固体,观察颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。
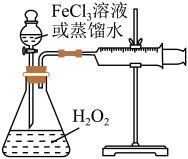
(1)①写出锥形瓶中反应的化学方程式________ 。
②设计实验方案:在不同条件下,测定_______ 。(要求所测得的数据能直接体现反应速率大小)
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
①表格中a=_______ ,b=________ 。
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是________ 。
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为_______ 。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴_______ 溶液,产生蓝色沉淀。
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因______ 。

(1)①写出锥形瓶中反应的化学方程式
②设计实验方案:在不同条件下,测定
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
| 实验序号 | 10%H2O2/mL | 蒸馏水/mL | 0.2mol·LFeCl3溶液/mL | 现象 |
| I | 10 | a | 0 | 无明显变化 |
| Ⅱ | 10 | b | 2 | 锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅 |
| Ⅲ | 5 | 5 | 2 | 锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快 |
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因
您最近一年使用:0次
7 . 下列对实验设计的评价错误的是
| 选项 | 实验设计 | 实验评价 |
| A. | 将含有二氧化硫的气体通入酸性高锰酸钾中,然后加入足量氯化钡溶液。通过测定白色沉淀的质量,可推算二氧化硫的物质的量 | 不合理,酸性高锰酸钾中的稀硫酸会与氯化钡产生沉淀 |
| B. | 实验室用浓硫酸和乙醇制取乙烯时,若要检验所得气体含有CH2=CH2,可将混合气体干燥后,通入溴的四氯化碳溶液中。若溶液褪色,则证明有乙烯 | 合理,混合气体中,只有乙烯可使溴的四氯化碳溶液褪色 |
| C. | 常温下,用pH计分别测定等体积 CH3COONH4溶液和 CH3COONH4溶液和 CH3COONH4溶液的pH.通过比较pH值,探究浓度对水的电离程度的影响 CH3COONH4溶液的pH.通过比较pH值,探究浓度对水的电离程度的影响 | 合理 |
| D. | 探究浓度对反应速率的影响,向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液。通过观察现象,探究浓度对反应速率的影响 | 不合理,该实验无明显现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-16更新
|
418次组卷
|
3卷引用:2024年辽宁省抚顺市普通高中高三下学期模拟考试化学试卷
8 . 下列方案设计、现象和结论均正确的是
| 选项 | 目的 | 方案设计 | 现象和结论 |
| A | 证明氯与碳的非金属性 | 取适量盐酸加入NaHCO3溶液中 | 产生气泡,证明氯的非金属性比碳强 |
| B | 乙醇消去产物的检验 | 取1mL无水乙醇,边振荡边加入3mL浓硫酸,再加入几片碎瓷片。连接好装置,迅速加热至170℃,将产生的气体通入酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色,证明乙醇消去反应有乙烯生成 |
| C |  的水解过程的热效应 的水解过程的热效应 | 取适量Na2SO3溶液于试管中,测定pH,然后加热一段时间,再次测定该溶液的pH | pH变小,证明 的水解过程为放热过程 的水解过程为放热过程 |
| D | 比较BaCO3与BaSO4的Ksp大小 | 将少量BaCl2溶液分别逐滴加入等浓度的Na2CO3溶液和Na2SO4溶液中 | Na2SO4溶液中先出现沉淀,证明Ksp(BaCO3)>Ksp(BaSO4) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-13更新
|
896次组卷
|
3卷引用:重庆市拔尖强基联盟2024届高三下学期2月联合考试化学试题
名校
9 . 下列图示装置能达到实验目的的是

A.用装置甲蒸干溶液并灼烧获得纯净的 晶体 晶体 |
| B.用装置乙除去废铁屑表面的油脂 |
C.用装置丙证明 是电解质而 是电解质而 不是电解质 不是电解质 |
| D.用装置丁制备并收集氨气 |
您最近一年使用:0次
名校
解题方法
10 . 亚硫酸钠( )常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
)常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
实验(一)探究 水解的影响因素。
水解的影响因素。
I.配制250 mL 0.1 mol⋅L
 溶液。
溶液。
(1)称取 固体的质量为
固体的质量为______ g。
(2)配制该溶液不需要选择下列仪器中的______ (填标号)。
(3)实验①④_______ (填“能”或“不能”)得出单一变量对实验结果的影响规律。
(4)实验①和②的目的是___________ 。
(5)某同学预测 ,实验测得
,实验测得 ,
,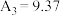 ,理论预测与实际矛盾的原因可能是
,理论预测与实际矛盾的原因可能是_______ (答1条);将实验③的溶液降温至25℃(标记为⑤),测得溶液pH为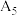 (9.25),小于
(9.25),小于 (9.66),请你猜想可能的原因:
(9.66),请你猜想可能的原因:_______ ,设计实验证明你的猜想:________ ,猜想成立。
实验(二)测定样品纯度。
称取w g 样品溶于水配制成100 mL溶液,准确量取25.00 mL制得的溶液于锥形瓶中,滴加2滴淀粉溶液,用标准c mol⋅L
 溶液滴定至终点,消耗滴定液的体积为V mL。
溶液滴定至终点,消耗滴定液的体积为V mL。
(6)该 样品纯度为
样品纯度为______ %,若滴定前仰视读数,滴定终点俯视读数,则测得的结果______ (填“偏高”“偏低”或“无影响”)。
 )常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
)常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:实验(一)探究
 水解的影响因素。
水解的影响因素。I.配制250 mL 0.1 mol⋅L

 溶液。
溶液。(1)称取
 固体的质量为
固体的质量为(2)配制该溶液不需要选择下列仪器中的
A. B.
B. C.
C.
| 序号 | 0.1 mol⋅L  溶液 /mL 溶液 /mL | 水/mL | 水浴温度/℃ | 测得pH |
| ① | 10.0 | 0 | 25 | 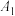 |
| ② | 5.0 | 5 | 25 | 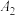 |
| ③ | 10.0 | 0 | 40 |  |
| ④ | 8.0 | 2 | 35 |  |
(3)实验①④
(4)实验①和②的目的是
(5)某同学预测
 ,实验测得
,实验测得 ,
,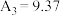 ,理论预测与实际矛盾的原因可能是
,理论预测与实际矛盾的原因可能是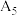 (9.25),小于
(9.25),小于 (9.66),请你猜想可能的原因:
(9.66),请你猜想可能的原因:实验(二)测定样品纯度。
称取w g 样品溶于水配制成100 mL溶液,准确量取25.00 mL制得的溶液于锥形瓶中,滴加2滴淀粉溶液,用标准c mol⋅L

 溶液滴定至终点,消耗滴定液的体积为V mL。
溶液滴定至终点,消耗滴定液的体积为V mL。(6)该
 样品纯度为
样品纯度为
您最近一年使用:0次
2024-02-03更新
|
120次组卷
|
4卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题



