名校
1 . 下列反应的离子方程式正确的是
A.铬酸钾溶液中加入浓盐酸: |
B.泡沫灭火器的反应原理: |
C.热的纯碱去油污: |
D.硫化钠溶液中通入过量二氧化硫: |
您最近一年使用:0次
名校
2 . 下列对生产生活中事实的解释不正确 的是
| 选项 | 事实 | 解释 |
| A | 合成氨选择铁触媒做催化剂 | 铁触媒能提高反应的活化能 |
| B | 用醋酸能除去水垢中的 | 醋酸的酸性强于碳酸 |
| C | 用 净化天然水 净化天然水 |  水解生成 水解生成 胶体,吸附水中悬浮物,加速其沉降 胶体,吸附水中悬浮物,加速其沉降 |
| D | 用 作内服造影剂 作内服造影剂 | 胃液中的 对 对 的沉淀溶解平衡基本没有影响, 的沉淀溶解平衡基本没有影响, 可以保持在安全浓度范围内 可以保持在安全浓度范围内 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-14更新
|
88次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题
名校
解题方法
3 . 硫酸亚硝酰合铁(Ⅱ)在化学分析、金属腐蚀抑制剂、染料工业、医药领域等方面具有重要的应用价值。某兴趣小组利用废铁屑为原料制备硫酸亚硝酰合铁(Ⅱ),并测定其化学式。
Ⅰ.用废铁屑制备 溶液
溶液
(1)将废铁屑放入 溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中
溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中 溶液的作用是
溶液的作用是___________ 。
(2)将处理好的铁屑放入锥形瓶,加入适量的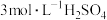 溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。
溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。
①废铁屑中含有的少量氧化铁无需在制备前除去,用离子方程式解释原因___________ 。
②步骤中的过滤采用如下图装置,相对于普通过滤装置而言,其优点是___________ 。
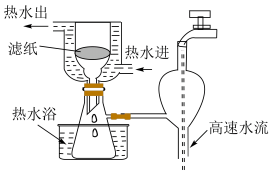
Ⅱ.用NO气体和 溶液制备硫酸亚硝酰合铁(Ⅱ)
溶液制备硫酸亚硝酰合铁(Ⅱ)
装置如图所示(加热及夹持装置略)。
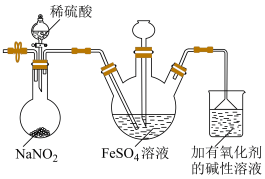
(3)圆底烧瓶中生成NO的同时还生成了 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(4)实验开始前需先鼓入 ,其目的是
,其目的是___________ 。
Ⅲ.测定硫酸亚硝酰合铁(Ⅱ)的化学式,其化学式可表示为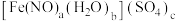 。
。
步骤i.用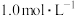 酸性
酸性 溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性
溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性 溶液16.00 mL(NO完全转化为
溶液16.00 mL(NO完全转化为 );
);
步骤ii.另取10.00 mL硫酸亚硝酰合铁(Ⅱ)溶液加入足量 溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。
溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。
(5)已知硫酸亚硝酰合铁(Ⅱ)中 的配位数为6,则化学式中
的配位数为6,则化学式中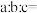
___________ 。
(6)酸性 溶液应盛装在
溶液应盛装在___________ (填“酸”或“碱”)式滴定管中,若滴定前未润洗该滴定管,会导致b的数值___________ (填“偏大”或“偏小”)。
Ⅰ.用废铁屑制备
 溶液
溶液(1)将废铁屑放入
 溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中
溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中 溶液的作用是
溶液的作用是(2)将处理好的铁屑放入锥形瓶,加入适量的
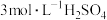 溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。
溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。①废铁屑中含有的少量氧化铁无需在制备前除去,用离子方程式解释原因
②步骤中的过滤采用如下图装置,相对于普通过滤装置而言,其优点是

Ⅱ.用NO气体和
 溶液制备硫酸亚硝酰合铁(Ⅱ)
溶液制备硫酸亚硝酰合铁(Ⅱ)装置如图所示(加热及夹持装置略)。

(3)圆底烧瓶中生成NO的同时还生成了
 ,该反应的离子方程式为
,该反应的离子方程式为(4)实验开始前需先鼓入
 ,其目的是
,其目的是Ⅲ.测定硫酸亚硝酰合铁(Ⅱ)的化学式,其化学式可表示为
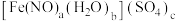 。
。步骤i.用
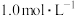 酸性
酸性 溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性
溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性 溶液16.00 mL(NO完全转化为
溶液16.00 mL(NO完全转化为 );
);步骤ii.另取10.00 mL硫酸亚硝酰合铁(Ⅱ)溶液加入足量
 溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。
溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。(5)已知硫酸亚硝酰合铁(Ⅱ)中
 的配位数为6,则化学式中
的配位数为6,则化学式中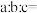
(6)酸性
 溶液应盛装在
溶液应盛装在
您最近一年使用:0次
2023-10-13更新
|
229次组卷
|
5卷引用:新疆石河子第一中学2023-2024学年高三上学期11月月考化学试题
名校
解题方法
4 . 下列有关物质的用途或现象与盐的水解无关的是
A.某雨水样品采集后放置一段时间, 由4.68变为4.28 由4.68变为4.28 |
B.实验室中盛放 溶液的试剂瓶不能用磨口玻璃塞 溶液的试剂瓶不能用磨口玻璃塞 |
C. 与 与 两种溶液可用作泡沬灭火剂 两种溶液可用作泡沬灭火剂 |
D. 与 与 溶液可用作焊接金属时的除锈剂 溶液可用作焊接金属时的除锈剂 |
您最近一年使用:0次
2023-06-28更新
|
125次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
5 . 下列实验操作能达到实验目的的是
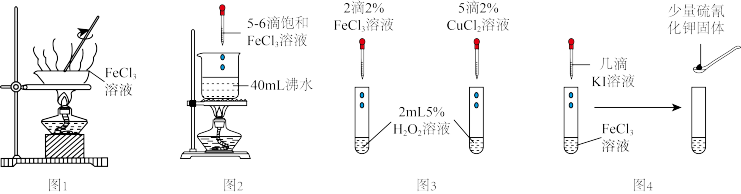

| A.图1:加热蒸干FeCl3溶液制备FeCl3固体 |
| B.图2:制备Fe(OH)3胶体 |
| C.图3:比较Fe3+、Cu2+对H2O2分解的催化效果 |
| D.图4:验证FeCl3与KI的反应是可逆反应 |
您最近一年使用:0次
2022-12-07更新
|
241次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高三上学期第三次月考化学试题
12-13高二上·吉林长春·期末
名校
6 . 为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是
| A.NaOH | B.Na2CO3 | C.NH3•H2O | D.MgCO3 |
您最近一年使用:0次
2022-10-24更新
|
842次组卷
|
92卷引用:新疆维吾尔自治区石河子二中2018-2019学年高二上学期第二次月考化学试题
新疆维吾尔自治区石河子二中2018-2019学年高二上学期第二次月考化学试题(已下线)2011-2012学年吉林省长春外国语学校高二上学期期末考试化学试卷(已下线)2011-2012学年河南省焦作市高二第一学期期末考试化学试卷(已下线)2011-2012学年陕西省西安市远东第一中学高二12月月考化学试卷(已下线)2012年苏教版高中化学选修4 3.3盐类的水解练习卷2014-2015湖南省长沙市望城区高二上学期期末化学理科试卷2015-2016学年贵州省凯里一中高二上学期期末化学试卷2016届河北省冀州中学高三上学期第四次月考化学试卷2015-2016学年吉林省延边三中高二上12月月考化学试卷2015-2016学年甘肃省永昌一中高二上学期期末化学试卷2015-2016学年四川省成都市龙泉一中高二下入学考试化学试卷2015-2016学年福建师大附中高二下期中化学试卷2016-2017学年吉林省长春市第十一高中高二上学期期初考试化学试卷2016-2017学年天津市宝坻区高二11月联考化学试卷2016-2017学年天津市部分区高二上学期期末化学试卷2016-2017学年湖北省鄂东南部分重点中学高二2月联考化学试卷甘肃省兰州第一中学2017-2018学年高二12月月化学试题广东省深圳市罗湖区2017-2018学年高二上学期期末模拟化学试题陕西师范大学附中2017-2018第一学期高二年级化学期中考试化学试题陕西省黄陵中学2017-2018学年高二(普通班)上学期期末考试化学试题江西省景德镇一中2017-2018学年高二上学期期末考化学试题山东省德州市2017-2018学年高二上学期期末考试化学试题山东省泰安市2017-2018学年高二上学期期末考试化学试题云南省昆明市黄冈实验学校2017-2018学年高二下学期第三次月考化学试题内蒙古通辽实验中学2018-2019学年高二上学期第一次月考化学试题宁夏回族自治区吴忠中学2018-2019学年高二上学期期末模拟化学试题山东省泰安第四中学2018-2019学年高二上学期12月月考化学试题【全国百强校】吉林省实验中学2018-2019学年高二上学期期末考试化学试题【区级联考】天津市部分区2018-2019学年高二上学期期末考试化学试题【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高二下学期开学考试化学试题【区级联考】北京市东城区2018-2019学年高二上学期期末检测化学试题云南省峨山彝族自治县第一中学2018-2019学年高二6月月考化学试题北京市朝阳区2018-2019学年高二第二学期期末统一考试化学试题江西省南昌市安义中学2019-2020学年高二上学期期中考试化学试题河北省承德第一中学2019-2020学年高二上学期第三次月考化学试题湖南省长沙市望城区第二中学2019-2020学年高二上学期第二次月考化学试题步步为赢高二化学寒假作业 :作业九 盐类水解的应用新疆乌鲁木齐市第四中学2019-2020学年高二上学期期末考试化学试题甘肃省白银市会宁县第四中学2019-2020学年高二上学期期末期末考试化学试题湖北省荆州中学、宜昌一中两校2019-2020学年高二上学期期末考试化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校2018-2019学年高三上学期末考试化学试题四川省遂宁市第二中学校2017-2018学年高二下学期期中考试化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第三次月考化学试题北京市中央民族大学附属中学2019-2020学年高二下学期期末考试化学试题四川省绵阳市2019-2020学年高二下学期期末教学质量测试化学试题甘肃省兰州市第一中学2019-2020学年高二上学期期末考试化学试题湖北省恩施州清江外国语学校2020-2021学年高二上学期10月月考化学试题(已下线)第三章 水溶液中的离子平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)云南省保山市第九中学2020-2021学年高二上学期第二次月考化学试题北京清华大学附属中学朝阳分校2020-2021学年高二上学期期中考试化学试题四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题吉林省长春市第二实验中学2020-2021学年高二上学期期中考试化学试题(已下线)3.3.2 影响盐类水解的主要因素和盐类水解的应用(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)河南省项城市第三高级中学2020-2021学年高二上学期第三次考试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第四次月考化学试题山西省运城市临猗县临晋中学2020-2021学年高二上学期12月月考化学试题北京市石景山区2020-2021学年高二上学期期末调研化学试题甘肃省庆阳市镇原县第二中学2020-2021学年高二上学期期末考试化学试题青海省西宁市普通高中五校2020-2021学年高二上学期期末联考化学试题黑龙江大庆市东风中学2020-2021学年高二下开学测试化学试题浙江省天台县育才中学2021-2022学年高二上学期第一次月考试卷化学试题人教2019版选择性必修一第三章 水溶液中的离子反应与平衡 复习与提高辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期中考试化学试题内蒙古呼和浩特市2021-2022学年高二上学期期末考试化学试题天津市河北区2021-2022学年高二上学期期末质量检测化学试题四川省绵阳市盐亭中学2021-2022学年高二下学期4月月考化学试题(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省哈尔滨市第六中学2022-2023学年高三8月月考化学试题(已下线)3.3.3 盐类水解的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)黑龙江省伊春市伊美区第二中学2021-2022学年高二下学期开学考试化学试题 吉林省吉林市2022-2023学年高二上学期期中调研测试化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高二上学期期中考试化学试题辽宁省葫芦岛市第八高级中学2021–2022学年高二上学期期中考试化学试题宁夏回族自治区银川市北方民族大学附属中学2020-2021学年高二下学期3月月考化学试题四川省宜宾市南溪区第二中学校2021-2022学年高二上学期12月月考化学试题天津市南开大学附属中学2022-2023学年高二上学期期末考试化学试卷新疆巴音郭楞蒙古自治州第一中学2022-2023学年高二上学期期末考试化学试题湖南省长沙市长郡中学2022-2023学年高二上学期期末考试化学试题福建师范大学附属中学2022-2023学年高二下学期开学考试(期末考)化学试卷广东省惠州市丰湖高级中学2022-2023学年高二上学期期中考试化学试题(已下线)上海市华东师范大学第二附属中学2022-2023学年高二下学期期中考试化学试题(已下线)第13讲 盐类的水解-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)江苏省泰州市兴化市2022-2023学年高二下学期4月期中考试化学试题第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用新疆维吾尔自治区喀什第二中学2022-2023学年高二上学期1月期末考试化学试题贵州省贵阳市清华中学2022-2023学年高二上学期11月月考化学试题北京市清华大学附属中学2023-2024学年高二上学期第三单元化学统练北京市八一学校2023-2024学年高二上学期12月月考化学试题湖南省衡阳市八中2023-2024学年高二上学期第四次月考化学试题河北省石家庄康福外国语学校2023-2024学年高二上学期期中考试化学试题内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高二上学期第三次考试化学试卷内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高二上学期期末考试化学试题
名校
7 . 下列事实与盐类的水解无关的是
A. 溶液可用于腐蚀印刷电路铜板 溶液可用于腐蚀印刷电路铜板 | B. 溶液可用作焊接中的除锈剂 溶液可用作焊接中的除锈剂 |
C. 溶液蒸干后灼烧可得到 溶液蒸干后灼烧可得到 | D.草木灰与铵态氮肥混合后使用肥效降低 |
您最近一年使用:0次
2021-04-26更新
|
134次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题
名校
8 . 化学与生活密切相关。下列说法不正确 的是
| A.高温可杀灭细菌,是由于高温可使蛋白质变性 |
| B.纯碱溶液可去油污,是由于NaHCO3水解使溶液显碱性 |
| C.石灰石可减少煤燃烧的SO2排放,是由于它可将SO2转化为CaSO4 |
| D.维生素C常与补铁剂(有效成分中铁元素为+2价)同服,是由于它具有还原性 |
您最近一年使用:0次
2021-01-23更新
|
379次组卷
|
3卷引用:新疆石河子第一中学2022-2023学年高三10月月考化学试题
9 . 下列做法中没有用到水解平衡原理的是
| A.食盐腌制酸菜 | B.泡沫灭火器灭火 |
| C.明矾净水 | D.热的纯碱去油污 |
您最近一年使用:0次
2021-01-11更新
|
87次组卷
|
2卷引用:新疆生产建设兵团第六师五家渠高级中学2022-2023学年高三2月月考化学试题
名校
10 . 溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地产生碱性的原因:___________ (离子方程式表示)。
(2)把氯化铝溶液蒸干并灼烧固体产物是___________ 。
(3)泡沫灭火器原理(用离子方程式表示)___________
(4)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m___________ (填“>”“<”或“=”)n。
(5)已知水存在如下平衡:H2O+H2O H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向___________ 移动(填“向左”“向右”“不移动”),且所得溶液显___________ 性。
(6)下表所示为部分酸的电离平衡常数:
从H2SO3、CH3COOH中选择合适的物质,以实现HCOONa→HCOOH的转化,写出该反应的离子方程式:___________ 。
(1)盐碱地产生碱性的原因:
(2)把氯化铝溶液蒸干并灼烧固体产物是
(3)泡沫灭火器原理(用离子方程式表示)
(4)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m
(5)已知水存在如下平衡:H2O+H2O
 H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向(6)下表所示为部分酸的电离平衡常数:
| 酸 | H2SO3 | CH3COOH | HCOOH |
| 电离平衡常数 | Ka1=1.2×10-2 Ka2=5.6×10-8 | 1.75×10-5 | 1.8×10-4 |
您最近一年使用:0次



