名校
1 . 化学在生产和日常生活中有着重要的应用,下列说法不正确 的是
A.推广使用燃煤脱硫技术,可以防治 的污染 的污染 |
| B.草木灰溶液呈碱性,不能与铵态氮肥混合施用 |
| C.明矾水解时产生具有吸附性的胶体粒子,可用于水的净化 |
| D.光导纤维、醋酸纤维、硝酸纤维都是以纤维素为原料的化工产品 |
您最近一年使用:0次
名校
2 . 下列说法正确的是
A.将 溶液和 溶液和 溶液分别加热、蒸干、灼烧,所得固体成分相同 溶液分别加热、蒸干、灼烧,所得固体成分相同 |
B.配制 溶液时,将 溶液时,将 固体溶于稀盐酸中,然后稀释至所需浓度 固体溶于稀盐酸中,然后稀释至所需浓度 |
C.用湿润的pH试纸测定 溶液的pH,会使测得结果偏大 溶液的pH,会使测得结果偏大 |
D.将 溶液稀释10倍,溶液中 溶液稀释10倍,溶液中 不变 不变 |
您最近一年使用:0次
2024-05-23更新
|
127次组卷
|
2卷引用:重庆市育才中学校2023-2024学年高二下学期期中考试化学试题
解题方法
3 . 一种从水钴矿(含 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
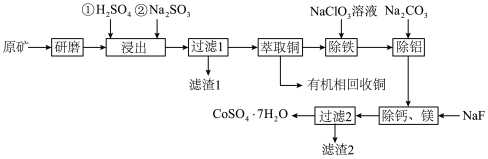
请回答下列问题:
(1)“研磨”的目的是___________ 。
(2)“浸出”时, 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
(3)滤渣1的成分是___________ 。
(4)“除铁”时, 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为___________ ;“除铝”时加入 的目的是
的目的是___________ 。
(5)已知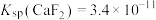 ,
,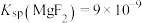 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中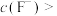
___________  。
。
(6)由“过滤2”后的母液得到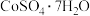 的操作是
的操作是___________ ,___________ 、过滤、洗涤、干燥。
 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是
(2)“浸出”时,
 被浸出的化学方程式为
被浸出的化学方程式为(3)滤渣1的成分是
(4)“除铁”时,
 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为 的目的是
的目的是(5)已知
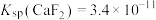 ,
,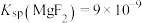 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中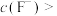
 。
。(6)由“过滤2”后的母液得到
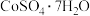 的操作是
的操作是
您最近一年使用:0次
名校
解题方法
4 . 硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。

回答以下问题
(1)为加快酸溶速率,可采取的措施
(2)滤渣1经过处理可作为制备水玻璃(
 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式(3)加入试剂除铁前,滤液1中的阳离子除了
 、
、 外还有的阳离子是
外还有的阳离子是 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理(4)向滤液1中加入的试剂可以是
 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因(5)要从滤液2获取硫酸铝晶体需要经过多步处理,其中从溶液中得到晶体的方法是
(6)某兴趣小组为了测定晶体中
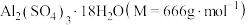 的质量分数,进行如下实验:
的质量分数,进行如下实验:①准确称取1.00g晶体样品,溶于一定量水中;
②滴入 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)则晶体中
以物质的量之比1:1反应,假设杂质不与EDTA反应)则晶体中 的质量分数是
的质量分数是
您最近一年使用:0次
名校
解题方法
5 . 钛被称为继铁、铝之后的第三金属,性能优越,广泛用于航天航空等领域,有人说“21世纪将是钛的世纪”。冶炼金属钛的主要原料为钛铁矿(主要成分FeTiO3,含FeO、Fe2O3等杂质),其冶炼过程如图所示,除了得到金属钛,还可以得到副产物绿矾(FeSO4·7H2O)。
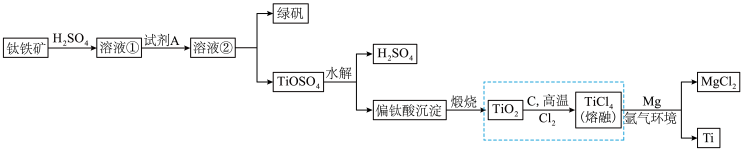
(1)Ti在元素周期表中的位置为___________ , 的键角
的键角___________ H2O分子的键角(填 “>”“<”或“=”)。
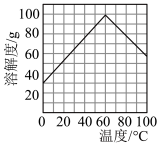
(2)试剂A为___________ 。已知绿矾的溶解度随温度变化的曲线如图所示,从溶液②获得绿矾的操作方法为___________ 、过滤、洗涤、干燥。
(3)已知常温下,Ksp[Fe(OH)2]=8×10-16,若溶液②中c(Fe2+)=0.5mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过___________ (lg2=0.3)。
(4)TiOSO4水解生成偏钛酸(H2TiO3)沉淀的化学方程式为___________ 。
(5)TiCl4的水解程度很大,可以利用其稀溶液制备纳米级TiO2·xH2O,该反应的化学方程式为___________ 。

(1)Ti在元素周期表中的位置为
 的键角
的键角(2)试剂A为

(3)已知常温下,Ksp[Fe(OH)2]=8×10-16,若溶液②中c(Fe2+)=0.5mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过
(4)TiOSO4水解生成偏钛酸(H2TiO3)沉淀的化学方程式为
(5)TiCl4的水解程度很大,可以利用其稀溶液制备纳米级TiO2·xH2O,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
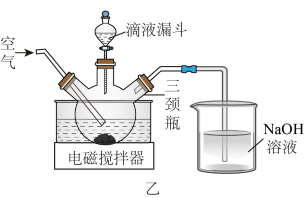
6 . 实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为
,其实验过程可表示为
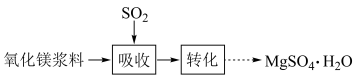
(1)向氧化镁浆料中匀速通入 气体以生成
气体以生成 ,常温下,能提高氧化镁浆料转化效率的措施有
,常温下,能提高氧化镁浆料转化效率的措施有___________ (写出一种即可)
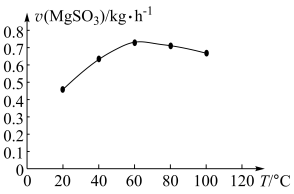
(2)在“转化”步骤中,其他条件相同时,以负载钴的分子篮为催化剂,浆料中 被
被 氧化的速率随温度的变化如图所示。当温度高于
氧化的速率随温度的变化如图所示。当温度高于 ,升温,浆料中
,升温,浆料中 的氧化速率减慢,其主要原因是
的氧化速率减慢,其主要原因是___________ 。
(3)在如图所示的实验装置中制取 :用滴液漏斗向盛有
:用滴液漏斗向盛有 浆料的三颈烧瓶中缓慢滴加硫酸溶液,得到含有少量
浆料的三颈烧瓶中缓慢滴加硫酸溶液,得到含有少量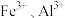 的
的 溶液(此时
溶液(此时 的浓度为
的浓度为 ),再分批加入少量试剂
),再分批加入少量试剂 ,搅拌,调节溶液的
,搅拌,调节溶液的 至合理范围,过滤,将滤液蒸发浓缩、降温至室温结晶,所得晶体在
至合理范围,过滤,将滤液蒸发浓缩、降温至室温结晶,所得晶体在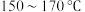 干燥即可得到
干燥即可得到 。
。
注:有关金属离子沉淀完全的 见下表,回答下列问题:
见下表,回答下列问题:
①试剂X可以是:___________ (填化学式,1种即可)
② 的合理范围为
的合理范围为___________ 。
③用化学用语及必要的文字说明解释用试剂X除去杂质的原理:___________
(4)上述流程中的重要一步是生成 的反应:
的反应: ,则该反应的平衡常数
,则该反应的平衡常数 与
与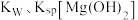 、
、 的代数关系式为
的代数关系式为
___________ 。
 ,其实验过程可表示为
,其实验过程可表示为
(1)向氧化镁浆料中匀速通入
 气体以生成
气体以生成 ,常温下,能提高氧化镁浆料转化效率的措施有
,常温下,能提高氧化镁浆料转化效率的措施有(2)在“转化”步骤中,其他条件相同时,以负载钴的分子篮为催化剂,浆料中
 被
被 氧化的速率随温度的变化如图所示。当温度高于
氧化的速率随温度的变化如图所示。当温度高于 ,升温,浆料中
,升温,浆料中 的氧化速率减慢,其主要原因是
的氧化速率减慢,其主要原因是
(3)在如图所示的实验装置中制取
 :用滴液漏斗向盛有
:用滴液漏斗向盛有 浆料的三颈烧瓶中缓慢滴加硫酸溶液,得到含有少量
浆料的三颈烧瓶中缓慢滴加硫酸溶液,得到含有少量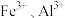 的
的 溶液(此时
溶液(此时 的浓度为
的浓度为 ),再分批加入少量试剂
),再分批加入少量试剂 ,搅拌,调节溶液的
,搅拌,调节溶液的 至合理范围,过滤,将滤液蒸发浓缩、降温至室温结晶,所得晶体在
至合理范围,过滤,将滤液蒸发浓缩、降温至室温结晶,所得晶体在 干燥即可得到
干燥即可得到 。
。
注:有关金属离子沉淀完全的
 见下表,回答下列问题:
见下表,回答下列问题:| 金属离子 |  |  |  |
沉淀完全 的 的 | 3.2 | 4.7 | 11.0 |
②
 的合理范围为
的合理范围为③用化学用语及必要的文字说明解释用试剂X除去杂质的原理:
(4)上述流程中的重要一步是生成
 的反应:
的反应: ,则该反应的平衡常数
,则该反应的平衡常数 与
与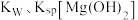 、
、 的代数关系式为
的代数关系式为
您最近一年使用:0次
7 . 氯化铜晶体(CuCl2·2H2O)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗制氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:

已知:氯化亚砜( 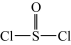 )熔点-101℃,沸点76℃,易水解。回答下列问题:
)熔点-101℃,沸点76℃,易水解。回答下列问题:
(1)为避免引入杂质,试剂x可选用___________ (填字母)
a.KMnO4溶液 b.Cl2水 c.Br2水 d.H2O2溶液
(2)溶液C中加入试剂y可以调节溶液pH,控制pH的取值范围为______~________________ ,从而除去Fe3+而不引入杂质。试剂y可选用下列物质中的___________ (填字母)
a.Cu b.CuO c.Cu2(OH)2CO3 d.NaOH
(3)SOCl2与水反应的化学方程式为___________ 。
(4)SOCl2与CuCl2·2H2O混合并加热,可得到无水CuCl2的原因是__________________ 。

| Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 6.7 |
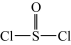 )熔点-101℃,沸点76℃,易水解。回答下列问题:
)熔点-101℃,沸点76℃,易水解。回答下列问题:(1)为避免引入杂质,试剂x可选用
a.KMnO4溶液 b.Cl2水 c.Br2水 d.H2O2溶液
(2)溶液C中加入试剂y可以调节溶液pH,控制pH的取值范围为______~_____
a.Cu b.CuO c.Cu2(OH)2CO3 d.NaOH
(3)SOCl2与水反应的化学方程式为
(4)SOCl2与CuCl2·2H2O混合并加热,可得到无水CuCl2的原因是
您最近一年使用:0次
名校
解题方法
8 . 利用表面含有油脂的废旧的铁屑制备Fe3O4粒子,流程如下:
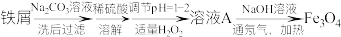
已知: 易与水反应(水解反应),pH=2.7时开始沉淀,pH=3.7沉淀完全。
易与水反应(水解反应),pH=2.7时开始沉淀,pH=3.7沉淀完全。
回答下列问题:
(1)Na2CO3溶液的作用是___________ 。
(2)调节pH为1—2的目的是___________ 。
(3)控制H2O2用量的原因是___________ 。
(4)溶液A中的阳离子是___________ ,检验溶液A中阳离子(除Fe元素外形成的阳离子)的具体操作是___________ 。
(5)溶液A到Fe3O4的离子方程式是___________ 。
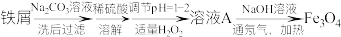
已知:
 易与水反应(水解反应),pH=2.7时开始沉淀,pH=3.7沉淀完全。
易与水反应(水解反应),pH=2.7时开始沉淀,pH=3.7沉淀完全。回答下列问题:
(1)Na2CO3溶液的作用是
(2)调节pH为1—2的目的是
(3)控制H2O2用量的原因是
(4)溶液A中的阳离子是
(5)溶液A到Fe3O4的离子方程式是
您最近一年使用:0次
名校
解题方法
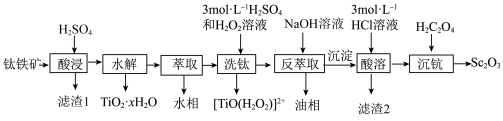
9 . 氧化钪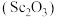 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为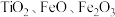 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至 时可认为沉淀完全。
时可认为沉淀完全。
②室温下 完全沉淀的
完全沉淀的 为1.05。
为1.05。
③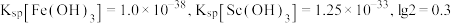 。
。
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是_______ 。
(2) 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式_______ 。
(3)萃取剂萃取 的反应原理为阳离子交换:
的反应原理为阳离子交换: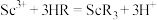 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是_______ 。
(4)“酸溶”后滤液中存在的金属阳离子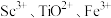 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是_______ 。
(5)由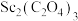 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式_______ 。
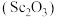 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为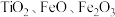 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至
 时可认为沉淀完全。
时可认为沉淀完全。②室温下
 完全沉淀的
完全沉淀的 为1.05。
为1.05。③
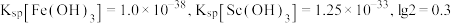 。
。回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是(2)
 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式(3)萃取剂萃取
 的反应原理为阳离子交换:
的反应原理为阳离子交换: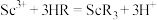 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是(4)“酸溶”后滤液中存在的金属阳离子
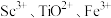 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是(5)由
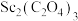 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式
您最近一年使用:0次
2023-12-19更新
|
301次组卷
|
2卷引用:湖南省雅礼教育集团2023-2024学年高二上学期期中考试化学试题
10 . 水溶液中的离子平衡在生产生活中有广泛的应用,下列说法正确的是
| A.蒸干氯化镁溶液并灼烧可得到干燥的氯化镁固体 |
| B.用氯化铵溶液除去铁器表面的铁锈是利用了电离生成的氢离子 |
C.向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察到溶液颜色变浅,证明 溶液,观察到溶液颜色变浅,证明 溶液中存在水解平衡 溶液中存在水解平衡 |
D. 的盐酸和 的盐酸和 的碳酸钠溶液中,二者由水电离出的氢离子浓度一定相同 的碳酸钠溶液中,二者由水电离出的氢离子浓度一定相同 |
您最近一年使用:0次



