解题方法
1 . 研究发现,在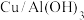 催化剂上使用等离子体催化能将
催化剂上使用等离子体催化能将 和
和 直接转化为
直接转化为 和
和 。某小组以硫酸烧渣(主要成分为
。某小组以硫酸烧渣(主要成分为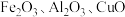 和
和 等)制备
等)制备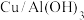 催化剂的流程如图所示:
催化剂的流程如图所示:
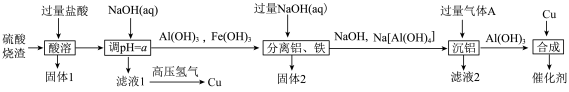
几种金属离子沉淀的pH如表所示:
回答下列问题:
(1)灼烧固体2得到的主要成分是___________ (填化学式)。气体A是_________ (填名称)。
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度,其原因是____________________ 。a的范围为____________________ 。
(3)滤液1中通入高压氢制备铜的离子方程式为_______________________ 。
(4)滤液2的pH__________________ (填“>”“<”或“=”)7。
(5)该催化剂能将 和
和 转化成
转化成 、
、 ,这四种分子中能与水分子形成氢键的有
,这四种分子中能与水分子形成氢键的有______________________ (填化学式)。
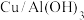 催化剂上使用等离子体催化能将
催化剂上使用等离子体催化能将 和
和 直接转化为
直接转化为 和
和 。某小组以硫酸烧渣(主要成分为
。某小组以硫酸烧渣(主要成分为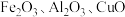 和
和 等)制备
等)制备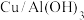 催化剂的流程如图所示:
催化剂的流程如图所示:
几种金属离子沉淀的pH如表所示:
| 金属离子 |  |  |  |
| 开始沉淀pH | 1.9 | 3.4 | 7.4 |
| 完全沉淀pH | 3.7 | 4.7 | 9.6 |
(1)灼烧固体2得到的主要成分是
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度,其原因是
(3)滤液1中通入高压氢制备铜的离子方程式为
(4)滤液2的pH
(5)该催化剂能将
 和
和 转化成
转化成 、
、 ,这四种分子中能与水分子形成氢键的有
,这四种分子中能与水分子形成氢键的有
您最近一年使用:0次
名校
2 . 下列实验操作规范且能达到目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 配制FeCl3溶液 | 将氯化铁固体溶解在较浓的盐酸中再加水稀释 |
| B | 取20.00mL盐酸 | 在50mL酸式滴定管中装入盐酸,调整初始读数30.00mL后,将剩余盐酸放入锥形瓶中 |
| C | 测定醋酸钠溶液的pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
| D | 除去MgCl2溶液中的Fe3+ | 可在加热搅拌的条件下加入NaOH溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-28更新
|
41次组卷
|
2卷引用:江西省新余市第一中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
3 . 室温下,下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将1mL0.1mol/L 溶液滴入5mL 0.1mol/L NaOH溶液有沉淀产生,再滴加0.1mol/L 溶液滴入5mL 0.1mol/L NaOH溶液有沉淀产生,再滴加0.1mol/L 溶液 溶液 | 先有白色沉淀生成,后变为浅蓝色沉淀 | 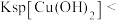 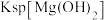 |
| B | 向浓度均为0.1mol/L的 和 和 混合溶液中滴加0.1mol/L 混合溶液中滴加0.1mol/L 溶液 溶液 | 先出现黄色沉淀 |  还原性强于 还原性强于 |
| C | 室温时,在pH试纸上滴2~3滴 溶液 溶液 | 测得, |  溶液中 溶液中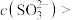  |
| D | 用pH计测量相同浓度NaClO溶液和 溶液的pH值 溶液的pH值 | NaClO溶液的pH值大于 溶液 溶液 |  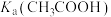 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-29更新
|
439次组卷
|
2卷引用:江西省上饶市第一中学2023-2024学年高二下学期开学考试化学试题
名校
4 . 实验室利用 和亚硫酰氯(SOCl2)制备无水
和亚硫酰氯(SOCl2)制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为
沸点为 ,遇水极易反应生成两种酸性气体。回答下列问题:
,遇水极易反应生成两种酸性气体。回答下列问题:

(1)装置c的名称是___________ ,装置b内发生反应的化学方程式为___________ 。
(2)下列说法正确的是___________。
(3)能由上述装置将下列结晶水合物制备得到相应的无水盐的是___________ (填字母)。
A. B.
B. C.
C.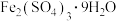
(4)现有含少量杂质的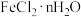 ,为测定n值进行如下实验:
,为测定n值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,用
样品,用足量稀硫酸溶解后,用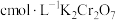 标准溶液滴定
标准溶液滴定 达终点时消耗
达终点时消耗 (滴定过程中
(滴定过程中 转化为Cr3+,Cl-不反应)。
转化为Cr3+,Cl-不反应)。
实验Ⅱ:另取 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为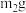 。
。
①上述滴定滴定过程中,下列操作正确的是___________ (填字母)。
A.滴定前,锥形瓶和滴定管均须用标准溶液润洗
B.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
C.滴定时,常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.滴定时,眼睛应注视滴定管内液面高度变化
②下列情况会导致n测量值偏小的是___________ (填字母)。
A.若样品中含少量 杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成
杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成
C.样品与 反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解
反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解
③若样品中所含的少量杂质不参与反应,则
___________ (用含 、c、V的表达式表示)
、c、V的表达式表示)
 和亚硫酰氯(SOCl2)制备无水
和亚硫酰氯(SOCl2)制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为
沸点为 ,遇水极易反应生成两种酸性气体。回答下列问题:
,遇水极易反应生成两种酸性气体。回答下列问题:
(1)装置c的名称是
(2)下列说法正确的是___________。
A.实验开始先通 一段时间后,应先加热装置a,再加热装置b 一段时间后,应先加热装置a,再加热装置b |
| B.两处洗气瓶e中均可装入浓硫酸 |
C.装置c、d,共同起到的作用冷凝回流 |
| D.装置f既可吸收尾气,又可防止倒吸,烧杯中可加入水 |
(3)能由上述装置将下列结晶水合物制备得到相应的无水盐的是
A.
 B.
B. C.
C.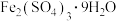
(4)现有含少量杂质的
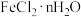 ,为测定n值进行如下实验:
,为测定n值进行如下实验:实验Ⅰ:称取
 样品,用足量稀硫酸溶解后,用
样品,用足量稀硫酸溶解后,用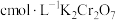 标准溶液滴定
标准溶液滴定 达终点时消耗
达终点时消耗 (滴定过程中
(滴定过程中 转化为Cr3+,Cl-不反应)。
转化为Cr3+,Cl-不反应)。实验Ⅱ:另取
 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为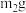 。
。①上述滴定滴定过程中,下列操作正确的是
A.滴定前,锥形瓶和滴定管均须用标准溶液润洗
B.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
C.滴定时,常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.滴定时,眼睛应注视滴定管内液面高度变化
②下列情况会导致n测量值偏小的是
A.若样品中含少量
 杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成
杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成C.样品与
 反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解
反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解③若样品中所含的少量杂质不参与反应,则

 、c、V的表达式表示)
、c、V的表达式表示)
您最近一年使用:0次
2023-12-23更新
|
123次组卷
|
2卷引用:江西省宜春市丰城中学东校区(九中)2023-2024学年高二下学期开学考试化学试卷
解题方法
5 . 下列劳动生产中涉及的化学原理,关联正确的是
| 选项 | 劳动项目 | 化学原理 |
| A | 使用明矾净水 | 明矾可以杀菌消毒 |
| B | 用石膏改良盐碱地 | 石膏是一种酸性物质 |
| C | 葡萄酒中通入少量 |  具有漂白性 具有漂白性 |
| D | 用Na2CO3除油污 |  溶液具有碱性 溶液具有碱性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 无水碘化锂 广泛应用于有机合成,也是构成电池电解液的核心物质。某小组利用水合肼(
广泛应用于有机合成,也是构成电池电解液的核心物质。某小组利用水合肼( ,
, 是非电解质,沸点为113.5℃,具有强还原性)还原法制备
是非电解质,沸点为113.5℃,具有强还原性)还原法制备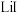 。回答下列问题:
。回答下列问题:
(1)水合肼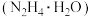 的制备,装置(夹持和加热仪器已省略)如图所示:
的制备,装置(夹持和加热仪器已省略)如图所示:

①仪器A的名称为_____ ,冷凝水从_____ (填“a”或“b”)通入。
②写出装置A中制备水合肼反应的离子方程式:_____ (除了生成水合肼外,还有 和
和 生成)。
生成)。
③分液漏斗滴液速率不宜过快或过多,其原因是_____ 。
④上述得到的水合肼粗品含有较多水,若进一步提纯水合肼,其操作为_____ 。
(2)三水碘化锂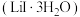 的制备:将水合肼缓慢加入含有
的制备:将水合肼缓慢加入含有 和
和 的混合液中,搅拌,反应完全后,过滤浓缩反应后的混合液,可得到三水碘化锂。制备过程中发生两个反应:
的混合液中,搅拌,反应完全后,过滤浓缩反应后的混合液,可得到三水碘化锂。制备过程中发生两个反应: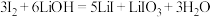 ,水合肼将
,水合肼将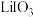 还原为
还原为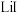 ,同时生成无毒气体单质,写出
,同时生成无毒气体单质,写出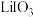 与水合肼反应的化学方程式:
与水合肼反应的化学方程式:_____ 。
(3)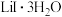 脱水制备
脱水制备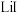 ,有如下三种方法。与方法三相比,方法一、二的缺点是
,有如下三种方法。与方法三相比,方法一、二的缺点是_____ (任写出两条)。
方法一:将三水碘化锂放在碘化氢气氛中干燥,同时在熔融盐上方通入干燥氢气吸收生成的碘;
方法二:将三水碘化锂溶于有机溶剂中,在催化还原电极和金属锂电极作用下进行电化学电解,除去有机溶剂得到无水碘化锂;
方法三:将三水碘化锂和有机溶剂按一定质量比混合均匀得到碘化锂有机溶剂混合液,将混合液进行蒸馏共沸脱水得到无水碘化锂。
 广泛应用于有机合成,也是构成电池电解液的核心物质。某小组利用水合肼(
广泛应用于有机合成,也是构成电池电解液的核心物质。某小组利用水合肼( ,
, 是非电解质,沸点为113.5℃,具有强还原性)还原法制备
是非电解质,沸点为113.5℃,具有强还原性)还原法制备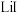 。回答下列问题:
。回答下列问题:(1)水合肼
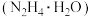 的制备,装置(夹持和加热仪器已省略)如图所示:
的制备,装置(夹持和加热仪器已省略)如图所示:
①仪器A的名称为
②写出装置A中制备水合肼反应的离子方程式:
 和
和 生成)。
生成)。③分液漏斗滴液速率不宜过快或过多,其原因是
④上述得到的水合肼粗品含有较多水,若进一步提纯水合肼,其操作为
(2)三水碘化锂
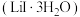 的制备:将水合肼缓慢加入含有
的制备:将水合肼缓慢加入含有 和
和 的混合液中,搅拌,反应完全后,过滤浓缩反应后的混合液,可得到三水碘化锂。制备过程中发生两个反应:
的混合液中,搅拌,反应完全后,过滤浓缩反应后的混合液,可得到三水碘化锂。制备过程中发生两个反应: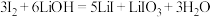 ,水合肼将
,水合肼将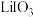 还原为
还原为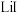 ,同时生成无毒气体单质,写出
,同时生成无毒气体单质,写出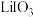 与水合肼反应的化学方程式:
与水合肼反应的化学方程式:(3)
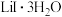 脱水制备
脱水制备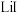 ,有如下三种方法。与方法三相比,方法一、二的缺点是
,有如下三种方法。与方法三相比,方法一、二的缺点是方法一:将三水碘化锂放在碘化氢气氛中干燥,同时在熔融盐上方通入干燥氢气吸收生成的碘;
方法二:将三水碘化锂溶于有机溶剂中,在催化还原电极和金属锂电极作用下进行电化学电解,除去有机溶剂得到无水碘化锂;
方法三:将三水碘化锂和有机溶剂按一定质量比混合均匀得到碘化锂有机溶剂混合液,将混合液进行蒸馏共沸脱水得到无水碘化锂。
您最近一年使用:0次
2023-09-01更新
|
104次组卷
|
2卷引用:江西省南昌市等5地2022-2023学年高三上学期开学考试化学试题
7 . 下列应用中涉及到氧化还原反应的是
| A.使用明矾对水进行净化 | B.雪天道路上撒盐融雪 |
| C.暖贴中的铁粉遇空气放热 | D.荧光指示牌被照发光 |
您最近一年使用:0次
2023-06-12更新
|
13991次组卷
|
28卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期开学考试化学试题
江西省宜春市宜丰中学2023-2024学年高二上学期开学考试化学试题浙江省名校协作体2023-2024学年高二上学期开学适应性考试化学试题天津市宁河区芦台第一中学2023-2024学年高三上学期开学学情诊断化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高一下学期开学摸底考试化学试卷2023年高考全国乙卷化学真题(已下线)T7-氧化还原反应(已下线)2023年高考化学真题完全解读(全国乙卷)(PPT+Word)(已下线)专题09 氧化还原反应(已下线)专题09 氧化还原反应(已下线)专题09 氧化还原反应(已下线)第3讲 氧化还原反应(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)黑龙江省大庆市东风中学2023-2024学年高三上学期适应性考试化学试题(已下线)实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)黑龙江省哈尔滨市第三十二中学校2023-2024学年高三上学期9月月考化学试题天津市南开中学2023-2024学年高三上学期第一次月考化学试题天津市南开中学2023-2024学年高三上学期第一次月检测化学试题吉林省长春市第二中学2023-2024学年高三上学期10月月考化学试题(已下线)题型04 氧化还原反应-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖南省长沙市雨花区2023-2024学年高一上学期期末质量监测化学试题河北省遵化市第一中学2023-2024学年高二上学期月考2化学试题吉林省通化市梅河口市博文学校2022-2023学年高二下学期期末考试化学试题 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试化学模拟卷(二)安徽省蚌埠市固镇县汉兴学校、怀远县禹泽学校2023-2024学年高一上学期12月期末联考化学试题(已下线)第04讲 氧化还原反应的基本概念和规律(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
8 . 氯化亚铜(CuCl)是白色粉末,微溶于水,广泛应用于化工和印染等行业。某研究性学习小组模拟热分解CuCl2•2H2O制备CuCl的过程,并进行相关物质转化的探究。
已知:酸性条件下Cu+不稳定

下列说法不正确的是
已知:酸性条件下Cu+不稳定

下列说法不正确的是
| A.X气体是HCl,可抑制CuCl2•2H2O加热时水解 |
| B.途径1中产生的Cl2可以回收利用,也可以通入饱和NaOH溶液中除去 |
C.途径2中200℃时反应的化学方程式为Cu2(OH)2Cl2 2CuO+2HCl↑ 2CuO+2HCl↑ |
D.CuCl与稀硫酸反应的离子方程式为2Cu++4H++SO =2Cu2++SO2↑+2H2O =2Cu2++SO2↑+2H2O |
您最近一年使用:0次
2023-04-12更新
|
1054次组卷
|
7卷引用:江西省丰城中学2023-2024学年高三上学期开学考试化学试题
江西省丰城中学2023-2024学年高三上学期开学考试化学试题北京市顺义区2023届高三下学期第二次化学统练题(已下线)专题10 物质的反应及转化(已下线)第07练 元素及其化合物基础知识和应用 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题河南省中原名校联盟2024届高三上学期9月调研考试化学试题陕西省西安市长安区第一中学2023-2024学年高三上学期第三次教学质量检测(期中)化学试题
9 . 以硫酸厂矿渣(含 ,
, ,
, 等)为原料制备铁黄(
等)为原料制备铁黄( )的一种工艺流程如图所示:
)的一种工艺流程如图所示:

资料:ⅰ. 化学性质极不活泼,不溶于水也不溶于酸或碱。
化学性质极不活泼,不溶于水也不溶于酸或碱。
ⅱ.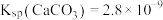 ;
;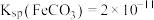 。
。
回答下列问题:
(1)“还原”过程中的离子方程式为_______ 。
(2)“滤渣”中主要成分为(填化学式)_______ 。
(3)①“沉铁”过程中有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为_______ 。
②“沉铁”过程中往往有副产物 生成,分析原因是
生成,分析原因是_______ 。
③若用 “沉铁”,则无副产物
“沉铁”,则无副产物 产生,当反应完成时,溶液中
产生,当反应完成时,溶液中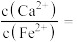
_______ 。
(4)写出氧化过程生成铁黄的化学方程式为_______ 。
(5)工业上为了充分利用铁资源,硫酸厂矿渣也可以用来炼铁,在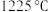 、
、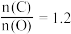 时,焙烧时间与金属产率的关系如下图:
时,焙烧时间与金属产率的关系如下图:

请分析焙烧时间超过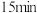 时,金属产率下降的原因可能是
时,金属产率下降的原因可能是_______ 。
 ,
, ,
, 等)为原料制备铁黄(
等)为原料制备铁黄( )的一种工艺流程如图所示:
)的一种工艺流程如图所示:
资料:ⅰ.
 化学性质极不活泼,不溶于水也不溶于酸或碱。
化学性质极不活泼,不溶于水也不溶于酸或碱。ⅱ.
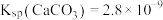 ;
;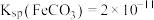 。
。回答下列问题:
(1)“还原”过程中的离子方程式为
(2)“滤渣”中主要成分为(填化学式)
(3)①“沉铁”过程中有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为②“沉铁”过程中往往有副产物
 生成,分析原因是
生成,分析原因是③若用
 “沉铁”,则无副产物
“沉铁”,则无副产物 产生,当反应完成时,溶液中
产生,当反应完成时,溶液中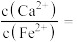
(4)写出氧化过程生成铁黄的化学方程式为
(5)工业上为了充分利用铁资源,硫酸厂矿渣也可以用来炼铁,在
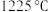 、
、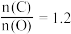 时,焙烧时间与金属产率的关系如下图:
时,焙烧时间与金属产率的关系如下图:
请分析焙烧时间超过
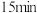 时,金属产率下降的原因可能是
时,金属产率下降的原因可能是
您最近一年使用:0次
名校
10 . 化学与生产、生活息息相关。下列说法错误的是
| A.热的纯碱溶液可用于清洗厨房油污 |
| B.霓红灯的发光机制与氢原子光谱形成的机制基本相同 |
C.误服 或 或 后可用 后可用 溶液解毒 溶液解毒 |
D. 可以用于天然水的消毒、净化 可以用于天然水的消毒、净化 |
您最近一年使用:0次



