解题方法
1 . 肉桂酸钠(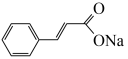 )是一种食品防腐剂,也是一种化妆品成分。某小组探究肉桂酸钠的性质。
)是一种食品防腐剂,也是一种化妆品成分。某小组探究肉桂酸钠的性质。
| 序号 | 操作 | 现象 |
 | 取适量肉桂酸钠溶于水中,滴加酚酞溶液 | 溶液变红色 |
 | 向酸性 溶液中滴加肉桂酸钠溶液,振荡 溶液中滴加肉桂酸钠溶液,振荡 | 溶液褪色 |
 | 向溴水中滴加肉桂酸钠溶液,振荡 | 溶液褪色 |
 可证明肉桂酸是
可证明肉桂酸是(2)由实验
 可知,肉桂酸钠具有
可知,肉桂酸钠具有 中发生反应的类型是
中发生反应的类型是实验(二):探究肉桂酸钠的水解(肉桂酸钠用NaR表示)。
(3)用肉桂酸钠固体配制
 溶液。
溶液。①下列仪器中,配制上述溶液不需要的是

(4)为了探究外界条件对NaR水解的影响,该小组设计如表所示实验:
| 序号 |  溶液/mL 溶液/mL | 蒸馏水/mL | 温度/℃ | 测定pH |
 | 10.0 | 0 | 25 | 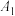 |
 | 5.0 | 5.0 | 25 | 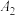 |
 | 10.0 | 0 | 45 |  |
 、
、 的目的是
的目的是②已知NaR水解为吸热反应,甲同学预测:
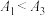 ,实验结果:
,实验结果: ,二者矛盾的主要原因是
,二者矛盾的主要原因是(5)该小组通过测定不同温度下NaR的水解常数
 ,确定温度对NaR水解程度的影响。
,确定温度对NaR水解程度的影响。【查阅资料】
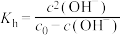 ,
, 为NaR溶液起始浓度。
为NaR溶液起始浓度。试剂和仪器:0.10 mol·L-1NaR溶液、0.100 0 mol·L-1盐酸、甲基橙溶液、pH计。
【设计实验】测定45℃下NaR的水解常数
 ,补充下表中实验。
,补充下表中实验。| 序号 | 实验 | 记录的数据 |
 | 取20.00mLNaR溶液,滴几滴甲基橙溶液,用 盐酸滴定至终点 盐酸滴定至终点 | 盐酸体积为 |
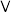 | 测定45℃纯水的pH |  |
 |  |
【实验处理】
45℃下,

【实验结论】Kh(65℃)>Kh(55℃)>Kh(45℃),升高温度,NaR水解程度增大。
您最近一年使用:0次
名校
解题方法
2 . 某研究性学习小组设计下列实验探究Zn和FeCl3溶液的反应,回答下列问题:
(1)由FeCl3固体配制未酸化的250mL0.5mol·L-1FeCl3溶液(pH=1.3),不需要使用的实验仪器有___________ (从下列图中选择,写出名称)。

(2)将Zn投入到未酸化的0.5mol·L-1FeCl3溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
①实验中产生的气体为___________ ,实验ii中产生气体的速率明显快于实验i,可能的原因是___________ (答出两点)。
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在Fe2+。生成Fe2+的离子方程式为___________ 。
(3)实验i和ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则Fe3+、H+、Zn2+、Fe2+的氧化性大小关系为___________ 。
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
对比实验iii和iv,实验iv中“气泡不明显,红褐色褪色明显”的原因可能为___________ 。
③结合实验探究过程及现象分析,影响Zn与FeCl3溶液反应的条件有___________ (答两点即可的)。
(1)由FeCl3固体配制未酸化的250mL0.5mol·L-1FeCl3溶液(pH=1.3),不需要使用的实验仪器有

(2)将Zn投入到未酸化的0.5mol·L-1FeCl3溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
| 实验编号 | 条件 | 现象 |
| i | 锌粒18℃ | 刚开始无明显气泡,0.5min后有气体产生,一段时间后,溶液颜色加深。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
| ii | 锌粒65℃ | 产生气泡较快,大约12 s后,气泡非常明显,溶液很快转为红棕色。较长时间后发现红棕色基本消失,最后产生红棕色沉淀 |
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在Fe2+。生成Fe2+的离子方程式为
(3)实验i和ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则Fe3+、H+、Zn2+、Fe2+的氧化性大小关系为
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
| 实验编号 | 条件 | 现象 |
| iii | 锌粉18℃ 不振荡 | 大约3min可以看到明显的气泡,溶液颜色逐渐变深。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
| iv | 锌粉65℃ 振荡 | 气泡不明显,红褐色褪色明显。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
③结合实验探究过程及现象分析,影响Zn与FeCl3溶液反应的条件有
您最近一年使用:0次
2022-01-19更新
|
1223次组卷
|
5卷引用:福建省漳州市2022届高三毕业班第一次质量检测化学试题
福建省漳州市2022届高三毕业班第一次质量检测化学试题(已下线)一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题福建省永安第九中学2022-2023学年高三上学期期中考试化学试题(已下线)专题六 金属元素及其化合物-实战高考·二轮复习核心突破
解题方法
3 . 资料显示,水溶液中 与
与 发生互促水解生成蓝色沉淀
发生互促水解生成蓝色沉淀 。某小组同学设计实验探究水溶液中
。某小组同学设计实验探究水溶液中 与
与 反应的产物。
反应的产物。
实验记录如下:将 溶液逐滴加入盐酸酸化的
溶液逐滴加入盐酸酸化的 溶液中,溶液蓝色变浅,有白色沉淀生成。
溶液中,溶液蓝色变浅,有白色沉淀生成。
(1) 溶液用盐酸酸化的目的是
溶液用盐酸酸化的目的是___________ 。
(2)查阅资料得知,该白色沉淀是 。写出产生
。写出产生 的离子方程式:
的离子方程式:___________ 。
(3)甲同学认为:要证明 氧化了
氧化了 ,可检验溶液中含有
,可检验溶液中含有 。操作为:取少量上层清液于试管中,
。操作为:取少量上层清液于试管中,___________ (将操作和现象补充完整)。
(4)乙同学认为:溶液中存在 不一定是
不一定是 氧化的,体系中存在的
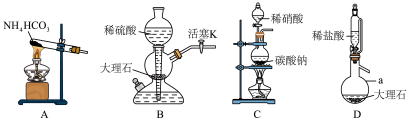
氧化的,体系中存在的 会干扰实验,于是设计了如下4个装置排除体系中的
会干扰实验,于是设计了如下4个装置排除体系中的 。其中合理的是
。其中合理的是___________ (填字母),仪器a的名称是___________ 。
(5)丙同学认为: 的还原性大
的还原性大 ,也可与盐酸酸化的
,也可与盐酸酸化的 溶液反应生成
溶液反应生成 沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:
沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:___________ 。
(6)称取沉淀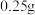 与过量氯化铁溶液反应,待样品完全溶解后,加水
与过量氯化铁溶液反应,待样品完全溶解后,加水 、邻菲啰啉溶液2滴,用
、邻菲啰啉溶液2滴,用 硫酸铈
硫酸铈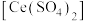 标准溶液滴定,滴定终点时消耗标准溶液
标准溶液滴定,滴定终点时消耗标准溶液 (已知:
(已知:
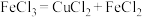 ,
, )。邻菲啰啉溶液的作用是
)。邻菲啰啉溶液的作用是___________ ,沉淀中 的质量分数为
的质量分数为___________ 。
 与
与 发生互促水解生成蓝色沉淀
发生互促水解生成蓝色沉淀 。某小组同学设计实验探究水溶液中
。某小组同学设计实验探究水溶液中 与
与 反应的产物。
反应的产物。实验记录如下:将
 溶液逐滴加入盐酸酸化的
溶液逐滴加入盐酸酸化的 溶液中,溶液蓝色变浅,有白色沉淀生成。
溶液中,溶液蓝色变浅,有白色沉淀生成。(1)
 溶液用盐酸酸化的目的是
溶液用盐酸酸化的目的是(2)查阅资料得知,该白色沉淀是
 。写出产生
。写出产生 的离子方程式:
的离子方程式:(3)甲同学认为:要证明
 氧化了
氧化了 ,可检验溶液中含有
,可检验溶液中含有 。操作为:取少量上层清液于试管中,
。操作为:取少量上层清液于试管中,(4)乙同学认为:溶液中存在
 不一定是
不一定是 氧化的,体系中存在的
氧化的,体系中存在的 会干扰实验,于是设计了如下4个装置排除体系中的
会干扰实验,于是设计了如下4个装置排除体系中的 。其中合理的是
。其中合理的是
(5)丙同学认为:
 的还原性大
的还原性大 ,也可与盐酸酸化的
,也可与盐酸酸化的 溶液反应生成
溶液反应生成 沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:
沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:(6)称取沉淀
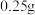 与过量氯化铁溶液反应,待样品完全溶解后,加水
与过量氯化铁溶液反应,待样品完全溶解后,加水 、邻菲啰啉溶液2滴,用
、邻菲啰啉溶液2滴,用 硫酸铈
硫酸铈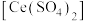 标准溶液滴定,滴定终点时消耗标准溶液
标准溶液滴定,滴定终点时消耗标准溶液 (已知:
(已知:
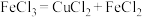 ,
, )。邻菲啰啉溶液的作用是
)。邻菲啰啉溶液的作用是 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
4 . I.配制100mL0.05mol·L-1Fe2(SO4)3溶液。
(1)该实验需要用到的玻璃仪器有:烧杯、量筒、玻璃棒、___________ 、___________ 。
(2)为了防止Fe2(SO4)3水解,在配置过程中可以加入少量___________ 。
Ⅱ.探究Fe2(SO4)3与Cu的反应。
原理预测:
(3)请写出Fe2(SO4)3与Cu的反应的离子方程式:___________ 。
开展实验并观察现象:
某实验小组在进行Fe2(SO4)3与Cu的反应时观察到了异常现象,决定对其进行进一步的探究。
实验I:
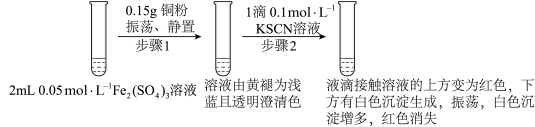
提出问题:
(4)实验前,小组同学预测步骤2后溶液不会变为红色,原因是___________ 。
查阅文献:i.CuSCN为难溶于水的白色固体;
ii.SCN-被称为拟卤素离子,性质与卤素离子相似。
提出猜想:经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能。
猜测1:Cu2+与KSCN发生了氧化还原反应。
猜测2:亚铁离子将其还原 ,
,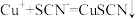 。
。
(5)猜测1的离子方程式为___________ 。
设计实验:
得出结论:
(6)实验Ⅱ中试管___________ (填字母)中的现象可以证实猜测1不成立。
(7)Fe3+的氧化性本应强于Cu2+,结合实验Ⅲ中的现象解释 能正向发生的原因:
能正向发生的原因:___________ 。
(1)该实验需要用到的玻璃仪器有:烧杯、量筒、玻璃棒、
(2)为了防止Fe2(SO4)3水解,在配置过程中可以加入少量
Ⅱ.探究Fe2(SO4)3与Cu的反应。
原理预测:
(3)请写出Fe2(SO4)3与Cu的反应的离子方程式:
开展实验并观察现象:
某实验小组在进行Fe2(SO4)3与Cu的反应时观察到了异常现象,决定对其进行进一步的探究。
实验I:

提出问题:
(4)实验前,小组同学预测步骤2后溶液不会变为红色,原因是
查阅文献:i.CuSCN为难溶于水的白色固体;
ii.SCN-被称为拟卤素离子,性质与卤素离子相似。
提出猜想:经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能。
猜测1:Cu2+与KSCN发生了氧化还原反应。
猜测2:亚铁离子将其还原
 ,
,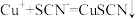 。
。(5)猜测1的离子方程式为
设计实验:
| 实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
| Ⅱ | A试管 2 mL 0.1 mol/LFeSO4溶液 | 加入1mL0.4mol·L-1KSCN溶液 | 开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管 |
| B试管 2mL0.1mol/LCuSO4溶液 | 加入1mL0.4mol·L-1KSCN溶液 | 溶液变成绿色 | |
| Ⅲ | C试管 2mL0.1mol/LFeSO4溶液 | 加入2mL0.1mol·L-1CuSO4溶液 | 溶液变为淡蓝色 |
| 再加1mL0.4mol·L-1KSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色 |
(6)实验Ⅱ中试管
(7)Fe3+的氧化性本应强于Cu2+,结合实验Ⅲ中的现象解释
 能正向发生的原因:
能正向发生的原因:
您最近一年使用:0次
2023-11-01更新
|
964次组卷
|
4卷引用:广东省湛江市2024届高三上学期毕业班调研考试化学试题
5 . 某学习小组对“ 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:
(1)如图所示将浸泡过 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。 溶液的操作为先加
溶液的操作为先加____________ 溶解 ,再稀释至所需浓度。
,再稀释至所需浓度。
②用化学方程式解释粉笔表面出现红褐色的原因:________________ 。
③溶液变铁锈色是因为生成了______________ (填化学式)。
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料: 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。
提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为________________ ,未呈现黑色。
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是_______________ 。
限选试剂:黑色粉末样品、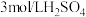 溶液、
溶液、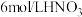 溶液、
溶液、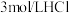 溶液、
溶液、 酸性
酸性 溶液、
溶液、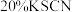 溶液、蒸馏水。
溶液、蒸馏水。
(4)由以上实验测得黑色粉末中铁元素的质量分数为_______________ (已知实验条件下所得 固体中
固体中 与
与 个数比为
个数比为 )。
)。
 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:(1)如图所示将浸泡过
 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。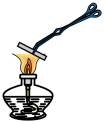
 溶液的操作为先加
溶液的操作为先加 ,再稀释至所需浓度。
,再稀释至所需浓度。②用化学方程式解释粉笔表面出现红褐色的原因:
③溶液变铁锈色是因为生成了
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料:
 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热
 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
限选试剂:黑色粉末样品、
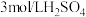 溶液、
溶液、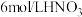 溶液、
溶液、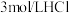 溶液、
溶液、 酸性
酸性 溶液、
溶液、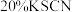 溶液、蒸馏水。
溶液、蒸馏水。实验序号 | 实验操作 | 实验现象 | 实验结论 |
| 3 | 取黑色粉末靠近磁铁 | 黑色粉末几乎全被磁铁吸引,未被吸收的黑色粉末经检验不含铁元素 | 黑色粉末不是 |
| 4 | 向盛有 黑色粉末的试管中加入① 黑色粉末的试管中加入① | 固体全部溶解且无气泡产生 | ② |
| 5 | 将实验4的溶液分为四等份,用 酸性 酸性 溶液滴定至终点,重复三次平均消耗 溶液滴定至终点,重复三次平均消耗 溶液 溶液 | 滴定终点现象是 ③ | 黑色粉末是 |
| 6 | 取实验5中剩余一等份溶液于洁净试管中,加入④ | ⑤ |
(4)由以上实验测得黑色粉末中铁元素的质量分数为
 固体中
固体中 与
与 个数比为
个数比为 )。
)。
您最近一年使用:0次
2024-05-24更新
|
96次组卷
|
2卷引用:2024届浙江省高三下学期5月份大联考化学试题
解题方法
6 . 我国科学家发现某化合物(如图所示)可用于制造大功率固体激光器,填补国家空白。已知X、Y、Z、W为前20号元素且位于不同周期,原子序数依次递增,Y为地壳中含量最多的元素。下列有关说法正确的是


A.原子半径: |
| B.该化合物易溶于水且水溶液显碱性 |
| C.Z的最高价氧化物对应的水化物为强酸 |
D.单质的氧化性: ,单质的还原性: ,单质的还原性: |
您最近一年使用:0次
7 . 某兴趣小组用Fe3+与I-间的反应探究氧化还原反应规律与平衡移动原理的取系,回答下列问题:
(1)用Fe2(SO4)3晶体配制100mL0.05mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓硫酸中,再用水稀释,加入硫酸的目的是_______ (结合化学用语回答)。
(2)甲组同学将0.10mol/L的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液各5mL混合充分反应后,溶液变为棕黄色,现进行如下实验①②。
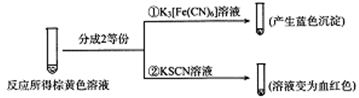
实验①中产生蓝色沉淀的离子方程式为_________ ,根据以上反应现象写出甲组同学实验中的离子方程式_________ ,在甲组同学的反应中,I2和Fe3+的氧化性强弱顺序为_________ 。
查阅资料:其它条件相同时,物质的氧化性及还原性强弱随浓度大小发生变化。
(3)乙组同学以下图实验装置进一步探究上述反应,
K闭合时,指针发生偏转,盐桥中的阳离子向______ 极(填“a”或“b”)定向移动;当指针归零时,向烧杯I中满加0.01mol/L AgNO3溶液,指针反向偏转,表明平衡发生了移动。据此分析I-还原性强弱与浓度关系______________ 。
(4)丙组同学欲测定甲组同学所得棕黄色溶液中c(I2),已知I2+2Na2S2O3=2NaI+Na2S4O6。现借助酸碱中和滴定相关仪器,用cmol·L-1的Na2S2O3溶液在弱碱性环境下对该溶液进行滴定,消耗Na2S2O3溶液VmL。
①Na2S2O3溶液装入______ (填“酸式”或“碱式”)滴定管,选用淀粉溶液为指示剂,滴定终点现象为_______________ 。
②老师提出丙组同学方案不可行,原因一是Fe3+可能氧化Na2S2O3,二是_________ 。
(1)用Fe2(SO4)3晶体配制100mL0.05mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓硫酸中,再用水稀释,加入硫酸的目的是
(2)甲组同学将0.10mol/L的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液各5mL混合充分反应后,溶液变为棕黄色,现进行如下实验①②。

实验①中产生蓝色沉淀的离子方程式为
查阅资料:其它条件相同时,物质的氧化性及还原性强弱随浓度大小发生变化。
(3)乙组同学以下图实验装置进一步探究上述反应,
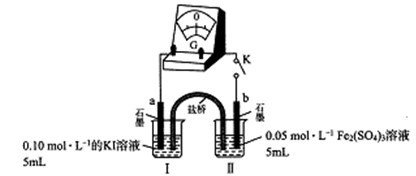
K闭合时,指针发生偏转,盐桥中的阳离子向
(4)丙组同学欲测定甲组同学所得棕黄色溶液中c(I2),已知I2+2Na2S2O3=2NaI+Na2S4O6。现借助酸碱中和滴定相关仪器,用cmol·L-1的Na2S2O3溶液在弱碱性环境下对该溶液进行滴定,消耗Na2S2O3溶液VmL。
①Na2S2O3溶液装入
②老师提出丙组同学方案不可行,原因一是Fe3+可能氧化Na2S2O3,二是
您最近一年使用:0次
2017-05-20更新
|
538次组卷
|
2卷引用:四川省教育联盟2017届高三毕业班第三次诊断性考试理综化学试题
8 . 久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。回答下列问题:
(1)写出Fe2+水解的离子方程式______ ;要抑制FeSO4水解,可以采取的措施是______ 。
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2⇌4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是______ 。
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响______ 。
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是______ 。
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200mol•L-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=______ mol•L-1。

(1)写出Fe2+水解的离子方程式
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2⇌4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200mol•L-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=
您最近一年使用:0次
9 . 劳动最光荣。下列化学知识正确,且能解释所对应的劳动项目的是
| 选项 | 化学知识 | 劳动项目 |
| A | 乙醇具有强氧化性可以使细菌蛋白质变性 | 医疗服务:用75%的酒精溶液消毒 |
| B | 碳酸钠水解,溶液呈碱性 | 家务劳动:纯碱去油污 |
| C | 铝的化学性质很不活泼,所以耐腐蚀 | 工业生产:将铝制成饮料罐 |
| D | 石膏具有酸性 | 农业劳动:撒石膏改良碱性土壤(含碳酸钠) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 劳动创造幸福未来。下列劳动项目与所述的化学知识关联不合理的是
| 选项 | 劳动项目 | 化学知识 |
| A | 社会实践:向公共场所喷洒过氧乙酸消毒剂 | 过氧乙酸有强氧化性,能使蛋白质变性 |
| B | 社区服务:演示用泡沫灭火器灭火 | 盐酸与小苏打反应产生大量二氧化碳 |
| C | 自主探究:锌、铜和柠檬为原料制作水果电池 | 锌能与柠檬中酸性物质发生氧化还原反应 |
| D | 家务劳动:饭后用热的纯碱溶液洗涤餐具 | 油脂在碱性条件下发生水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-05更新
|
462次组卷
|
3卷引用:陕西省渭南市2023届高三第一次教学质量检测(一模)化学试题



