1 . 矾是一类含硫化合物,在生活和生产中有着重要应用。
(1)蓝矾(CuSO4•5H2O)属于的物质类别有___ (填序号)。
a.混合物 b.电解质 c.氧化物 d.离子化合物
(2)绿矾(FeSO4•7H2O)溶于水后水溶液显__ 性,绿矾水溶液在空气中久置出现红褐色沉淀,写出相关的离子方程式___ ,绿矾水溶液保存时防止变质可加入试剂为___ (填化学式)。
(3)黄矾[FexSyO9•zH2O]中Fe、S的化合价分别为+3、+6。y=2时,x=__ ,采用热重分析法测定该黄矾样品所含结晶水数,将样品加热到110℃时,只失掉2个结晶水,失重7.2%,黄矾的化学式为___ 。
(1)蓝矾(CuSO4•5H2O)属于的物质类别有
a.混合物 b.电解质 c.氧化物 d.离子化合物
(2)绿矾(FeSO4•7H2O)溶于水后水溶液显
(3)黄矾[FexSyO9•zH2O]中Fe、S的化合价分别为+3、+6。y=2时,x=
您最近一年使用:0次
名校
2 . 下列有关实验说法,正确的是
| A.某溶液加强碱并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液溶质为铵盐 |
| B.将硝酸亚铁样品溶于稀硫酸,滴加硫氰化钾溶液,溶液变为血红色,可推知该样品已经氧化变质 |
| C.往含有FeBr2和FeI2的混合溶液中通入足量的氯气,然后把溶液蒸干,得到FeCl3固体 |
| D.向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅,证明Na2CO3溶液中存在水解平衡 |
您最近一年使用:0次
2020-07-12更新
|
160次组卷
|
2卷引用:浙江省温州市平阳县2020届高三高考适应性考试(6月)化学试题
名校
解题方法
3 . 下列实验中,现象及结论都正确,且二者之间有因果的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生 | Na2SO3已变质 |
| B | 将AlCl3溶液加热蒸干 | 得到白色固体 | 成分为纯净的AlCl3 |
| C | 蘸有浓氨水的玻璃棒靠近X | 有白烟产生 | X一定是浓盐酸 |
| D | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-06-18更新
|
180次组卷
|
2卷引用:云南省红河州2020届高三第三次复习统一检测理科综合化学试题
4 . 下列实验操作及现象,能推出相应结论的是
| 选项 | 实验操作及现象 | 结论 |
| A | 常温下,用pH计测得0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH,前者大 | 酸性:CH3COOH>HClO |
| B | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热,未见有银镜产生 | 淀粉没有水解 |
| C | 向MgCl2溶液中滴加足量NaOH溶液,有白色沉淀生成;再滴加CuCl2溶液,有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| D | 向Fe(NO3)2样品,溶于稀硫酸,滴加KSCN溶液,溶液变红 | Fe(NO3)2样品溶于稀硫酸前已氧化变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-03-15更新
|
403次组卷
|
3卷引用:山东省济宁市2018届高三第一次模拟考试理综化学试题
未知-未知
|
较易(0.85)
|
名校
5 . 下列实验操作所得的现象及结论均正确的是
| 选项 | 实验操作 | 现象及结论 |
| A | 将AlCl3溶液加热蒸干 | 得到白色固体,成分为纯净的AlCl3 |
| B | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生,则Na2SO3已变质 |
| C | 用量筒量取一定体积的浓硫酸时,仰视读数 | 所量取的浓硫酸体积偏大 |
| D | 向FeI2溶液中通入少量Cl2 | 溶液变黄,则Cl2的氧化性强于Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023·上海·模拟预测
6 . 过氧化氢和盐酸的混合溶液可以刻蚀含铜的电路板。
(1)请写出用过氧化氢和盐酸刻蚀电路板时发生的离子反应方程式:_______ 。当反应一段时间后,随着溶液变蓝,气泡产生的速率加快,其可能的原因是_______ 。
含铜电路板也可以用 进行刻蚀,对刻蚀后的液体(
进行刻蚀,对刻蚀后的液体( 、
、 和
和 )进行处理以提取和
)进行处理以提取和 ,流程如下图所示:
,流程如下图所示:
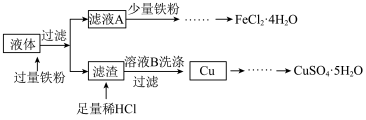
(2)从滤液A中提取 的操作为:加入Fe粉后,应先浓缩滤液至出现
的操作为:加入Fe粉后,应先浓缩滤液至出现_______ ,趁热过滤,取溶液,_______ ,过滤、洗涤、干燥。
(3)检验溶液B中提取出的Cu上粘附的 已经洗净的操作为:
已经洗净的操作为:_______ ,制备 时,将铜溶解于
时,将铜溶解于 、
、 的混酸中,此过程中产生的红棕色气体为
的混酸中,此过程中产生的红棕色气体为_______ 产物(选填“氧化”或“还原”)。
利用滴定法可测定所得 的纯度,操作如下:
的纯度,操作如下:
①取a g 样品,加入足量
样品,加入足量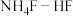 溶液溶解(其中用于防止
溶液溶解(其中用于防止 干扰检验:
干扰检验: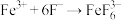 )
)
②滴加足量KI溶液,发生反应
③再用c mol·L
 标准溶液滴定,以淀粉溶液作指示剂,到达滴定终点时消耗硫代硫酸钠标准液V mL,发生的反应为:
标准溶液滴定,以淀粉溶液作指示剂,到达滴定终点时消耗硫代硫酸钠标准液V mL,发生的反应为: ,
,
(4)已知 溶液呈酸性,则水解程度
溶液呈酸性,则水解程度
_______  (填“>”、“<”或“=”),稀释后溶液中,
(填“>”、“<”或“=”),稀释后溶液中, 的值
的值_______ (选填“增大”、“减小”或“不变”)。
(5)接近滴定终点时,向溶液中滴加KSCN溶液,会发现CuI沉淀转化为CuSCN,其沉淀转化的原因是_______ 。已知CuI能够吸附大量 ,若不加KSCN,则测得
,若不加KSCN,则测得 的纯度
的纯度_______ (选填“偏高”、“偏低”或“不变”)。
(6)计算 的纯度:
的纯度:_______ (用a、c、V的代数式表示)。
(1)请写出用过氧化氢和盐酸刻蚀电路板时发生的离子反应方程式:
含铜电路板也可以用
 进行刻蚀,对刻蚀后的液体(
进行刻蚀,对刻蚀后的液体( 、
、 和
和 )进行处理以提取和
)进行处理以提取和 ,流程如下图所示:
,流程如下图所示:
(2)从滤液A中提取
 的操作为:加入Fe粉后,应先浓缩滤液至出现
的操作为:加入Fe粉后,应先浓缩滤液至出现(3)检验溶液B中提取出的Cu上粘附的
 已经洗净的操作为:
已经洗净的操作为: 时,将铜溶解于
时,将铜溶解于 、
、 的混酸中,此过程中产生的红棕色气体为
的混酸中,此过程中产生的红棕色气体为利用滴定法可测定所得
 的纯度,操作如下:
的纯度,操作如下:①取a g
 样品,加入足量
样品,加入足量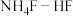 溶液溶解(其中用于防止
溶液溶解(其中用于防止 干扰检验:
干扰检验: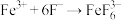 )
)②滴加足量KI溶液,发生反应

③再用c mol·L

 标准溶液滴定,以淀粉溶液作指示剂,到达滴定终点时消耗硫代硫酸钠标准液V mL,发生的反应为:
标准溶液滴定,以淀粉溶液作指示剂,到达滴定终点时消耗硫代硫酸钠标准液V mL,发生的反应为: ,
, (4)已知
 溶液呈酸性,则水解程度
溶液呈酸性,则水解程度
 (填“>”、“<”或“=”),稀释后溶液中,
(填“>”、“<”或“=”),稀释后溶液中, 的值
的值(5)接近滴定终点时,向溶液中滴加KSCN溶液,会发现CuI沉淀转化为CuSCN,其沉淀转化的原因是
 ,若不加KSCN,则测得
,若不加KSCN,则测得 的纯度
的纯度(6)计算
 的纯度:
的纯度:
您最近一年使用:0次
解题方法
7 . 磁性Fe3O4纳米粒子(粒径1-100nm)因其独特的物理、化学性质广泛用于生物医学和功能材料等领域而受到研究者的关注。实验室通过共沉淀法制备磁性Fe3O4纳米粒子的方法如下:
I.称取5.0gFeCl2·4H2O和2.7gFeCl3·6HO加入烧杯中,加入40mL蒸馏水,充分溶解。
Ⅱ.将I所得的混合液保持30℃恒温,向混合液中加入0.4mol·L-1的NaOH溶液并不断搅拌,溶液中逐渐出现黑色物质,直至溶液pH=11,再加入5mL乙醇,将混合液在50℃恒温的条件下晶化2h。
Ⅲ.从晶化后的混合液中分离出纳米粒子,用少量蒸馏水反复洗涤直至洗涤液的pH=7,再用乙醇洗涤后,在60℃真空中干燥2h得到磁性Fe3O4纳米粒子。
回答下列问题:
(1)将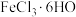 固体溶于蒸馏水时常会出现的现象为
固体溶于蒸馏水时常会出现的现象为___________ 。
(2)制备时NaOH溶液的浓度不宜过大,其原因为___________ ,实验Ⅱ过程中控制反应温度为50℃的操作方法为___________ 。
(3)生成磁性Fe3O4纳米粒子的离子方程式为___________ 。在制备过程中实际上加入的试剂中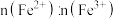 约为2.5:1,其原因为
约为2.5:1,其原因为___________ 。
(4)实验Ⅲ中除了通过测定洗涤液的pH=7外,实验室还可以判断纳米粒子已经洗涤干净的操作方法为___________ 。
(5)产物中混杂的 会降低纳米粒子的磁性,为了测定产品中
会降低纳米粒子的磁性,为了测定产品中 的含量,采取如下实验方法:准确称取
的含量,采取如下实验方法:准确称取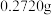 产品于锥形瓶中,用稀硝酸充分浸取,再加热使过量的硝酸全部逸出,冷却后加入足量
产品于锥形瓶中,用稀硝酸充分浸取,再加热使过量的硝酸全部逸出,冷却后加入足量 溶液充分混合反应后,用
溶液充分混合反应后,用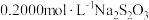 标准溶液滴定至溶液颜色明显变浅,加入几滴淀粉溶液,继续滴定至终点,消耗
标准溶液滴定至溶液颜色明显变浅,加入几滴淀粉溶液,继续滴定至终点,消耗 标准溶液的体积为
标准溶液的体积为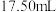 ,已知滴定过程中发生反应的离子方程式为
,已知滴定过程中发生反应的离子方程式为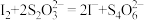 。
。
① 标准溶液应盛放在
标准溶液应盛放在____________ 填“酸式”或“碱式”)滴定管。
②若过量的硝酸没有全部逸出,则会导致测定结果___________ (填“偏高”“偏低”或“不变”)。
③所取样品中 的质量为
的质量为___________ g(结果保留4位小数)。
I.称取5.0gFeCl2·4H2O和2.7gFeCl3·6HO加入烧杯中,加入40mL蒸馏水,充分溶解。
Ⅱ.将I所得的混合液保持30℃恒温,向混合液中加入0.4mol·L-1的NaOH溶液并不断搅拌,溶液中逐渐出现黑色物质,直至溶液pH=11,再加入5mL乙醇,将混合液在50℃恒温的条件下晶化2h。
Ⅲ.从晶化后的混合液中分离出纳米粒子,用少量蒸馏水反复洗涤直至洗涤液的pH=7,再用乙醇洗涤后,在60℃真空中干燥2h得到磁性Fe3O4纳米粒子。
回答下列问题:
(1)将
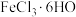 固体溶于蒸馏水时常会出现的现象为
固体溶于蒸馏水时常会出现的现象为(2)制备时NaOH溶液的浓度不宜过大,其原因为
(3)生成磁性Fe3O4纳米粒子的离子方程式为
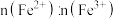 约为2.5:1,其原因为
约为2.5:1,其原因为(4)实验Ⅲ中除了通过测定洗涤液的pH=7外,实验室还可以判断纳米粒子已经洗涤干净的操作方法为
(5)产物中混杂的
 会降低纳米粒子的磁性,为了测定产品中
会降低纳米粒子的磁性,为了测定产品中 的含量,采取如下实验方法:准确称取
的含量,采取如下实验方法:准确称取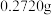 产品于锥形瓶中,用稀硝酸充分浸取,再加热使过量的硝酸全部逸出,冷却后加入足量
产品于锥形瓶中,用稀硝酸充分浸取,再加热使过量的硝酸全部逸出,冷却后加入足量 溶液充分混合反应后,用
溶液充分混合反应后,用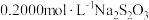 标准溶液滴定至溶液颜色明显变浅,加入几滴淀粉溶液,继续滴定至终点,消耗
标准溶液滴定至溶液颜色明显变浅,加入几滴淀粉溶液,继续滴定至终点,消耗 标准溶液的体积为
标准溶液的体积为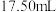 ,已知滴定过程中发生反应的离子方程式为
,已知滴定过程中发生反应的离子方程式为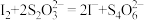 。
。①
 标准溶液应盛放在
标准溶液应盛放在②若过量的硝酸没有全部逸出,则会导致测定结果
③所取样品中
 的质量为
的质量为
您最近一年使用:0次
解题方法
8 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 测定硫酸铜晶体中结晶水的含量 | 加热盛有硫酸铜晶体的坩埚,待固体全部呈白色后将坩埚放置在铁架台上冷却,再称重 |
| B | 检验Fe(NO3)2中是否混有Fe(NO3)3 | 取样品于试管中,滴加稀硫酸溶解,再滴加几滴KSCN溶液 |
| C | 验证石蜡油分解的产物不仅是烷烃 | 将热分解的气体产物通入溴的四氯化碳溶液 |
| D | 制备无水氯化铝 | 在硬质玻璃管中灼烧AlCl3·6H2O,同时通入干燥空气气流保护 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-20更新
|
638次组卷
|
2卷引用:四川省乐山市2023届高三下学期第三次调查研究考试理科综合化学试题
名校
解题方法
9 . 钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如图:

已知:①还原性:Cl->Co2+;
②Fe3+和C2O 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的____ 。
(2)滤渣的主要成分为____ (填化学式)。
(3)从含铝废液得到Al(OH)3的离子方程式为____ 。
(4)滤液A中的溶质除HCl、LiCl外还有____ (填化学式)。写出LiCoO2和盐酸反应的化学方程式____ 。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见表,请补充完整表中问题。已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为____ mol·L-1。
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是____ 。

已知:①还原性:Cl->Co2+;
②Fe3+和C2O
 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:(1)废旧电池初步处理为粉末状的目的
(2)滤渣的主要成分为
(3)从含铝废液得到Al(OH)3的离子方程式为
(4)滤液A中的溶质除HCl、LiCl外还有
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见表,请补充完整表中问题。已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
| 序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
| I | 120~220 | CoC2O4·2H2O=CoC2O4+2H2O | 19.67% |
| II | 300~350 | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是
您最近一年使用:0次
2022-05-30更新
|
256次组卷
|
2卷引用:陕西省西安中学2022届高三下学期五月全仿真模拟考试(一)理综化学试题
解题方法
10 . 无水 是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水
是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水 的实验装置如图所示:
的实验装置如图所示:

E和G用来收集产物。回答下列问题:
(1)通入氯气后,A中观察到有酸雾产生,C中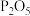 的作用是
的作用是_______ 。
(2)在E、G处收集产物是利用了
_______ 的性质。
(3)实验过程中若F处出现堵塞,则在B处可观察到的现象是_______ 。可通过_______ (填简单操作),使实验能继续进行。
(4)Ⅰ中反应的离子方程式为_______ 。
(5)某同学用 干燥铁粉制得无水
干燥铁粉制得无水 样品
样品 ,该次实验的产率是
,该次实验的产率是_______ 。
(6)实验室中还常用 与
与 晶体共热制备无水
晶体共热制备无水 ,其化学反应方程式为
,其化学反应方程式为_______ .检验水合三氯化铁原料中是否存在 的试剂是
的试剂是_______ 。
 是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水
是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水 的实验装置如图所示:
的实验装置如图所示:
E和G用来收集产物。回答下列问题:
(1)通入氯气后,A中观察到有酸雾产生,C中
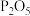 的作用是
的作用是(2)在E、G处收集产物是利用了

(3)实验过程中若F处出现堵塞,则在B处可观察到的现象是
(4)Ⅰ中反应的离子方程式为
(5)某同学用
 干燥铁粉制得无水
干燥铁粉制得无水 样品
样品 ,该次实验的产率是
,该次实验的产率是(6)实验室中还常用
 与
与 晶体共热制备无水
晶体共热制备无水 ,其化学反应方程式为
,其化学反应方程式为 的试剂是
的试剂是
您最近一年使用:0次



