1 . 某湿法炼锌的萃余液中含有 、
、 、
、 、
、 、
、 、
、 及
及 等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:
等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:

已知:
(1)常温下,测得某种萃余液中硫酸的浓度为 ,则此溶液中
,则此溶液中
___________  。
。
(2)在酸性条件下,加入 氧化时,
氧化时, 转化为
转化为 除去,生成
除去,生成 反应的离子方程式为
反应的离子方程式为___________ 。
(3)常温下,中和时,先调节 约为1,加入适量的
约为1,加入适量的 氧化,再调节
氧化,再调节 为4.0,“沉渣”的主要成分除
为4.0,“沉渣”的主要成分除 外还有
外还有___________ ;若加入过量 ,钴元素将会进入“沉渣”中,则水解后的溶液中
,钴元素将会进入“沉渣”中,则水解后的溶液中 约为
约为___________  。
。
(4)“沉锌”时,在近中性条件下加入 可得碱式碳酸锌[
可得碱式碳酸锌[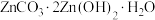 ]固体,同时产生大量气体,产生大量气体的原因是
]固体,同时产生大量气体,产生大量气体的原因是___________ 。
(5)不同质量分数的 溶液在不同温度下析出
溶液在不同温度下析出 晶体的物种如图所示。欲从含
晶体的物种如图所示。欲从含
 及微量杂质的“沉锌后液”中直接析出无水
及微量杂质的“沉锌后液”中直接析出无水 ,“操作a”为
,“操作a”为___________ 。

 、
、 、
、 、
、 、
、 、
、 及
及 等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:
等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:
已知:
| 沉淀物 |  |  |  |  |  |
 | 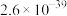 |  | 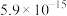 |  | 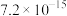 |
(1)常温下,测得某种萃余液中硫酸的浓度为
 ,则此溶液中
,则此溶液中
 。
。(2)在酸性条件下,加入
 氧化时,
氧化时, 转化为
转化为 除去,生成
除去,生成 反应的离子方程式为
反应的离子方程式为(3)常温下,中和时,先调节
 约为1,加入适量的
约为1,加入适量的 氧化,再调节
氧化,再调节 为4.0,“沉渣”的主要成分除
为4.0,“沉渣”的主要成分除 外还有
外还有 ,钴元素将会进入“沉渣”中,则水解后的溶液中
,钴元素将会进入“沉渣”中,则水解后的溶液中 约为
约为 。
。(4)“沉锌”时,在近中性条件下加入
 可得碱式碳酸锌[
可得碱式碳酸锌[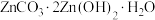 ]固体,同时产生大量气体,产生大量气体的原因是
]固体,同时产生大量气体,产生大量气体的原因是(5)不同质量分数的
 溶液在不同温度下析出
溶液在不同温度下析出 晶体的物种如图所示。欲从含
晶体的物种如图所示。欲从含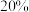
 及微量杂质的“沉锌后液”中直接析出无水
及微量杂质的“沉锌后液”中直接析出无水 ,“操作a”为
,“操作a”为
您最近一年使用:0次
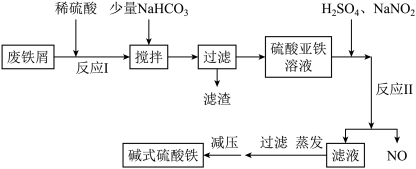
2 . 碱式硫酸铁[ ]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
部分正离子以氢氧化物形式沉淀时溶液的pH如表所示:
请回答下列问题:
(1)加入少量NaHCO3的目的是将溶液的pH条件至___________ 范围,以除去 ,可能发生的离子方程式为
,可能发生的离子方程式为___________ 。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作___________ 。若参与反应的O2有11.2L(标准状况),则相当于节约了___________ molNaNO2。
(3)碱式硫酸铁溶于水后产生的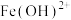 可部分水解生成
可部分水解生成 ,该水解反应的离子方程式为
,该水解反应的离子方程式为___________ 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有 及
及 。为检验所得的产品中是否含有
。为检验所得的产品中是否含有 ,应当先用稀硫酸溶解样品。请简述后续的检验方法:
,应当先用稀硫酸溶解样品。请简述后续的检验方法:___________ 。
 ]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
部分正离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 |  |  |  |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是将溶液的pH条件至
 ,可能发生的离子方程式为
,可能发生的离子方程式为(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作
(3)碱式硫酸铁溶于水后产生的
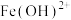 可部分水解生成
可部分水解生成 ,该水解反应的离子方程式为
,该水解反应的离子方程式为(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有
 及
及 。为检验所得的产品中是否含有
。为检验所得的产品中是否含有 ,应当先用稀硫酸溶解样品。请简述后续的检验方法:
,应当先用稀硫酸溶解样品。请简述后续的检验方法:
您最近一年使用:0次
3 . 碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
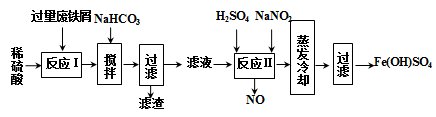
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
完成下列填空:
(1)反应I后的溶液中存在的主要阳离子有___________ 。
(2)加入少量NaHCO3的目的是将溶液的pH调节在___________ 范围内,该工艺中“搅拌”的作用是___________ 。
(3)在实验室,“过滤”操作中用到的硅酸盐仪器是___________ 。
(4)反应II加入NaNO2的目的是___________ ,反应的离子方程式为___________ 。
(5)该流程中“蒸发”要采用减压蒸发,相对于常压蒸发,减压蒸发的优点是______ ,溶液的pH也不能过大或过小,原因是___________ 。
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为___________(选填序号)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为___________(选填序号)。

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应I后的溶液中存在的主要阳离子有
(2)加入少量NaHCO3的目的是将溶液的pH调节在
(3)在实验室,“过滤”操作中用到的硅酸盐仪器是
(4)反应II加入NaNO2的目的是
(5)该流程中“蒸发”要采用减压蒸发,相对于常压蒸发,减压蒸发的优点是
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO
 。为检验所得产品中是否含有Fe2+,应使用的试剂为___________(选填序号)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为___________(选填序号)。| A.氯水 | B.KSCN溶液 | C.NaOH溶液 | D.酸性KMnO4溶液 |
您最近一年使用:0次
2021-11-09更新
|
367次组卷
|
2卷引用:山东省济宁邹城市2021-2022学年高三上学期期中考试化学试题
名校
解题方法
4 . 铋是一种稀有金属,铋及其化合物在工业生产中用途广泛,如氯氧化铋常用于电子设备、汽车装饰材料、塑料助剂及生产干电池阴极。以下是一种用铋精矿(主要成分是Bi2S3还含有FeS2、 Cu2S、PbO2及不溶性杂质)制备 BiOCl的一种方法,其流程如图:

已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
(1)铋精矿在浸取时会先进行粉碎,目的是___________ 。
(2)加压氧化氨浸过程中,已知 CuS2发生如下反应: ,
, 生成
生成 ,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式
,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式___________ 。
(3)操作Ⅰ为:___________ 。
(4)根据流程分析,盐酸羟胺在反应中起到什么作用:___________ 。
(5)流程中生成 BiOCl 的离子方程式:___________ 。
(6)滤液 3 中含有的金属阳离子有:___________ 。

已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
(1)铋精矿在浸取时会先进行粉碎,目的是
(2)加压氧化氨浸过程中,已知 CuS2发生如下反应:
 ,
, 生成
生成 ,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式
,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式(3)操作Ⅰ为:
(4)根据流程分析,盐酸羟胺在反应中起到什么作用:
(5)流程中生成 BiOCl 的离子方程式:
(6)滤液 3 中含有的金属阳离子有:
您最近一年使用:0次
2021-03-03更新
|
642次组卷
|
4卷引用:河南省范县第一中学2021-2022学年高二上学期期中检测化学试题
河南省范县第一中学2021-2022学年高二上学期期中检测化学试题广东省珠海市2021届高三第一次学业质量监测化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)2022届重庆市缙云教育联盟高三第〇次诊断性检测化学试题
13-14高三·浙江嘉兴·阶段练习
解题方法
5 . 某溶液可能含有Clˉ、SO 、CO
、CO 、NH
、NH 、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:

由此可知原溶液中
 、CO
、CO 、NH
、NH 、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
由此可知原溶液中
| A.原溶液中c(Fe3+)=0.2 mol·L-1 |
| B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1 |
C.SO 、NH 、NH 、Na+一定存在,CO 、Na+一定存在,CO 、Al3+一定不存在 、Al3+一定不存在 |
| D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
您最近一年使用:0次
2019-01-30更新
|
962次组卷
|
4卷引用:2015届四川省成都九中高三上学期期中考试化学试卷
2015届四川省成都九中高三上学期期中考试化学试卷(已下线)2014届浙江省嘉兴市高三教学测试(一)理综化学试卷【校级联考】浙江省温州市新力量联盟2018-2019学年高二上学期期末考试化学试题(已下线)专题06 离子共存、检验和推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
解题方法
6 . 五种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:_________ ;
(2)写出步骤②中发生反应的离子方程式_______________ 。
(3)D溶液中滴入石蕊试液,现象是__________________ ,原因是_____________________ (用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是________ mL。
| 阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
| 阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:
(2)写出步骤②中发生反应的离子方程式
(3)D溶液中滴入石蕊试液,现象是
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是
您最近一年使用:0次
2016-12-09更新
|
449次组卷
|
6卷引用:2017届河北省衡水中学高三上期中化学卷



