解题方法
1 .  在生产和生活中用途广泛。
在生产和生活中用途广泛。
Ⅰ. 溶液的配制及浓度的标定
溶液的配制及浓度的标定
(1) 溶液的配制
溶液的配制
①配制100mL一定浓度的 溶液需用到的仪器有
溶液需用到的仪器有___________ (填字母)。 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为___________ 。
(2) 溶液浓度的标定
溶液浓度的标定
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用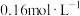
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ. 与
与 反应的探究
反应的探究
(3)预测现象1:向 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为___________ (用离子方程式表示)。
预测现象2:向 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。
(4)实验验证:小组同学设计以下实验探究溶液中 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
①请补充表格中的数据:a=___________ 。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是___________ 。
③实验ⅵ和ⅶ的实验现象说明溶液中 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:___________ 。
④甲同学认为实验ⅵ和ⅶ中, 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,___________ (填实验操作与现象),则说明猜想成立。
(5)请举出一种水解反应在生产或生活中的应用:___________ 。
 在生产和生活中用途广泛。
在生产和生活中用途广泛。Ⅰ.
 溶液的配制及浓度的标定
溶液的配制及浓度的标定(1)
 溶液的配制
溶液的配制①配制100mL一定浓度的
 溶液需用到的仪器有
溶液需用到的仪器有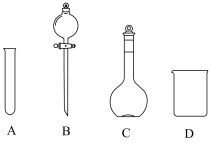
 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为(2)
 溶液浓度的标定
溶液浓度的标定量取10.00mL
 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用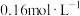
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 与
与 反应的探究
反应的探究(3)预测现象1:向
 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为预测现象2:向
 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。(4)实验验证:小组同学设计以下实验探究溶液中
 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:| 序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
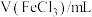 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
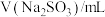 | 0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 |
 | 38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 |
| 现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
| pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是
③实验ⅵ和ⅶ的实验现象说明溶液中
 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:④甲同学认为实验ⅵ和ⅶ中,
 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(5)请举出一种水解反应在生产或生活中的应用:
您最近半年使用:0次
名校
解题方法
2 . 酸浸法回收废炉渣中(主要为铜、钴、镍、铁等金属元素的氧化物)的铜、钴、镍的流程如下: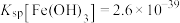 ,
, 。
。
(1)“磨细”过程的目的是_______ 。
(2)酸浸液中大量铁元素以 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为_______ 。
(3)“滤渣2”主要成分为_______ (填化学式)。
(4)“镍钴分离”过程 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(5)“酸溶1”过程用 替换
替换 ,从绿色化学角度分析其可行性
,从绿色化学角度分析其可行性_______ 。
(6)“焙烧”过程发生反应的化学方程式为_______ 。
(7)已知当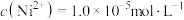 时,认为其沉淀完全。“沉镍”过程的目的是为了将“
时,认为其沉淀完全。“沉镍”过程的目的是为了将“ ”,此时应调节溶液的pH为
”,此时应调节溶液的pH为_______ 。
(8)“操作X”为_______ 。
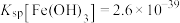 ,
, 。
。(1)“磨细”过程的目的是
(2)酸浸液中大量铁元素以
 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为(3)“滤渣2”主要成分为
(4)“镍钴分离”过程
 发生反应的离子方程式为
发生反应的离子方程式为(5)“酸溶1”过程用
 替换
替换 ,从绿色化学角度分析其可行性
,从绿色化学角度分析其可行性(6)“焙烧”过程发生反应的化学方程式为
(7)已知当
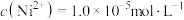 时,认为其沉淀完全。“沉镍”过程的目的是为了将“
时,认为其沉淀完全。“沉镍”过程的目的是为了将“ ”,此时应调节溶液的pH为
”,此时应调节溶液的pH为(8)“操作X”为
您最近半年使用:0次
2024-02-20更新
|
448次组卷
|
2卷引用:福建省2024届名校联盟全国优质校高三大联考化学试题
名校
解题方法
3 . 以废旧锂离子电池(主要成分为 )为原料制备棒状草酸钴晶体(
)为原料制备棒状草酸钴晶体( ,微溶于水,溶解度随温度升高而逐渐增大)的一种方法如下图所示,该法经济可行,为工业化回收废旧锂电池中有色金属提供了依据。
,微溶于水,溶解度随温度升高而逐渐增大)的一种方法如下图所示,该法经济可行,为工业化回收废旧锂电池中有色金属提供了依据。 外,还含
外,还含 、
、 ,
, ,
, ,
, ,
, 等离子;
等离子;
② ,
,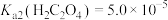 ;
;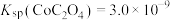 。
。
回答下列问题:
(1)“浸出”时, 与
与 、稀硫酸反应中氧化剂与还原剂的物质的量之比为
、稀硫酸反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)“水解沉淀铝铜”时,沉淀铝反应的离子方程式为___________ 。
(3)沉淀2的成分为 和
和___________ ,“氧化沉淀铁锰”时,生成 的离子方程式为
的离子方程式为___________ 。
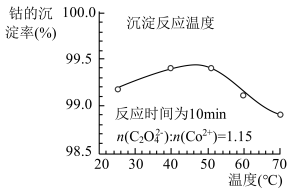
(4)“沉钴”时,温度与钴的沉淀率的关系如图所示,沉淀反应时间为10 min,反应温度为50℃以上时,温度升高,而钴的沉淀率下降,可能原因为___________ 。 溶液代替
溶液代替 ,反应为
,反应为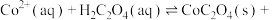
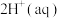 ,则该反应的平衡常数为
,则该反应的平衡常数为___________ ,若平衡时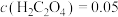 mol⋅L-1,
mol⋅L-1, ,则此时Co2+是否沉淀完全?
,则此时Co2+是否沉淀完全?___________ (填“是”或“否”,离子浓度≤10-5 mol⋅L-1即可认为沉淀完全)。
 )为原料制备棒状草酸钴晶体(
)为原料制备棒状草酸钴晶体( ,微溶于水,溶解度随温度升高而逐渐增大)的一种方法如下图所示,该法经济可行,为工业化回收废旧锂电池中有色金属提供了依据。
,微溶于水,溶解度随温度升高而逐渐增大)的一种方法如下图所示,该法经济可行,为工业化回收废旧锂电池中有色金属提供了依据。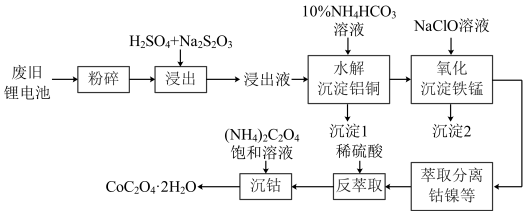
 外,还含
外,还含 、
、 ,
, ,
, ,
, ,
, 等离子;
等离子;②
 ,
,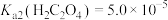 ;
;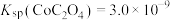 。
。回答下列问题:
(1)“浸出”时,
 与
与 、稀硫酸反应中氧化剂与还原剂的物质的量之比为
、稀硫酸反应中氧化剂与还原剂的物质的量之比为(2)“水解沉淀铝铜”时,沉淀铝反应的离子方程式为
(3)沉淀2的成分为
 和
和 的离子方程式为
的离子方程式为(4)“沉钴”时,温度与钴的沉淀率的关系如图所示,沉淀反应时间为10 min,反应温度为50℃以上时,温度升高,而钴的沉淀率下降,可能原因为
 溶液代替
溶液代替 ,反应为
,反应为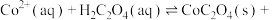
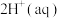 ,则该反应的平衡常数为
,则该反应的平衡常数为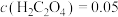 mol⋅L-1,
mol⋅L-1, ,则此时Co2+是否沉淀完全?
,则此时Co2+是否沉淀完全?
您最近半年使用:0次
2024-02-01更新
|
325次组卷
|
2卷引用:江西省宜春市第一中学2023-2024学年高三上学期1月质量检测化学试题
4 . 某湿法炼锌的萃余液中含有 、
、 、
、 、
、 、
、 、
、 及
及 等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:
等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:

已知:
(1)常温下,测得某种萃余液中硫酸的浓度为 ,则此溶液中
,则此溶液中
___________  。
。
(2)在酸性条件下,加入 氧化时,
氧化时, 转化为
转化为 除去,生成
除去,生成 反应的离子方程式为
反应的离子方程式为___________ 。
(3)常温下,中和时,先调节 约为1,加入适量的
约为1,加入适量的 氧化,再调节
氧化,再调节 为4.0,“沉渣”的主要成分除
为4.0,“沉渣”的主要成分除 外还有
外还有___________ ;若加入过量 ,钴元素将会进入“沉渣”中,则水解后的溶液中
,钴元素将会进入“沉渣”中,则水解后的溶液中 约为
约为___________  。
。
(4)“沉锌”时,在近中性条件下加入 可得碱式碳酸锌[
可得碱式碳酸锌[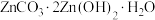 ]固体,同时产生大量气体,产生大量气体的原因是
]固体,同时产生大量气体,产生大量气体的原因是___________ 。
(5)不同质量分数的 溶液在不同温度下析出
溶液在不同温度下析出 晶体的物种如图所示。欲从含
晶体的物种如图所示。欲从含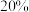
 及微量杂质的“沉锌后液”中直接析出无水
及微量杂质的“沉锌后液”中直接析出无水 ,“操作a”为
,“操作a”为___________ 。

 、
、 、
、 、
、 、
、 、
、 及
及 等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:
等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:
已知:
| 沉淀物 |  |  |  |  |  |
 | 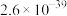 |  | 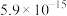 |  | 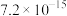 |
(1)常温下,测得某种萃余液中硫酸的浓度为
 ,则此溶液中
,则此溶液中
 。
。(2)在酸性条件下,加入
 氧化时,
氧化时, 转化为
转化为 除去,生成
除去,生成 反应的离子方程式为
反应的离子方程式为(3)常温下,中和时,先调节
 约为1,加入适量的
约为1,加入适量的 氧化,再调节
氧化,再调节 为4.0,“沉渣”的主要成分除
为4.0,“沉渣”的主要成分除 外还有
外还有 ,钴元素将会进入“沉渣”中,则水解后的溶液中
,钴元素将会进入“沉渣”中,则水解后的溶液中 约为
约为 。
。(4)“沉锌”时,在近中性条件下加入
 可得碱式碳酸锌[
可得碱式碳酸锌[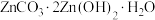 ]固体,同时产生大量气体,产生大量气体的原因是
]固体,同时产生大量气体,产生大量气体的原因是(5)不同质量分数的
 溶液在不同温度下析出
溶液在不同温度下析出 晶体的物种如图所示。欲从含
晶体的物种如图所示。欲从含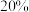
 及微量杂质的“沉锌后液”中直接析出无水
及微量杂质的“沉锌后液”中直接析出无水 ,“操作a”为
,“操作a”为
您最近半年使用:0次
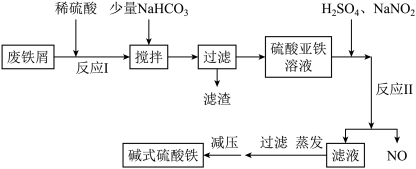
5 . 碱式硫酸铁[ ]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
部分正离子以氢氧化物形式沉淀时溶液的pH如表所示:
请回答下列问题:
(1)加入少量NaHCO3的目的是将溶液的pH条件至___________ 范围,以除去 ,可能发生的离子方程式为
,可能发生的离子方程式为___________ 。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作___________ 。若参与反应的O2有11.2L(标准状况),则相当于节约了___________ molNaNO2。
(3)碱式硫酸铁溶于水后产生的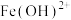 可部分水解生成
可部分水解生成 ,该水解反应的离子方程式为
,该水解反应的离子方程式为___________ 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有 及
及 。为检验所得的产品中是否含有
。为检验所得的产品中是否含有 ,应当先用稀硫酸溶解样品。请简述后续的检验方法:
,应当先用稀硫酸溶解样品。请简述后续的检验方法:___________ 。
 ]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
部分正离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 |  |  |  |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是将溶液的pH条件至
 ,可能发生的离子方程式为
,可能发生的离子方程式为(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作
(3)碱式硫酸铁溶于水后产生的
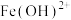 可部分水解生成
可部分水解生成 ,该水解反应的离子方程式为
,该水解反应的离子方程式为(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有
 及
及 。为检验所得的产品中是否含有
。为检验所得的产品中是否含有 ,应当先用稀硫酸溶解样品。请简述后续的检验方法:
,应当先用稀硫酸溶解样品。请简述后续的检验方法:
您最近半年使用:0次
名校
6 . 硫氰化钾(KSCN)是中学实验室的常见药品,某校化学兴趣小组在实验室制备少量样品,并进行探究实验。他们查有关资料: ,该反应比较缓慢。
,该反应比较缓慢。
I.制备KSCN样品。
(1)先制备 溶液,装置如图:
溶液,装置如图:
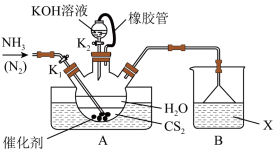
①实验开始时打开 ,关闭
,关闭 ,加热水浴装置,缓缓地向三颈烧瓶中持续通入
,加热水浴装置,缓缓地向三颈烧瓶中持续通入 ,并持续通入
,并持续通入 ,通入
,通入 的作用是:
的作用是:___________ 。
②一段时间后,当 反应完毕,停止实验,此时可以观察到三颈烧瓶内的现象是:
反应完毕,停止实验,此时可以观察到三颈烧瓶内的现象是:___________ 。
③烧杯内的溶液X是___________ 。
(2)再制备KSCN溶液:关闭 ,打开
,打开 ,利用耐碱分液漏斗缓慢加入适量KOH溶液,继续加热,此时三颈烧瓶中发生反应的化学方程式是
,利用耐碱分液漏斗缓慢加入适量KOH溶液,继续加热,此时三颈烧瓶中发生反应的化学方程式是___________ 。
(3)样品检测:待冷却后,用胶头滴管吸取少量样品滴入试管中的 溶液中,并没有观察到明显变红的现象,请分析可能的原因:
溶液中,并没有观察到明显变红的现象,请分析可能的原因:___________ 。
Ⅱ.KSCN的探究实验,同学们用实验室配制的KSCN溶液做下列实验(不是刚才兴趣小组合成的)。
(4)同学甲想检测 中是否有三价铁,他把在充满氧气的集气瓶中燃烧后的铁丝残渣放入试管,加适量盐酸使其溶解,再往混合液中滴入少量KSCN溶液检验是否有
中是否有三价铁,他把在充满氧气的集气瓶中燃烧后的铁丝残渣放入试管,加适量盐酸使其溶解,再往混合液中滴入少量KSCN溶液检验是否有 ,结果没变红,请分析原因:
,结果没变红,请分析原因:___________ 。
(5)同学丙往 和KSCN的混合溶液中滴加氯水,溶液变成红色,不过他注意到,当氯水过量时,红色会褪去,为此,他设计如图装置进行探究。
和KSCN的混合溶液中滴加氯水,溶液变成红色,不过他注意到,当氯水过量时,红色会褪去,为此,他设计如图装置进行探究。
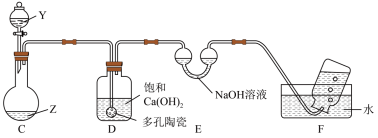
Y为 溶液,Z为
溶液,Z为 和KSCN的混合溶液。打开分液漏斗,持续缓慢滴入
和KSCN的混合溶液。打开分液漏斗,持续缓慢滴入 溶液至过量,他观察到:C中红色变浅,有大量气泡产生,C中还有现象为:
溶液至过量,他观察到:C中红色变浅,有大量气泡产生,C中还有现象为:___________ ;D中的现象为:___________ ;F中有气泡,由此推测,KSCN具有___________ 性。
 ,该反应比较缓慢。
,该反应比较缓慢。I.制备KSCN样品。
(1)先制备
 溶液,装置如图:
溶液,装置如图:
①实验开始时打开
 ,关闭
,关闭 ,加热水浴装置,缓缓地向三颈烧瓶中持续通入
,加热水浴装置,缓缓地向三颈烧瓶中持续通入 ,并持续通入
,并持续通入 ,通入
,通入 的作用是:
的作用是:②一段时间后,当
 反应完毕,停止实验,此时可以观察到三颈烧瓶内的现象是:
反应完毕,停止实验,此时可以观察到三颈烧瓶内的现象是:③烧杯内的溶液X是
(2)再制备KSCN溶液:关闭
 ,打开
,打开 ,利用耐碱分液漏斗缓慢加入适量KOH溶液,继续加热,此时三颈烧瓶中发生反应的化学方程式是
,利用耐碱分液漏斗缓慢加入适量KOH溶液,继续加热,此时三颈烧瓶中发生反应的化学方程式是(3)样品检测:待冷却后,用胶头滴管吸取少量样品滴入试管中的
 溶液中,并没有观察到明显变红的现象,请分析可能的原因:
溶液中,并没有观察到明显变红的现象,请分析可能的原因:Ⅱ.KSCN的探究实验,同学们用实验室配制的KSCN溶液做下列实验(不是刚才兴趣小组合成的)。
(4)同学甲想检测
 中是否有三价铁,他把在充满氧气的集气瓶中燃烧后的铁丝残渣放入试管,加适量盐酸使其溶解,再往混合液中滴入少量KSCN溶液检验是否有
中是否有三价铁,他把在充满氧气的集气瓶中燃烧后的铁丝残渣放入试管,加适量盐酸使其溶解,再往混合液中滴入少量KSCN溶液检验是否有 ,结果没变红,请分析原因:
,结果没变红,请分析原因:(5)同学丙往
 和KSCN的混合溶液中滴加氯水,溶液变成红色,不过他注意到,当氯水过量时,红色会褪去,为此,他设计如图装置进行探究。
和KSCN的混合溶液中滴加氯水,溶液变成红色,不过他注意到,当氯水过量时,红色会褪去,为此,他设计如图装置进行探究。
Y为
 溶液,Z为
溶液,Z为 和KSCN的混合溶液。打开分液漏斗,持续缓慢滴入
和KSCN的混合溶液。打开分液漏斗,持续缓慢滴入 溶液至过量,他观察到:C中红色变浅,有大量气泡产生,C中还有现象为:
溶液至过量,他观察到:C中红色变浅,有大量气泡产生,C中还有现象为:
您最近半年使用:0次
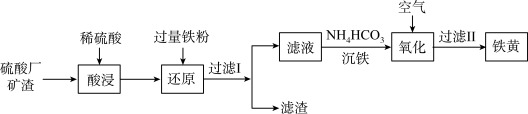
7 . 以硫酸厂矿渣(含Fe2O3、α-Al2O3、SiO2等)为原料制备铁黄( )的一种工艺流程如图所示:
)的一种工艺流程如图所示:
资料:i.α-Al2O3化学性质极不活泼,不溶于水也不溶于酸或碱。
ii. ;
;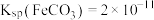 。
。
回答下列问题:
(1)为了提高“酸浸”的效率可以采用的措施有(写出其中两种)___________ 。
(2)“还原”过程中的离子方程式为___________ 。
(3)“滤渣”中主要成分为(填化学式)___________ 。
(4)①“沉铁”过程中有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为___________ 。
②“沉铁”过程中往往有副产物 生成,分析原因是
生成,分析原因是___________ 。
③若用 “沉铁”,则无副产物
“沉铁”,则无副产物 产生,当反应完成时,溶液中
产生,当反应完成时,溶液中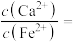
___________ 。
(5)写出氧化过程生成铁黄的化学方程式为___________ 。
(6)利用制备的铁黄进行如图实验:

①加入氯水后颜色加深的原因可能是:___________ 。
②某同学发现实验中加入过量新制氯水,放置一段时间后,深红色会逐渐褪去,褪色后的溶液中继续滴加 溶液,又出现红色,则褪色的原因可能是
溶液,又出现红色,则褪色的原因可能是___________ 。
 )的一种工艺流程如图所示:
)的一种工艺流程如图所示:
资料:i.α-Al2O3化学性质极不活泼,不溶于水也不溶于酸或碱。
ii.
 ;
;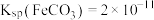 。
。回答下列问题:
(1)为了提高“酸浸”的效率可以采用的措施有(写出其中两种)
(2)“还原”过程中的离子方程式为
(3)“滤渣”中主要成分为(填化学式)
(4)①“沉铁”过程中有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为②“沉铁”过程中往往有副产物
 生成,分析原因是
生成,分析原因是③若用
 “沉铁”,则无副产物
“沉铁”,则无副产物 产生,当反应完成时,溶液中
产生,当反应完成时,溶液中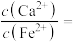
(5)写出氧化过程生成铁黄的化学方程式为
(6)利用制备的铁黄进行如图实验:

①加入氯水后颜色加深的原因可能是:
②某同学发现实验中加入过量新制氯水,放置一段时间后,深红色会逐渐褪去,褪色后的溶液中继续滴加
 溶液,又出现红色,则褪色的原因可能是
溶液,又出现红色,则褪色的原因可能是
您最近半年使用:0次
8 . 以电解铝废渣(主要含AlF3、NaF、LiF、CaO)为原料,制备电池级碳酸锂的工艺流程如下:
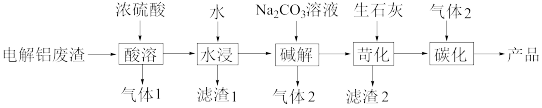
已知: AlF3、LiF难溶于水,LiOH溶于水,Li2CO3微溶于水,Ksp(Li2CO3)
 2.5×10-2、Ksp( CaCO3) = 2.8×10-9。回答下列问题:
2.5×10-2、Ksp( CaCO3) = 2.8×10-9。回答下列问题:
(1)①电解氧化铝生成铝的化学方程式为___________ ,无碳电解铝技术是利用陶瓷材料替代碳作阳极,该技术的优点之一是___________ 。
②已知AlCl3可形成共价分子, AlF3为离子晶体,从电负性的角度解释其原因:_____________ 。
(2)“气体1”是___________ ( 填化学式,下同),“滤渣1”的主要成分是___________ 。
(3)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式___________ 。
(4)“苛化”中存在如下反应:Li2CO3(s)+Ca2+(aq) 2Li+(aq)+ CaCO3(s)。通过计算解释生石灰能使Li2CO3完全转化的原因:
2Li+(aq)+ CaCO3(s)。通过计算解释生石灰能使Li2CO3完全转化的原因:______________ 。
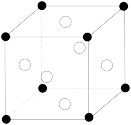
(5)Al-Li合金具有低密度、耐腐蚀等特点,已成为航天器的重要结构材料。一种Al3Li合金的晶胞如图所示,其中白球代表的是___________ ;若其晶胞参数为apm,则该合金的晶体密度为___________ g·cm-3 (列出计算式,阿伏加德罗常数用NA表示)。

已知: AlF3、LiF难溶于水,LiOH溶于水,Li2CO3微溶于水,Ksp(Li2CO3)

 2.5×10-2、Ksp( CaCO3) = 2.8×10-9。回答下列问题:
2.5×10-2、Ksp( CaCO3) = 2.8×10-9。回答下列问题:(1)①电解氧化铝生成铝的化学方程式为
②已知AlCl3可形成共价分子, AlF3为离子晶体,从电负性的角度解释其原因:
(2)“气体1”是
(3)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式
(4)“苛化”中存在如下反应:Li2CO3(s)+Ca2+(aq)
 2Li+(aq)+ CaCO3(s)。通过计算解释生石灰能使Li2CO3完全转化的原因:
2Li+(aq)+ CaCO3(s)。通过计算解释生石灰能使Li2CO3完全转化的原因:(5)Al-Li合金具有低密度、耐腐蚀等特点,已成为航天器的重要结构材料。一种Al3Li合金的晶胞如图所示,其中白球代表的是

您最近半年使用:0次
9 . 钪(Sc)是一种重要的稀土金属,常用来制特种玻璃、轻质耐高温合金。从“赤泥”矿(主要成分为 、
、 、
、 、
、 )中回收钪,同时生产聚合氯化铁铝[
)中回收钪,同时生产聚合氯化铁铝[ ]具有极其重要的工业价值,一种工艺流程如图所示:
]具有极其重要的工业价值,一种工艺流程如图所示:

已知:钪离子可以在不同pH下生成 (n=1~6)。请回答以下问题:
(n=1~6)。请回答以下问题:
(1)基态钪原子的价电子排布式为_______ ,过氧化氢的电子式为_______ 。
(2)“还原”步骤中发生的主要离子反应方程式为_______ 。
(3)“反萃取”时若加入的氢氧化钠大量过量,则生成的含Sc元素的粒子主要为_______ 。
(4)为了使水解步骤反应更加彻底,可以采取的措施为_______ (不能添加化学式剂,任答一条即可)。
(5)步骤X中生成聚合氯化铁铝[ ]的化学反应方程式为
]的化学反应方程式为_______ 。
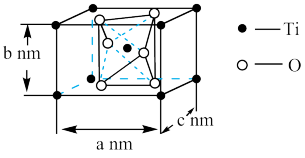
(6)如图是 晶胞的示意图,晶胞中含有的氧原子数目为
晶胞的示意图,晶胞中含有的氧原子数目为_______ 个,已知Ti原子的配位数为6,则O原子的配位数为_______ ,该晶体的密度约为_______  。(NA取
。(NA取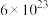 ,结果用含a、b、c的最简分数表达式表示)。
,结果用含a、b、c的最简分数表达式表示)。
 、
、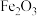 、
、 、
、 )中回收钪,同时生产聚合氯化铁铝[
)中回收钪,同时生产聚合氯化铁铝[ ]具有极其重要的工业价值,一种工艺流程如图所示:
]具有极其重要的工业价值,一种工艺流程如图所示:
已知:钪离子可以在不同pH下生成
 (n=1~6)。请回答以下问题:
(n=1~6)。请回答以下问题:(1)基态钪原子的价电子排布式为
(2)“还原”步骤中发生的主要离子反应方程式为
(3)“反萃取”时若加入的氢氧化钠大量过量,则生成的含Sc元素的粒子主要为
(4)为了使水解步骤反应更加彻底,可以采取的措施为
(5)步骤X中生成聚合氯化铁铝[
 ]的化学反应方程式为
]的化学反应方程式为(6)如图是
 晶胞的示意图,晶胞中含有的氧原子数目为
晶胞的示意图,晶胞中含有的氧原子数目为 。(NA取
。(NA取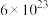 ,结果用含a、b、c的最简分数表达式表示)。
,结果用含a、b、c的最简分数表达式表示)。
您最近半年使用:0次
名校
解题方法
10 . 某学习小组查阅资料发现:①硫元素处于-2价和+4价的物质有较强的还原性,Fe3+具有较强的氧化性;②大多数自发的氧化还原反应是放热反应。该学习小组进行了一系列探究:
(1)利用下图装置探究SO2与FeCl3溶液的反应(夹持装置已略去):
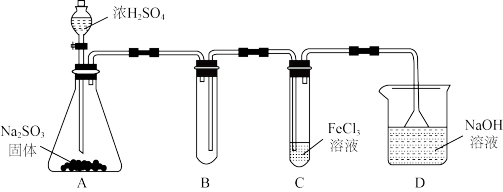
①用FeCl3晶体配制一定浓度FeCl3溶液的方法是_______ 。
②实验开始一段时间后,C中溶液由深黄色变为浅绿色,据此写出C中反应的离子方程式:_______ ,检验有Fe2+(溶液中仍有少量Fe3+)的方法是:取少量C试管溶液,加入无色溶液_______ (仅填一种物质化学式),生成_______ (现象),证明有Fe2+。
③取少量反应后的C中溶液,加入盐酸酸化,再加入Ba(NO3)2溶液,产生白色沉淀,即可证明反应生成了 ,该做法
,该做法_______ (填“合理”或“不合理”),理由是_______ 。
(2)利用0.10mol/L的NaHS溶液a(常温pH=8.1)和0.10mol/LFeCl3溶液b(常温pH=1.3)探究NaHS和FeCl3的反应:
①常温下,将溶液a和溶液b按3:1的体积比混合于试管中,发现有红褐色沉淀生成,仔细观察还有一些黄色固体,该红褐色沉淀是_______ ,黄色固体是_______ 。
②学习小组继续将溶液a和溶液b按3:1的体积比混合,分装在两支试管中,第一支置于沸水浴中,第二支置于冰水浴中,发现第一支试管只有红褐色沉淀,并产生臭鸡蛋气味气体,原因是_______ ;第二支试管只有黄色沉淀,没有气体产生,原因是_______ 。
(1)利用下图装置探究SO2与FeCl3溶液的反应(夹持装置已略去):

①用FeCl3晶体配制一定浓度FeCl3溶液的方法是
②实验开始一段时间后,C中溶液由深黄色变为浅绿色,据此写出C中反应的离子方程式:
③取少量反应后的C中溶液,加入盐酸酸化,再加入Ba(NO3)2溶液,产生白色沉淀,即可证明反应生成了
 ,该做法
,该做法(2)利用0.10mol/L的NaHS溶液a(常温pH=8.1)和0.10mol/LFeCl3溶液b(常温pH=1.3)探究NaHS和FeCl3的反应:
①常温下,将溶液a和溶液b按3:1的体积比混合于试管中,发现有红褐色沉淀生成,仔细观察还有一些黄色固体,该红褐色沉淀是
②学习小组继续将溶液a和溶液b按3:1的体积比混合,分装在两支试管中,第一支置于沸水浴中,第二支置于冰水浴中,发现第一支试管只有红褐色沉淀,并产生臭鸡蛋气味气体,原因是
您最近半年使用:0次
2022-05-14更新
|
431次组卷
|
2卷引用:广东省新高考普通高中2022届高三联合质量测评冲刺模拟考试化学试题



