名校
解题方法
1 . 化学实验小组探究0.1mol/LNa2S溶液与0.1mol/LFeCl3溶液的反应。查阅文献得相关信息如下:
(1)【猜想预测】
预测1:若产生红褐色沉淀,说明发生双水解反应;
预测2:若产生黑色沉淀时,说明发生复分解反应:
预测3:Fe3+具有___ ,若产生黄色沉淀,说明发生氧化还原反应。
(2)【实验探究】
实验Ⅰ.向装有5mL、0.1mol/L的FeCl3的溶液中滴加1mL、0.1mol/LNa2S溶液,迅速生成黑色沉淀,由此可知,预测1、3不成立,预测2成立。试解释预测2成立而预测1不成立的原因:___ 。实验过程中,该小组同学发现黑色沉淀放置一段时间后逐渐消失,并有黄色沉淀生成。为探明原因,分离滤渣和滤液进行如下实验:
实验Ⅱ.为探究实验Ⅰ中Fe2S3后续发生氧化还原反应的原因,该组同学进行如下探究实验:【限选试剂:Fe2S3、稀盐酸、稀硝酸、饱和FeCl3溶液、饱和Fe(NO3)3溶液、H2O2】

| 物质 | 相关信息 |
| 0.1mol/LNa2S溶液 | 无色透明液体,pH=12 |
| 0.1mol/LFeCl3溶液 | 黄褐色透明液体,pH=2 |
| S单质 | 微溶于酒精,难溶于水,含硫的酒精溶于水会出现乳白色浑浊 |
| Fe(OH)3 | 红褐色固体,Ksp=1.1×10-36 |
| Fe2S3 | 黑色固体,Ksp=1.0×10-88 |
预测1:若产生红褐色沉淀,说明发生双水解反应;
预测2:若产生黑色沉淀时,说明发生复分解反应:
预测3:Fe3+具有
(2)【实验探究】
实验Ⅰ.向装有5mL、0.1mol/L的FeCl3的溶液中滴加1mL、0.1mol/LNa2S溶液,迅速生成黑色沉淀,由此可知,预测1、3不成立,预测2成立。试解释预测2成立而预测1不成立的原因:
| 实验 | 操作 | 现象 | 结论 |
| ① | 取滤渣用酒精充分浸取,取上层浸液少许加入到盛有蒸馏水的试管中 | 滤渣中含有S | |
| ② | 取滤液加入几滴K3[Fe(CN)6]溶液 | 滤液中含有Fe2+;证明Fe2S3后续发生了氧化还原反应 |

| 实验 | 操作 | 现象 | 结论 |
| ① | 往A中滴加 | A中黑色固体消失,并有黄色沉淀生成;B中有黑色沉淀生成 | Fe2S3在酸性条件下发生了氧化还原,反应的离子反应方程式: |
| ② | 往A中滴加 | A中黑色固体消失,并有黄色沉淀生成;B中无黑色沉淀生成 | Fe3+可以氧化Fe2S3,反应的离子反应方程式: |
您最近一年使用:0次
2 . 碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
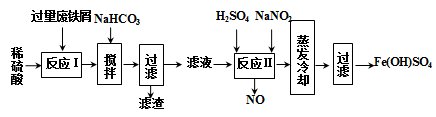
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
完成下列填空:
(1)反应I后的溶液中存在的主要阳离子有___________ 。
(2)加入少量NaHCO3的目的是将溶液的pH调节在___________ 范围内,该工艺中“搅拌”的作用是___________ 。
(3)在实验室,“过滤”操作中用到的硅酸盐仪器是___________ 。
(4)反应II加入NaNO2的目的是___________ ,反应的离子方程式为___________ 。
(5)该流程中“蒸发”要采用减压蒸发,相对于常压蒸发,减压蒸发的优点是______ ,溶液的pH也不能过大或过小,原因是___________ 。
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为___________(选填序号)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为___________(选填序号)。

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应I后的溶液中存在的主要阳离子有
(2)加入少量NaHCO3的目的是将溶液的pH调节在
(3)在实验室,“过滤”操作中用到的硅酸盐仪器是
(4)反应II加入NaNO2的目的是
(5)该流程中“蒸发”要采用减压蒸发,相对于常压蒸发,减压蒸发的优点是
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO
 。为检验所得产品中是否含有Fe2+,应使用的试剂为___________(选填序号)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为___________(选填序号)。| A.氯水 | B.KSCN溶液 | C.NaOH溶液 | D.酸性KMnO4溶液 |
您最近一年使用:0次
2021-11-09更新
|
367次组卷
|
2卷引用:山东省济宁邹城市2021-2022学年高三上学期期中考试化学试题
解题方法
3 . 下列反应的离子方程式正确的是
A.草酸使酸性KMnO4溶液褪色:5H2C2O4+2MnO +6H+=2Mn2++10CO2↑+8H2O +6H+=2Mn2++10CO2↑+8H2O |
B.泡沫灭火器的灭火原理:2Al3++3CO +3H2O=2Al(OH)3↓+3CO2↑ +3H2O=2Al(OH)3↓+3CO2↑ |
C.向AgNO3溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH |
D.已知电离平衡常数:H2CO3>HClO>HCO ,向NaClO溶液中通入少量CO2:2ClO—+CO2+H2O=2HClO+CO ,向NaClO溶液中通入少量CO2:2ClO—+CO2+H2O=2HClO+CO |
您最近一年使用:0次
解题方法
4 . 某研究小组用炼锌废渣制备 。炼锌产生的废渣中含钴10~18%、锌15~20%左右,还含有少量锰、铁、铜、镉等金属。
。炼锌产生的废渣中含钴10~18%、锌15~20%左右,还含有少量锰、铁、铜、镉等金属。
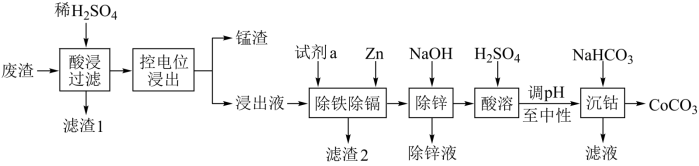
已知:
(1)滤渣1的成分是___________ ,提高“酸浸”浸出率的措施有___________ 。(任写一条措施)
(2)“控电位浸出”是控制合适的氧化电位电解除锰,将溶液中 变为
变为 除去,写出阳极电极反应式
除去,写出阳极电极反应式___________ 。
(3)已知浸出液含金属离子为 、
、 、
、 、
、 ,试剂a是
,试剂a是 和
和 的悬浊液,试剂a除铁的原理是
的悬浊液,试剂a除铁的原理是___________ (文字表述);滤渣2成分是___________ 。(写化学式)
(4)“沉钴”的离子方程式是___________ ,该步骤选择 ,而不用
,而不用 的原因是
的原因是___________ 。
(5) 与
与 按一定比例在700℃下烧结,可得重要的电极材料钴酸锂(
按一定比例在700℃下烧结,可得重要的电极材料钴酸锂( ),烧结反应化学方程式是
),烧结反应化学方程式是___________ 。
 。炼锌产生的废渣中含钴10~18%、锌15~20%左右,还含有少量锰、铁、铜、镉等金属。
。炼锌产生的废渣中含钴10~18%、锌15~20%左右,还含有少量锰、铁、铜、镉等金属。
已知:

(1)滤渣1的成分是
(2)“控电位浸出”是控制合适的氧化电位电解除锰,将溶液中
 变为
变为 除去,写出阳极电极反应式
除去,写出阳极电极反应式(3)已知浸出液含金属离子为
 、
、 、
、 、
、 ,试剂a是
,试剂a是 和
和 的悬浊液,试剂a除铁的原理是
的悬浊液,试剂a除铁的原理是(4)“沉钴”的离子方程式是
 ,而不用
,而不用 的原因是
的原因是(5)
 与
与 按一定比例在700℃下烧结,可得重要的电极材料钴酸锂(
按一定比例在700℃下烧结,可得重要的电极材料钴酸锂( ),烧结反应化学方程式是
),烧结反应化学方程式是
您最近一年使用:0次
解题方法
5 . 金属 性质相似,在电子工业以及金属材料上应用十分广泛。现以含钴、镍、铝的废渣(主要成分为
性质相似,在电子工业以及金属材料上应用十分广泛。现以含钴、镍、铝的废渣(主要成分为 、少量杂质
、少量杂质 )提取钴、镍化合物的工艺如下:
)提取钴、镍化合物的工艺如下:
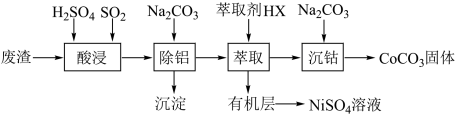
已知: 时,
时,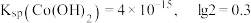
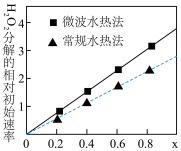
(1)酸浸时得到一种气体,其化学式为___________ ,酸浸时 参与的离子反应方程式为
参与的离子反应方程式为___________ ,能提高钴、镍元素浸出率的措施有___________ (写出两条即可)。
(2)除铝时加入碳酸钠产生沉淀的离子反应方程式为___________ , 时,若“沉钴”开始时
时,若“沉钴”开始时 ,则控制
,则控制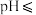
___________ 时不会产生 。
。
(3)用 为原料采用微波水热法和常规水热法均可制得使
为原料采用微波水热法和常规水热法均可制得使 分解的高效催化剂
分解的高效催化剂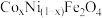 ,(其中
,(其中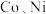 均为
均为 价)。如图是用两种不同方法制得的
价)。如图是用两种不同方法制得的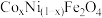 在
在 时催化分解
时催化分解 的
的 溶液的相对初始速率随x变化曲线。
溶液的相对初始速率随x变化曲线。
①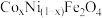 中
中 的价态为
的价态为___________ 。
②由图中信息可知:___________ 法制取的催化剂活性更高。
③ 两种离子中催化效果更好的是
两种离子中催化效果更好的是___________ 。
 性质相似,在电子工业以及金属材料上应用十分广泛。现以含钴、镍、铝的废渣(主要成分为
性质相似,在电子工业以及金属材料上应用十分广泛。现以含钴、镍、铝的废渣(主要成分为 、少量杂质
、少量杂质 )提取钴、镍化合物的工艺如下:
)提取钴、镍化合物的工艺如下:
已知:
 时,
时,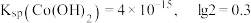

(1)酸浸时得到一种气体,其化学式为
 参与的离子反应方程式为
参与的离子反应方程式为(2)除铝时加入碳酸钠产生沉淀的离子反应方程式为
 时,若“沉钴”开始时
时,若“沉钴”开始时 ,则控制
,则控制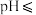
 。
。(3)用
 为原料采用微波水热法和常规水热法均可制得使
为原料采用微波水热法和常规水热法均可制得使 分解的高效催化剂
分解的高效催化剂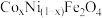 ,(其中
,(其中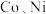 均为
均为 价)。如图是用两种不同方法制得的
价)。如图是用两种不同方法制得的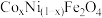 在
在 时催化分解
时催化分解 的
的 溶液的相对初始速率随x变化曲线。
溶液的相对初始速率随x变化曲线。①
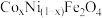 中
中 的价态为
的价态为②由图中信息可知:
③
 两种离子中催化效果更好的是
两种离子中催化效果更好的是
您最近一年使用:0次
2021-04-19更新
|
251次组卷
|
2卷引用:重庆市普通高中学业水平选择性考试2021届高三第二次联合诊断检测化学试题
名校
解题方法
6 . 铋是一种稀有金属,铋及其化合物在工业生产中用途广泛,如氯氧化铋常用于电子设备、汽车装饰材料、塑料助剂及生产干电池阴极。以下是一种用铋精矿(主要成分是Bi2S3还含有FeS2、 Cu2S、PbO2及不溶性杂质)制备 BiOCl的一种方法,其流程如图:

已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
(1)铋精矿在浸取时会先进行粉碎,目的是___________ 。
(2)加压氧化氨浸过程中,已知 CuS2发生如下反应: ,
, 生成
生成 ,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式
,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式___________ 。
(3)操作Ⅰ为:___________ 。
(4)根据流程分析,盐酸羟胺在反应中起到什么作用:___________ 。
(5)流程中生成 BiOCl 的离子方程式:___________ 。
(6)滤液 3 中含有的金属阳离子有:___________ 。

已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
(1)铋精矿在浸取时会先进行粉碎,目的是
(2)加压氧化氨浸过程中,已知 CuS2发生如下反应:
 ,
, 生成
生成 ,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式
,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式(3)操作Ⅰ为:
(4)根据流程分析,盐酸羟胺在反应中起到什么作用:
(5)流程中生成 BiOCl 的离子方程式:
(6)滤液 3 中含有的金属阳离子有:
您最近一年使用:0次
2021-03-03更新
|
642次组卷
|
4卷引用:广东省珠海市2021届高三第一次学业质量监测化学试题
广东省珠海市2021届高三第一次学业质量监测化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)2022届重庆市缙云教育联盟高三第〇次诊断性检测化学试题河南省范县第一中学2021-2022学年高二上学期期中检测化学试题



