名校
解题方法
1 . 常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明的溶液中:Cu2+、Na+、 、 、 |
B.AlCl3溶液中:Ba2+、Mn2+、 、 、 |
C.酸性溶液中:Fe2+、 、 、 、 、 |
D.使酚酞试液呈红色的溶液中:Na+、K+、 、 、 |
您最近一年使用:0次
名校
解题方法
2 . 硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。回答下列问题:
Ⅰ.工业生产硫化钠大多采用无水芒硝(Na2SO4) -炭粉还原法,其流程示意图如下:
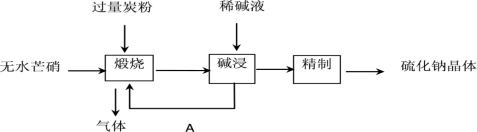
(1)①写出硫化钠的电子式___________
②上述流程中“碱浸”后,物质A必须经过___________ (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的 和
和 ,写出煅烧时发生的总的化学反应方程式为
,写出煅烧时发生的总的化学反应方程式为___________ 。
③上述流程中采用稀碱液比用热水更好,理由是___________ 。
Ⅱ.工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。溶解回流装置如下图所示,
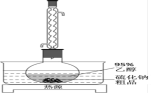
(2)回流前无需加入沸石,其原因是___________ 。回流时间不宜过长,原因是___________ ;回流结束后,需进行的操作有①停止加热②关闭冷凝水③移去水浴,正确的顺序为___________ (填标号)。
a.①②③ b.③①② c.②①③ d.①③②
(3)某毛纺厂废水中含 的硫化钠,与纸张漂白后的废水(含
的硫化钠,与纸张漂白后的废水(含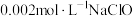 )按
)按 的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有
的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有___________ 。
Ⅰ.工业生产硫化钠大多采用无水芒硝(Na2SO4) -炭粉还原法,其流程示意图如下:

(1)①写出硫化钠的电子式
②上述流程中“碱浸”后,物质A必须经过
 和
和 ,写出煅烧时发生的总的化学反应方程式为
,写出煅烧时发生的总的化学反应方程式为③上述流程中采用稀碱液比用热水更好,理由是
Ⅱ.工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。溶解回流装置如下图所示,

(2)回流前无需加入沸石,其原因是
a.①②③ b.③①② c.②①③ d.①③②
(3)某毛纺厂废水中含
 的硫化钠,与纸张漂白后的废水(含
的硫化钠,与纸张漂白后的废水(含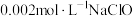 )按
)按 的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有
的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有
您最近一年使用:0次
名校
解题方法
3 . 碳元素可以形成数量丰富的化合物,如 与
与 等氧化物,
等氧化物, 等无机弱酸及其盐。回答下列问题:
等无机弱酸及其盐。回答下列问题:
(1) 的结构式为
的结构式为___________ 。
(2)氢氰酸的钾盐 在电镀工业中有重要应用,其水溶液呈碱性。用离子方程式解释
在电镀工业中有重要应用,其水溶液呈碱性。用离子方程式解释 水溶液显碱性的原因是
水溶液显碱性的原因是___________ 。
(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙 ,草酸钙在水中的沉淀溶解平衡可表示为
,草酸钙在水中的沉淀溶解平衡可表示为___________ 。
(4)已知 时,
时, 的电离平衡常数如下表。
的电离平衡常数如下表。
① 时,某
时,某 溶液的
溶液的 ,关于此溶液中的微粒浓度,下列说法正确的是
,关于此溶液中的微粒浓度,下列说法正确的是________ 。
A.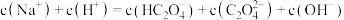
B.
C.
② 时,将
时,将 溶液和
溶液和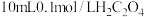 溶液混合并充分反应,所得溶液呈
溶液混合并充分反应,所得溶液呈___________ (选填“酸性”、“中性”或“碱性”)。
③将少量 溶液加入
溶液加入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为___________ 。
(5) 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: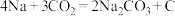 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式___________ 。

 与
与 等氧化物,
等氧化物, 等无机弱酸及其盐。回答下列问题:
等无机弱酸及其盐。回答下列问题:(1)
 的结构式为
的结构式为(2)氢氰酸的钾盐
 在电镀工业中有重要应用,其水溶液呈碱性。用离子方程式解释
在电镀工业中有重要应用,其水溶液呈碱性。用离子方程式解释 水溶液显碱性的原因是
水溶液显碱性的原因是(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙
 ,草酸钙在水中的沉淀溶解平衡可表示为
,草酸钙在水中的沉淀溶解平衡可表示为(4)已知
 时,
时, 的电离平衡常数如下表。
的电离平衡常数如下表。 |  |  | |
 | 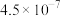 |  | 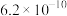 |
 | 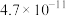 | 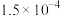 | 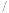 |
 时,某
时,某 溶液的
溶液的 ,关于此溶液中的微粒浓度,下列说法正确的是
,关于此溶液中的微粒浓度,下列说法正确的是A.
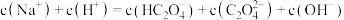
B.

C.

②
 时,将
时,将 溶液和
溶液和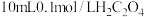 溶液混合并充分反应,所得溶液呈
溶液混合并充分反应,所得溶液呈③将少量
 溶液加入
溶液加入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为(5)
 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: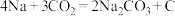 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
您最近一年使用:0次
名校
4 . 用低品铜矿(主要含 、
、 )制备
)制备 的一种工艺流程如下:
的一种工艺流程如下:
 、
、 )制备
)制备 的一种工艺流程如下:
的一种工艺流程如下: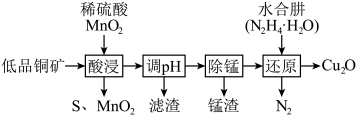
A.“酸浸”过程中 发生反应的离子方程式为 发生反应的离子方程式为 |
B.“调 ”的目的是除去溶液中的 ”的目的是除去溶液中的 |
C.使用 溶液“除锰”时,锰渣中可能会含有少量 溶液“除锰”时,锰渣中可能会含有少量 |
| D.“还原”过程中参与反应的氧化剂和还原剂的物质的量之比为2:1 |
您最近一年使用:0次
2024-02-17更新
|
213次组卷
|
3卷引用:安徽省合肥市第一中学2023-2024学年高三上学期期末考试化学试题
名校
5 . 下列化学方程式的书写正确的是
A. 溶液可使酚酞试液变红: 溶液可使酚酞试液变红: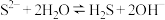 |
B.铅蓄电池放电时负极的电极反应式: |
C.向 溶液中滴加 溶液中滴加 溶液: 溶液: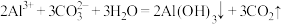 |
D.将 氢气与足量的碘蒸气混合混合反应后生成碘化氢气体,放出 氢气与足量的碘蒸气混合混合反应后生成碘化氢气体,放出 热量。则 热量。则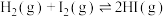  |
您最近一年使用:0次
2024-02-14更新
|
68次组卷
|
2卷引用:内蒙古呼伦贝尔市海拉尔第二中学2023-2024学年高二上学期期末考试化学试题
6 . 下列实验能达到相应实验目的的是
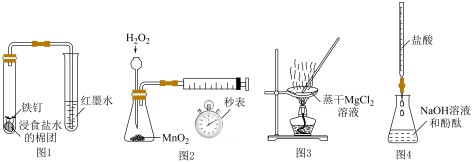
| A.利用图1观察铁的吸氧腐蚀 | B.利用图2装置测定化学反应速率 |
C.利用图3获得 固体 固体 | D.利用图4测定NaOH溶液的浓度 |
您最近一年使用:0次
2024-02-01更新
|
75次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
解题方法
7 . 实验室利用 和亚硫酰氯(
和亚硫酰氯( )制备无水
)制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
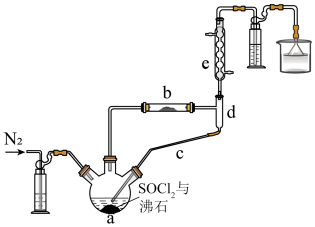
(1)仪器a的名称为________ 。
(2)实验开始时先通 ,作用是
,作用是________ ;一段时间后,先加热装置a再加热装置b,目的是________ 。
(3)加热时,装置b内发生反应的化学方程式为_________ 。
(4)f中试剂是________ 。
(5)g烧杯中的试剂可以是_________ 。
a. 溶液 b.
溶液 b. 溶液 c.浓硫酸 d.
溶液 c.浓硫酸 d. 溶液
溶液
(6)反应前,称取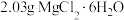 (
( 的相对分子质量为203),反应后,称得b中固体质量为
的相对分子质量为203),反应后,称得b中固体质量为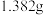 ,无水
,无水 的产率为
的产率为_______ (保留两位有效数字)。
 和亚硫酰氯(
和亚硫酰氯( )制备无水
)制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
(1)仪器a的名称为
(2)实验开始时先通
 ,作用是
,作用是(3)加热时,装置b内发生反应的化学方程式为
(4)f中试剂是
(5)g烧杯中的试剂可以是
a.
 溶液 b.
溶液 b. 溶液 c.浓硫酸 d.
溶液 c.浓硫酸 d. 溶液
溶液(6)反应前,称取
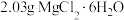 (
( 的相对分子质量为203),反应后,称得b中固体质量为
的相对分子质量为203),反应后,称得b中固体质量为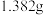 ,无水
,无水 的产率为
的产率为
您最近一年使用:0次
8 . 工业上利用高钛炉渣(主要成分为 及
及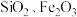 等)制备
等)制备 。
。
已知:① 在高温下与
在高温下与 反应生成
反应生成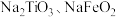 ,弱碱性条件下
,弱碱性条件下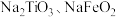 水解会生成
水解会生成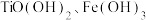 沉淀;
沉淀;
② 难溶于稀酸或稀碱,可以溶解在浓酸或浓碱中;
难溶于稀酸或稀碱,可以溶解在浓酸或浓碱中;
③ 水解能力显著强于
水解能力显著强于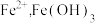 容易吸附沉淀。
容易吸附沉淀。
Ⅰ.硫酸法制备
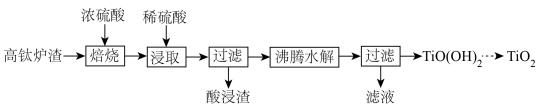
(1)焙烧、浸取
①“焙烧”时可将 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
②酸浸渣的主要成分为___________ 。
(2)沸腾水解
①水解反应 的平衡常数
的平衡常数
___________ 。(已知:该温度下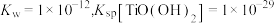 )
)
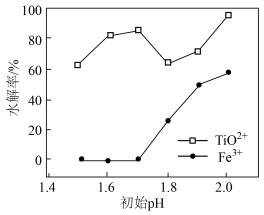
②其他条件不变,初始溶液 对含
对含 的
的 溶液水解率的影响如图所示,
溶液水解率的影响如图所示, 在
在 范围内,随着
范围内,随着 增大,
增大, 水解率下降的原因是
水解率下降的原因是___________ 。
(3)产品中 的纯度测定
的纯度测定
准确称取 样品,加入适量浓硫酸,加热至样品完全溶解,冷却后用水稀释,冷却至室温后再加入铝片将
样品,加入适量浓硫酸,加热至样品完全溶解,冷却后用水稀释,冷却至室温后再加入铝片将 还原为
还原为 ,用
,用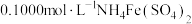 溶液滴定至终点,平行滴定3次,平均消耗
溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液 。计算样品中
。计算样品中 的纯度为
的纯度为___________ (已知: 可将
可将 还原为
还原为 )。
)。
Ⅱ.碱法制备
(4)高钛炉渣与 固体混合灼烧,冷却后加水浸出后得到含大量
固体混合灼烧,冷却后加水浸出后得到含大量 的
的 固体,请补充完整制取高纯
固体,请补充完整制取高纯 的实验方案:将浸出后的固体置于容器中,
的实验方案:将浸出后的固体置于容器中,___________ ,将 煅烧得
煅烧得 (实验中须使用的试剂:稀
(实验中须使用的试剂:稀 、
、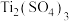 溶液、
溶液、 溶液、
溶液、 溶液)。
溶液)。
 及
及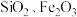 等)制备
等)制备 。
。已知:①
 在高温下与
在高温下与 反应生成
反应生成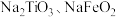 ,弱碱性条件下
,弱碱性条件下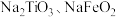 水解会生成
水解会生成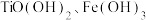 沉淀;
沉淀;②
 难溶于稀酸或稀碱,可以溶解在浓酸或浓碱中;
难溶于稀酸或稀碱,可以溶解在浓酸或浓碱中;③
 水解能力显著强于
水解能力显著强于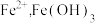 容易吸附沉淀。
容易吸附沉淀。Ⅰ.硫酸法制备


(1)焙烧、浸取
①“焙烧”时可将
 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为②酸浸渣的主要成分为
(2)沸腾水解
①水解反应
 的平衡常数
的平衡常数
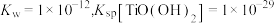 )
)②其他条件不变,初始溶液
 对含
对含 的
的 溶液水解率的影响如图所示,
溶液水解率的影响如图所示, 在
在 范围内,随着
范围内,随着 增大,
增大, 水解率下降的原因是
水解率下降的原因是
(3)产品中
 的纯度测定
的纯度测定准确称取
 样品,加入适量浓硫酸,加热至样品完全溶解,冷却后用水稀释,冷却至室温后再加入铝片将
样品,加入适量浓硫酸,加热至样品完全溶解,冷却后用水稀释,冷却至室温后再加入铝片将 还原为
还原为 ,用
,用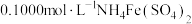 溶液滴定至终点,平行滴定3次,平均消耗
溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液 。计算样品中
。计算样品中 的纯度为
的纯度为 可将
可将 还原为
还原为 )。
)。Ⅱ.碱法制备
(4)高钛炉渣与
 固体混合灼烧,冷却后加水浸出后得到含大量
固体混合灼烧,冷却后加水浸出后得到含大量 的
的 固体,请补充完整制取高纯
固体,请补充完整制取高纯 的实验方案:将浸出后的固体置于容器中,
的实验方案:将浸出后的固体置于容器中, 煅烧得
煅烧得 (实验中须使用的试剂:稀
(实验中须使用的试剂:稀 、
、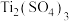 溶液、
溶液、 溶液、
溶液、 溶液)。
溶液)。
您最近一年使用:0次
名校
解题方法
9 . 氯化铁在金属蚀刻、污水处理等方面有广泛应用。某兴趣小组以废铁屑为原料,用如图所示装置制备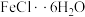

已知: 易溶于水、甲醇、乙醇,不溶于甘油。实验步骤如下:
易溶于水、甲醇、乙醇,不溶于甘油。实验步骤如下:
I.废铁屑的净化:取一只小烧杯,放入约5g废铁屑,向其中注入15mLlmol/L 溶液,浸泡数分钟后,分离出铁屑,洗净、晾干。
溶液,浸泡数分钟后,分离出铁屑,洗净、晾干。
II. 溶液的制备:将处理后的废铁屑加入装置B的三颈烧瓶中,缓慢加入适当过量的稀盐酸,得到含
溶液的制备:将处理后的废铁屑加入装置B的三颈烧瓶中,缓慢加入适当过量的稀盐酸,得到含 的混合液。
的混合液。
III. 溶液的制备:由装置A制备氯气;向
溶液的制备:由装置A制备氯气;向 的混合液中缓慢通入足量的氯气。
的混合液中缓慢通入足量的氯气。
IV. 产品的分离提纯:将三颈烧瓶中的
产品的分离提纯:将三颈烧瓶中的 混合液转移出来,经蒸发浓缩、冷却结晶、过滤、洗涤、重结晶、干燥,得到
混合液转移出来,经蒸发浓缩、冷却结晶、过滤、洗涤、重结晶、干燥,得到 产品。
产品。
V. 产品的纯度测定:用碘量法滴定并计算。
产品的纯度测定:用碘量法滴定并计算。
对于上述实验,对各步骤分析不正确的是
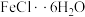

已知:
 易溶于水、甲醇、乙醇,不溶于甘油。实验步骤如下:
易溶于水、甲醇、乙醇,不溶于甘油。实验步骤如下:I.废铁屑的净化:取一只小烧杯,放入约5g废铁屑,向其中注入15mLlmol/L
 溶液,浸泡数分钟后,分离出铁屑,洗净、晾干。
溶液,浸泡数分钟后,分离出铁屑,洗净、晾干。II.
 溶液的制备:将处理后的废铁屑加入装置B的三颈烧瓶中,缓慢加入适当过量的稀盐酸,得到含
溶液的制备:将处理后的废铁屑加入装置B的三颈烧瓶中,缓慢加入适当过量的稀盐酸,得到含 的混合液。
的混合液。III.
 溶液的制备:由装置A制备氯气;向
溶液的制备:由装置A制备氯气;向 的混合液中缓慢通入足量的氯气。
的混合液中缓慢通入足量的氯气。IV.
 产品的分离提纯:将三颈烧瓶中的
产品的分离提纯:将三颈烧瓶中的 混合液转移出来,经蒸发浓缩、冷却结晶、过滤、洗涤、重结晶、干燥,得到
混合液转移出来,经蒸发浓缩、冷却结晶、过滤、洗涤、重结晶、干燥,得到 产品。
产品。V.
 产品的纯度测定:用碘量法滴定并计算。
产品的纯度测定:用碘量法滴定并计算。对于上述实验,对各步骤分析不正确的是
A.步骤I, 溶液适当加热效果更好 溶液适当加热效果更好 |
| B.步骤II,稀盐酸适当过量目的是使铁屑完全溶解,并抑制Fe²水解 |
| C.步骤III,可以通过三颈烧瓶中开始冒出气泡,判断氯气已过量 |
| D.步骤IV,向冷却结晶后浊液中加入甘油以便于晶体析出 |
您最近一年使用:0次
2024-01-21更新
|
191次组卷
|
4卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高二上学期1月期末化学试题
名校
10 . 为除去 酸性溶液中的
酸性溶液中的 ,可在加热搅拌的条件下加入的一种试剂是
,可在加热搅拌的条件下加入的一种试剂是
 酸性溶液中的
酸性溶液中的 ,可在加热搅拌的条件下加入的一种试剂是
,可在加热搅拌的条件下加入的一种试剂是A. | B.NaOH | C. | D. |
您最近一年使用:0次
2024-01-15更新
|
39次组卷
|
3卷引用:江西省宜春市丰城市东煌学校2023-2024学年高二上学期1月期末化学试题



