1 . 下列应用与盐类水解无关的是
| A.用纯碱去油污时,加热可以增强去污效果 | B.用醋酸除去茶壶里的水垢 |
| C.草木灰与铵盐不能混合使用 | D.饱和氯化铁溶液滴入沸水中制备胶体 |
您最近半年使用:0次
解题方法
2 . 化学与生活生产密切相关。下列说法正确的是
| A.“84”消毒液与洁厕灵(主要成分HCl)混合增强消毒效果 |
| B.利用高纯度单质硅可以制成太阳能光伏电池 |
| C.泡沫灭火器可用于一般的起火,也适用于电器起火 |
| D.盐碱地(含较多Na2CO3)不利于作物生长,可施加生石灰进行改良 |
您最近半年使用:0次
解题方法
3 . 化学与人体健康及生产、生活息息相关。下列叙述正确的是
| A.常用的食品添加剂有蔗糖、醋、二氧化硫、苯甲酸等 |
| B.直馏汽油、裂化汽油、植物油均能使溴的四氯化碳溶液褪色 |
| C.“井水不犯河水”说明井水与河水中含有两种完全不同的水 |
| D.古代造纸工艺中使用草木灰会导致纸张发生酸性腐蚀 |
您最近半年使用:0次
4 . 化学与生产、生活、科技、环境等关系密切。下列说法正确的是
| A.热的纯碱溶液具有除去油污和消毒杀菌的作用 |
| B.工业合成氨,常采用将NH3液化分离的方法来提高原料的转化率 |
| C.制造焊锡时,把铅加入锡,形成原电池,从而增加锡的抗腐蚀能力 |
D.泡沫灭火器的反应原理:2Al3++3 +3H2O=2Al(OH)3↓+3CO2↑ +3H2O=2Al(OH)3↓+3CO2↑ |
您最近半年使用:0次
名校
5 . 下列事实不能用勒夏特列原理解释的是
| A.将FeCl3溶液加热蒸干不能得到FeCl3固体 |
| B.合成氨工业采用高温条件能使平衡移动从而提高生产效率 |
| C.合成氨工业上增大压强以提高反应物的转化率 |
| D.在漂白液中加入适量盐酸能增强其漂白效果 |
您最近半年使用:0次
名校
6 . 二氧化钛(TiO2)是一种重要的工业原料,可用四氯化钛(TiCl4)制备。已知:
I.TiCl4(g)+O2(g) TiO2(s)+2Cl2(g) ΔH1=-178.4kJ•mol-1
TiO2(s)+2Cl2(g) ΔH1=-178.4kJ•mol-1
II.2C(s)+O2(g) 2CO(g) ΔH2=-219.9kJ•mol-1
2CO(g) ΔH2=-219.9kJ•mol-1
请回答下列问题:
(1)TiCl4(g)与CO(g)反应生成TiO2(s)、C(s)和氯气的热化学方程式为_______ 。
(2)t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2,发生反应I。4min达到平衡时测得TiO2的物质的量为0.2mol。
①0~4min内,用Cl2表示的反应速率v(Cl2)=_______ 。
②TiCl4的平衡转化率α=_______ 。
③下列措施,既能加快反应速率又能增大TiCl4平衡转化率的是_______ (填选项字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大O2浓度 E.降低温度
④t℃时,向10L恒容密闭容器中充入4molTiCl4和一定量O2的混合气体,发生反应I,两种气体的平衡转化率(α)与起始的物质的量之比[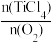 ]的关系如图所示:
]的关系如图所示:
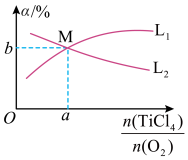
能表示TiCl4平衡转化率的曲线为_______ (填“L1”或“L2”);M点的坐标为_______ 。
(3)也可以利用四氯化钛(TiCl4)水解制备TiO2,该反应的方程为:_______ 。
I.TiCl4(g)+O2(g)
 TiO2(s)+2Cl2(g) ΔH1=-178.4kJ•mol-1
TiO2(s)+2Cl2(g) ΔH1=-178.4kJ•mol-1II.2C(s)+O2(g)
 2CO(g) ΔH2=-219.9kJ•mol-1
2CO(g) ΔH2=-219.9kJ•mol-1请回答下列问题:
(1)TiCl4(g)与CO(g)反应生成TiO2(s)、C(s)和氯气的热化学方程式为
(2)t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2,发生反应I。4min达到平衡时测得TiO2的物质的量为0.2mol。
①0~4min内,用Cl2表示的反应速率v(Cl2)=
②TiCl4的平衡转化率α=
③下列措施,既能加快反应速率又能增大TiCl4平衡转化率的是
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大O2浓度 E.降低温度
④t℃时,向10L恒容密闭容器中充入4molTiCl4和一定量O2的混合气体,发生反应I,两种气体的平衡转化率(α)与起始的物质的量之比[
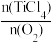 ]的关系如图所示:
]的关系如图所示:
能表示TiCl4平衡转化率的曲线为
(3)也可以利用四氯化钛(TiCl4)水解制备TiO2,该反应的方程为:
您最近半年使用:0次
解题方法
7 . 一种利用废旧三元锂离子电池分步回收金属的实验流程如下:
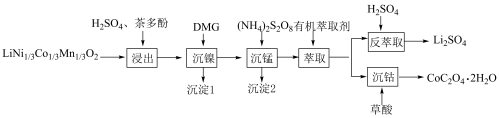
已知:
① 中元素
中元素 、
、 、
、 的价态分别为+1、+2、+3;
的价态分别为+1、+2、+3;
②室温下,几种金属离子形成氢氧化物沉淀的 如下表:
如下表:
③DMG的结构为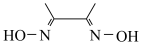 ;
;
④金属离子与有机萃取剂TBP结合能力为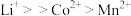 ,与P507的结合能力为
,与P507的结合能力为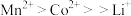 。
。
回答下列问题:
(1) 中锰元素的化合价是
中锰元素的化合价是___________ 。
(2) 可表示为LNCM,充放电时
可表示为LNCM,充放电时 分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的
分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的___________ (填“正极”或“负极”)材料。
(3)“浸出”后的溶液中过渡金属离子的化合价均为+2,茶多酚的作用是___________ 。
(4)沉淀1为 ,“沉镍”过程主要反应的离子方程式是
,“沉镍”过程主要反应的离子方程式是___________ (DMG用化学式表示),该过程中应控制溶液的 ,理论上最佳的
,理论上最佳的 不超过
不超过___________ (填序号),原因是___________ 。
A.7.2 B.8.1 C.8.7 D.10.1
(5)沉淀2为 ,“沉锰”过程主要反应的离子方程式是
,“沉锰”过程主要反应的离子方程式是___________ 。
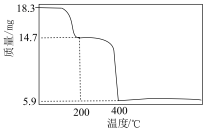
(6)有机萃取剂应选择___________ (填“TBP”或“P507”),利用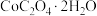 的热重图进行计算,可知400℃时的固体成分是
的热重图进行计算,可知400℃时的固体成分是___________ (填化学式)。

已知:
①
 中元素
中元素 、
、 、
、 的价态分别为+1、+2、+3;
的价态分别为+1、+2、+3;②室温下,几种金属离子形成氢氧化物沉淀的
 如下表:
如下表:| 金属离子 |  |  |  |
开始沉淀 | 8.1 | 7.2 | 7.2 |
完全沉淀 | 10.1 | 8.7 | 8.7 |
 ;
;④金属离子与有机萃取剂TBP结合能力为
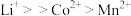 ,与P507的结合能力为
,与P507的结合能力为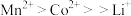 。
。回答下列问题:
(1)
 中锰元素的化合价是
中锰元素的化合价是(2)
 可表示为LNCM,充放电时
可表示为LNCM,充放电时 分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的
分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的(3)“浸出”后的溶液中过渡金属离子的化合价均为+2,茶多酚的作用是
(4)沉淀1为
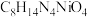 ,“沉镍”过程主要反应的离子方程式是
,“沉镍”过程主要反应的离子方程式是 ,理论上最佳的
,理论上最佳的 不超过
不超过A.7.2 B.8.1 C.8.7 D.10.1
(5)沉淀2为
 ,“沉锰”过程主要反应的离子方程式是
,“沉锰”过程主要反应的离子方程式是(6)有机萃取剂应选择
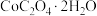 的热重图进行计算,可知400℃时的固体成分是
的热重图进行计算,可知400℃时的固体成分是
您最近半年使用:0次
名校
8 . 在日常生产生活中,经常涉及化学反应原理,下列过程或现象与盐类水解无关的是
| A.加热氯化铁溶液,颜色变深 |
B. 与 与 溶液可用作焊接金属时的除锈剂 溶液可用作焊接金属时的除锈剂 |
| C.氯化钙溶液中滴加甲基橙,溶液显黄色 |
D.实验室中盛放 溶液的试剂瓶不能用磨口玻璃塞 溶液的试剂瓶不能用磨口玻璃塞 |
您最近半年使用:0次
2024-03-09更新
|
171次组卷
|
2卷引用:云南省昆明市云南师范大学实验中学2023-2024学年高二下学期3月月考化学试题
解题方法
9 . 随着对有色金属需求的高速增长及冶炼技术的发展,钢铁行业的瓦斯泥也从昔日无序丢弃的大宗固体废物变成了今日抢手的资源。昆钢的技术员设计以瓦斯泥(主要含ZnO、Bi2O3、Bi2S3、Bi、Fe2O3还含少量PbO、FeO、CuO)为原料提取锌、铋的工艺流程如图所示:
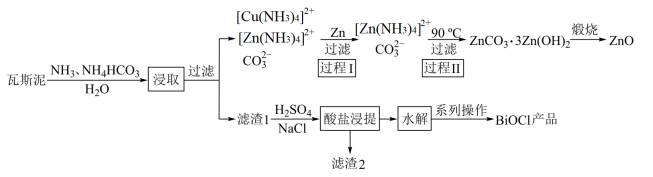
回答下列问题:
(1)“浸取”步骤,为避免“瓦斯泥”在反应器的底部沉淀结块,可采取的措施为______ 。
(2)配离子[Cu(NH3)4]2+中,______ 接受孤电子对,其中电负性最大的基态原子的价层电子排布图为_______ 。“过程I”步骤发生反应的离子方程式为______ 。
(3)“过程II”步骤产生的气体______ (填电子式),可在流程的______ 步骤中循环使用。
(4)“滤渣2”的主要成分除S外还有______ 。
(5)已知:此工艺中,Bi3+水解得到BiOCl沉淀的适宜pH范围为1.6-2.0;溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
①结合上述信息分析,“水解”步骤加入适量Zn粉的目的是______ 。
②“水解”步骤后的“系列操作”为______ 。

回答下列问题:
(1)“浸取”步骤,为避免“瓦斯泥”在反应器的底部沉淀结块,可采取的措施为
(2)配离子[Cu(NH3)4]2+中,
(3)“过程II”步骤产生的气体
(4)“滤渣2”的主要成分除S外还有
(5)已知:此工艺中,Bi3+水解得到BiOCl沉淀的适宜pH范围为1.6-2.0;溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 7.0 | 1.9 | 6.2 |
| 完全沉淀时pH | 9.0 | 3.2 | 8.0 |
②“水解”步骤后的“系列操作”为
您最近半年使用:0次
名校
解题方法
10 . 下列实验事实不能用勒夏特列原理来解释的是
A.用 与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉 与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉 |
B.向 溶液中加入铁粉,溶液颜色变浅 溶液中加入铁粉,溶液颜色变浅 |
C.配制 溶液时将 溶液时将 晶体溶在浓盐酸中再加水稀释到所需浓度 晶体溶在浓盐酸中再加水稀释到所需浓度 |
D.用 溶液清洗油污时,加热可以增强去污效果 溶液清洗油污时,加热可以增强去污效果 |
您最近半年使用:0次
2024-02-26更新
|
105次组卷
|
2卷引用:云南省大理州民族中学2023-2024学年高二下学期见面考化学试题



