一种利用废旧三元锂离子电池分步回收金属的实验流程如下:
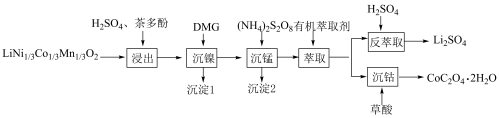
已知:
① 中元素
中元素 、
、 、
、 的价态分别为+1、+2、+3;
的价态分别为+1、+2、+3;
②室温下,几种金属离子形成氢氧化物沉淀的 如下表:
如下表:
③DMG的结构为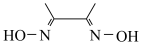 ;
;
④金属离子与有机萃取剂TBP结合能力为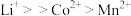 ,与P507的结合能力为
,与P507的结合能力为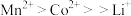 。
。
回答下列问题:
(1) 中锰元素的化合价是
中锰元素的化合价是___________ 。
(2) 可表示为LNCM,充放电时
可表示为LNCM,充放电时 分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的
分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的___________ (填“正极”或“负极”)材料。
(3)“浸出”后的溶液中过渡金属离子的化合价均为+2,茶多酚的作用是___________ 。
(4)沉淀1为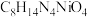 ,“沉镍”过程主要反应的离子方程式是
,“沉镍”过程主要反应的离子方程式是___________ (DMG用化学式表示),该过程中应控制溶液的 ,理论上最佳的
,理论上最佳的 不超过
不超过___________ (填序号),原因是___________ 。
A.7.2 B.8.1 C.8.7 D.10.1
(5)沉淀2为 ,“沉锰”过程主要反应的离子方程式是
,“沉锰”过程主要反应的离子方程式是___________ 。
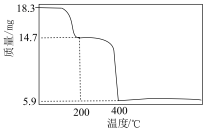
(6)有机萃取剂应选择___________ (填“TBP”或“P507”),利用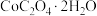 的热重图进行计算,可知400℃时的固体成分是
的热重图进行计算,可知400℃时的固体成分是___________ (填化学式)。

已知:
①
 中元素
中元素 、
、 、
、 的价态分别为+1、+2、+3;
的价态分别为+1、+2、+3;②室温下,几种金属离子形成氢氧化物沉淀的
 如下表:
如下表:| 金属离子 |  |  |  |
开始沉淀 | 8.1 | 7.2 | 7.2 |
完全沉淀 | 10.1 | 8.7 | 8.7 |
 ;
;④金属离子与有机萃取剂TBP结合能力为
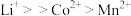 ,与P507的结合能力为
,与P507的结合能力为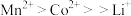 。
。回答下列问题:
(1)
 中锰元素的化合价是
中锰元素的化合价是(2)
 可表示为LNCM,充放电时
可表示为LNCM,充放电时 分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的
分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的(3)“浸出”后的溶液中过渡金属离子的化合价均为+2,茶多酚的作用是
(4)沉淀1为
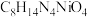 ,“沉镍”过程主要反应的离子方程式是
,“沉镍”过程主要反应的离子方程式是 ,理论上最佳的
,理论上最佳的 不超过
不超过A.7.2 B.8.1 C.8.7 D.10.1
(5)沉淀2为
 ,“沉锰”过程主要反应的离子方程式是
,“沉锰”过程主要反应的离子方程式是(6)有机萃取剂应选择
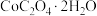 的热重图进行计算,可知400℃时的固体成分是
的热重图进行计算,可知400℃时的固体成分是
更新时间:2024-03-23 18:57:26
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】硫代尿素也称硫脲[CS(NH2)2]是一种白色晶体,熔点180℃,易溶于水和乙醇,受热时部分发生异构化反应而生成硫氰化铵,可用于制造药物,也可用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
Ⅰ.硫脲的制备:
已知:将石灰氮( )和水的混合物加热至80℃时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,实验装置如图所示。
)和水的混合物加热至80℃时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,实验装置如图所示。_______ 。
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
(2)仪器M的名称为_______ 。按(2)中所选试剂组合,按气流从左到右的方向,上述装置的合理连接顺序为c→_______ (填仪器接口的小写字母)
(3)装置C中反应的化学方程式为_______ 。
Ⅱ.硫脲的分离及产品含量的测定:
(4)装置C反应后的液体过滤后,将滤液减压蒸发浓缩,之后冷却结晶,离心分离,烘干即可得到产品。称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol/L 标准溶液滴定,滴定至终点时消耗
标准溶液滴定,滴定至终点时消耗 标准溶液VmL(已知
标准溶液VmL(已知
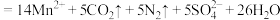 )。
)。
①硫脲 [CS(NH2)2]中硫元素的化合价为_______ 价。
②样品中硫脲的质量分数为_______ (用含“m、c、V的式子表示)。
Ⅰ.硫脲的制备:
已知:将石灰氮(
 )和水的混合物加热至80℃时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,实验装置如图所示。
)和水的混合物加热至80℃时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,实验装置如图所示。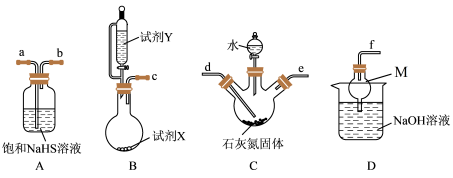
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
(2)仪器M的名称为
(3)装置C中反应的化学方程式为
Ⅱ.硫脲的分离及产品含量的测定:
(4)装置C反应后的液体过滤后,将滤液减压蒸发浓缩,之后冷却结晶,离心分离,烘干即可得到产品。称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol/L
 标准溶液滴定,滴定至终点时消耗
标准溶液滴定,滴定至终点时消耗 标准溶液VmL(已知
标准溶液VmL(已知
 )。
)。①硫脲 [CS(NH2)2]中硫元素的化合价为
②样品中硫脲的质量分数为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】过氧化尿素是一种无毒、无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下流程:
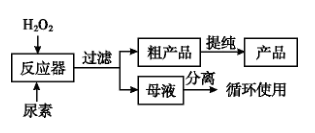
原理: CO(NH2)2+H2O2 CO(NH2)2·H2O2,已知降低系统压力可降低液体沸点,回答下列问题:
CO(NH2)2·H2O2,已知降低系统压力可降低液体沸点,回答下列问题:
(1)实际生产中需控制合成温度为25 ~30°C,其主要原因是_______ 。
(2)若欲从母液中分离出H2O2和尿素,可采用的操作是_______(填字母)。
(3)为测定产品中活性氧的含量(活性氧16%相当于H2O2 34%),称取干燥样品4.000g,溶解,在250mL容量瓶中定容。准确量取25mL于锥形瓶中,加入2mL6.0mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液16.00mL(已知KMnO4溶液与尿素不反应)。
①写出酸性KMnO4与H2O2反应的离子方程式:_______
②根据下图读出滴定后KMnO4溶液体积为_______ mL。

③若滴定前仰视读数,会使测得的活性氧含量_______ (填“偏高”“偏低”或“不变”)。滴定过程中判断终点的依据是_______ 。
④根据滴定结果,可确定产品中活性氧的质量百分数为_______ 。

原理: CO(NH2)2+H2O2
 CO(NH2)2·H2O2,已知降低系统压力可降低液体沸点,回答下列问题:
CO(NH2)2·H2O2,已知降低系统压力可降低液体沸点,回答下列问题:(1)实际生产中需控制合成温度为25 ~30°C,其主要原因是
(2)若欲从母液中分离出H2O2和尿素,可采用的操作是_______(填字母)。
| A.盐析、过滤 | B.分液、过滤 |
| C.减压蒸馏、结晶 | D.减压蒸馏、萃取 |
①写出酸性KMnO4与H2O2反应的离子方程式:
②根据下图读出滴定后KMnO4溶液体积为

③若滴定前仰视读数,会使测得的活性氧含量
④根据滴定结果,可确定产品中活性氧的质量百分数为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】海带中含有丰富的碘,某校化学兴趣小组的同学们设计联合氯碱工业,以海带灰为原料提碘的工艺流程如图:
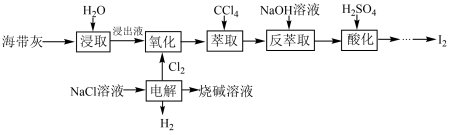
回答下列问题:
(1)“浸取”操作需要进行2~3次,将所得浸取液合并后进入下一流程,其目的是_____ ;请你设计实验证明“浸取”已经进行完全:_____ (需要用到的实验药品有:淀粉溶液、硫酸酸化的H2O2溶液,写出具体实验操作和现象)。
(2)“电解”反应的化学方程式为_____ 。
(3)“萃取”时,CCl4层的颜色为______ 色;“反萃取”时生成NaI和NaIO3,写出该反应的离子方程式:______ 。
(4)“酸化”后生成含I2的悬浊液,需要经过_____ (填操作名称)操作得到I2。
(5)该工艺流程实际操作中,碘的损失率为23.8%。若以2.5t海带灰为原料,最终制得I2物质的量为3×103mol,则该原料中含碘量为______ %
(6)该工艺流程中,除了H2O和NaCl以外,可以循环利用的物质有_____ (填化学式)。

回答下列问题:
(1)“浸取”操作需要进行2~3次,将所得浸取液合并后进入下一流程,其目的是
(2)“电解”反应的化学方程式为
(3)“萃取”时,CCl4层的颜色为
(4)“酸化”后生成含I2的悬浊液,需要经过
(5)该工艺流程实际操作中,碘的损失率为23.8%。若以2.5t海带灰为原料,最终制得I2物质的量为3×103mol,则该原料中含碘量为
(6)该工艺流程中,除了H2O和NaCl以外,可以循环利用的物质有
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铟(In)作为种稀有贵金属在很多高新领域有广泛应用,随着铟的应用越来越广泛,人类对铟的需求量日益增加,有效富集回收铟的技术也越来越受到重视。回收处理含铟废渣[In的质量分数为9.8%,同时含有FeCl3、SiO2、SnO、Tl(OH)3杂质]是提高铟回收率的主要途径之一。
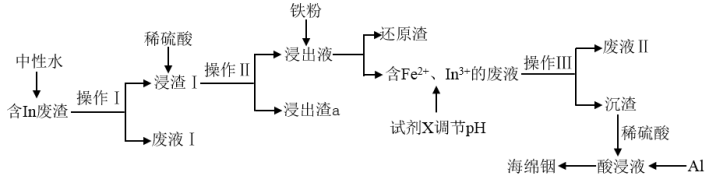
提示:①溶液中一些金属离子水解生成氢氧化物沉淀时的pH如表:
②“浸渣1”的主要成分为SnO、Tl(OH)3、SiO2、Fe(OH)3、In(OH)3。
(1)"操作III”的名称为__ 。
(2)"浸出渣a"的主要成分为__ (填化学式)。
(3)加入铁粉净化的最佳工艺控制溶液中硫酸含量为68.6g·L-1,则此时硫酸的物质的量浓度为__ mol·L-1,还原渣”的主要成分为Tl和Sn,写出反应生成Tl的离子方程式:__ 。
(4)加入试剂X调节pH的范围为__ 至__ ,可选择的试剂X为__ (填标号)。
A.Fe2O3 B.FeCO3 C.稀硫酸 D.稀硝酸
(5)“沉渣"中加入稀硫酸发生反应的化学方程式为__ 。
(6)通过加入铝置换出的海绵铟中铟的质量分数达到96.04%。通过以上途径回收铟的总损耗率约为2%,回收效率非常高。某企业每月可产生此种含铟废渣1600kg,利用上述技术手段,理论上可获得海绵铟的质量为__ kg。

提示:①溶液中一些金属离子水解生成氢氧化物沉淀时的pH如表:
金属离子 | Fe3+ | In3+ | Fe2+ |
开始沉淀pH | 2.0 | 2.9 | 7.15 |
沉淀完全pH | 3.2 | 5.0 | 8.15 |
(1)"操作III”的名称为
(2)"浸出渣a"的主要成分为
(3)加入铁粉净化的最佳工艺控制溶液中硫酸含量为68.6g·L-1,则此时硫酸的物质的量浓度为
(4)加入试剂X调节pH的范围为
A.Fe2O3 B.FeCO3 C.稀硫酸 D.稀硝酸
(5)“沉渣"中加入稀硫酸发生反应的化学方程式为
(6)通过加入铝置换出的海绵铟中铟的质量分数达到96.04%。通过以上途径回收铟的总损耗率约为2%,回收效率非常高。某企业每月可产生此种含铟废渣1600kg,利用上述技术手段,理论上可获得海绵铟的质量为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110∼120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为________________________________________ 。
(2)加入碳酸钠调节pH至a,a的范围是________________________ ;
(3)操作Ⅰ包含3个基本实验操作,它们是_______ 、__________ 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是______________________ 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_______________________ 。
(6)在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解于乙醚中,除去不溶性杂质后,再进行___________________________________ 。

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110∼120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为
(2)加入碳酸钠调节pH至a,a的范围是
(3)操作Ⅰ包含3个基本实验操作,它们是
(4)制得的CoCl2·6H2O需减压烘干的原因是
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
(6)在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解于乙醚中,除去不溶性杂质后,再进行
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】根据要求回答下列问题。
(1)常温下,将某一元酸HA(甲、乙代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
从甲组实验结果分析,该混合溶液中离子浓度由大到小的顺序是___________ 。
(2)pH相同的①NaCN ②NaClO ③Na2S三种溶液,其物质的量浓度由大到小的顺序为___________ (填序号)。(已知:弱酸的电离平衡常数HCN:Ka=4×10-10;H2S:Ka1=1×10-7,Ka2=7×10-15;HClO:Ka=3×10-8 )
(3)可溶性铝盐常用作净水剂的原因:_______ (用离子方程式表示)。
(4)在常温下,0.1 mol﹒L-1一元酸HB溶液的 ,常温下,有c(H+)相同、体积相同的盐酸和酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
,常温下,有c(H+)相同、体积相同的盐酸和酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是______ (填字母)。(①表示盐酸,②表示HB)
a.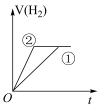 b.
b.  c.
c. 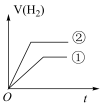 d.
d.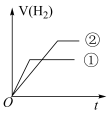
(5)相同物质的量浓度的五种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4 ④NH4Cl ⑤(NH4)2Fe(SO4)2 ,c( )由大到小顺序是
)由大到小顺序是___________ (用序号表示)。
(6)常温下,将0.2molH2C2O4加入300ml2mol/L的NaOH溶液中(假设溶液的体积不变),所得溶液的pH=a,则c(C2O )+2c(HC2O
)+2c(HC2O )+3c(H2C2O4)=
)+3c(H2C2O4)=_____ mol/L(用含a的代数式表示)。
(1)常温下,将某一元酸HA(甲、乙代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | 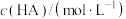 | 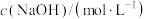 | 混合溶液的pH |
| 甲 | 0.2 | 0.1 | >7 |
| 乙 | 0.1 | 0.1 | =10 |
(2)pH相同的①NaCN ②NaClO ③Na2S三种溶液,其物质的量浓度由大到小的顺序为
(3)可溶性铝盐常用作净水剂的原因:
(4)在常温下,0.1 mol﹒L-1一元酸HB溶液的
 ,常温下,有c(H+)相同、体积相同的盐酸和酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
,常温下,有c(H+)相同、体积相同的盐酸和酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是a.
 b.
b.  c.
c.  d.
d.
(5)相同物质的量浓度的五种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4 ④NH4Cl ⑤(NH4)2Fe(SO4)2 ,c(
 )由大到小顺序是
)由大到小顺序是(6)常温下,将0.2molH2C2O4加入300ml2mol/L的NaOH溶液中(假设溶液的体积不变),所得溶液的pH=a,则c(C2O
 )+2c(HC2O
)+2c(HC2O )+3c(H2C2O4)=
)+3c(H2C2O4)=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径。
Ⅰ.氢能是理想的能源之一。回答下列问题:
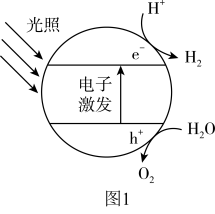
(1)利用太阳能催化光解水是制备 的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为
的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为_______ 。
(2)在高温时,水蒸气与灼热的炭反应也能制得 。该反应的能量变化如图2所示。
。该反应的能量变化如图2所示。
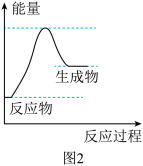
①该反应为_______ (填“吸热”或“放热”)反应。下列有关该反应的说法正确的是_______ (填字母)。
a.反应物的总能量高于产物的总能量
b.该反应过程中化学能全部转化为热能
c.该反应属于氧化还原反应
d.反应过程中,化学键的断裂与形成是化学反应中能量变化的主要原因
② 、
、 、C都是常用的燃料。
、C都是常用的燃料。 、
、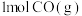 、
、 完全燃烧生成
完全燃烧生成 或
或 时,放出的热量分别为
时,放出的热量分别为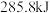 、
、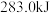 、
、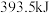 。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为
。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为_______ (用化学式表示)。
Ⅱ.原电池是将化学能转化为电能的一种装置。
常温下,将除去表面氧化膜的铝片、铜片插入浓 中组成原电池,装置如图甲所示,测得原电池的电流强度
中组成原电池,装置如图甲所示,测得原电池的电流强度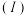 随时间
随时间 的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。
的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。

(3)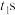 后,原电池的铜片是
后,原电池的铜片是_______ (填“正”或“负”)极,其电极反应式为_______ ,溶液中的 向
向_______ (填“正”或“负”)极移动。
Ⅰ.氢能是理想的能源之一。回答下列问题:
(1)利用太阳能催化光解水是制备
 的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为
的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为
(2)在高温时,水蒸气与灼热的炭反应也能制得
 。该反应的能量变化如图2所示。
。该反应的能量变化如图2所示。
①该反应为
a.反应物的总能量高于产物的总能量
b.该反应过程中化学能全部转化为热能
c.该反应属于氧化还原反应
d.反应过程中,化学键的断裂与形成是化学反应中能量变化的主要原因
②
 、
、 、C都是常用的燃料。
、C都是常用的燃料。 、
、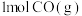 、
、 完全燃烧生成
完全燃烧生成 或
或 时,放出的热量分别为
时,放出的热量分别为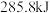 、
、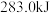 、
、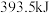 。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为
。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为Ⅱ.原电池是将化学能转化为电能的一种装置。
常温下,将除去表面氧化膜的铝片、铜片插入浓
 中组成原电池,装置如图甲所示,测得原电池的电流强度
中组成原电池,装置如图甲所示,测得原电池的电流强度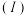 随时间
随时间 的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。
的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。
(3)
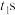 后,原电池的铜片是
后,原电池的铜片是 向
向
您最近半年使用:0次
【推荐2】下图是一种太阳能电池工作原理的示意图,其中电解质溶液为K3[Fe(CN)6]和K4[Fe(CN)6]的混合溶液。___________ 。
(2)电池工作时,下列描述正确的是___________。
(3)正极上发生的电极反应为___________ 。
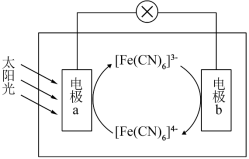
(2)电池工作时,下列描述正确的是___________。
| A.电极a为正极 | B.K+向电极a移动 |
| C.电子由电极a经导线流向电极b | D.电极b上发生氧化反应 |
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】海水中有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如图所示:
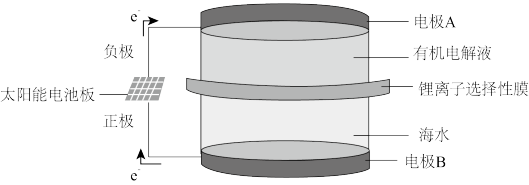
(1)①金属锂在电极_____ (填“A”或“B”)上生成,发生的是_________ 反应(填氧化或还原)。
②阳极产生两种气体单质,电极反应式分别是__________________ ;_______________ ;
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2↑(SOCl2是共价化合物)请回答下列问题:
①电池的负极材料为______ ,发生的电极反应为______________ 。
②电池正极发生的电极反应为______________________ 。
(3)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2固体
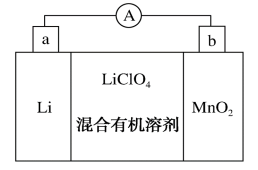
b 的电极反应为:____________________

(1)①金属锂在电极
②阳极产生两种气体单质,电极反应式分别是
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2↑(SOCl2是共价化合物)请回答下列问题:
①电池的负极材料为
②电池正极发生的电极反应为
(3)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2固体

b 的电极反应为:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】海洋是地球的“聚宝盆”,开发和利用海洋资源意义重大。下图是从海水资源获取某些重要化工原料的流程示意图。

(1)步骤①中,除去粗盐中泥沙,可采用___________ (填操作名称)。
(2)提纯的粗盐含有Ca2+、Mg2+、 等杂质,步骤②中添加试剂的顺序可以是___________。
等杂质,步骤②中添加试剂的顺序可以是___________。
(3)配制100mL0.10mol/LNaCl溶液。不需要用到的仪器有___________ 。(选填编号)
①电子天平②胶头滴管③分液漏斗④100mL容量瓶⑤烧杯⑥玻璃棒
(4)下列操作可能使上述溶液配制浓度偏低的是___________。
(5)上世纪30年代。吴蕴初研发了通过电解饱和食盐水。获得了生产盐酸、烧碱和漂白粉的工艺,创办了天原电化厂。写出电解饱和食盐水的离子方程式___________ 。
(6)下列图中白球代表通过步骤③得到的“?”原子、黑球代表氦原子。方框代表容器。容器中有一个可以上下滑动的隔板(隔板质量不计)。其中能表示等质量的“?”气体与氦气的___________。
(7)加碘食盐中常添加碘酸钾(KIO3)。研究小组测定加碘盐中碘含量的步骤为:
①准确称取mg食盐,加适量蒸馏水使其完全溶解。
②再用稀硫酸酸化所得溶液,加入足量KI溶液充分反应。
③最后加入10.0mL6.0×10-3mol/LNa2S2O3溶液恰好反应完全。
已知: +5I-+6H+=3I2+3H2O;I2+2
+5I-+6H+=3I2+3H2O;I2+2 =2I-+
=2I-+ 。
。
上述加碘盐中碘含量(以碘元素计)为___________ g/kg(用m表示)。

(1)步骤①中,除去粗盐中泥沙,可采用
(2)提纯的粗盐含有Ca2+、Mg2+、
 等杂质,步骤②中添加试剂的顺序可以是___________。
等杂质,步骤②中添加试剂的顺序可以是___________。| A.Na2CO3溶液、BaCl2溶液、NaOH溶液、盐酸 |
| B.BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸 |
| C.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸 |
| D.NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸 |
(3)配制100mL0.10mol/LNaCl溶液。不需要用到的仪器有
①电子天平②胶头滴管③分液漏斗④100mL容量瓶⑤烧杯⑥玻璃棒
(4)下列操作可能使上述溶液配制浓度偏低的是___________。
| A.容量瓶中有少量蒸馏水,未烘干 | B.未洗涤烧杯内壁和玻璃棒 |
| C.转移到容量瓶时,有少量液体溅出 | D.定容时,仰视刻度线 |
(5)上世纪30年代。吴蕴初研发了通过电解饱和食盐水。获得了生产盐酸、烧碱和漂白粉的工艺,创办了天原电化厂。写出电解饱和食盐水的离子方程式
(6)下列图中白球代表通过步骤③得到的“?”原子、黑球代表氦原子。方框代表容器。容器中有一个可以上下滑动的隔板(隔板质量不计)。其中能表示等质量的“?”气体与氦气的___________。
A.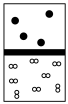 | B.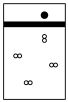 | C.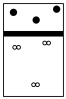 | D.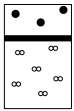 |
(7)加碘食盐中常添加碘酸钾(KIO3)。研究小组测定加碘盐中碘含量的步骤为:
①准确称取mg食盐,加适量蒸馏水使其完全溶解。
②再用稀硫酸酸化所得溶液,加入足量KI溶液充分反应。
③最后加入10.0mL6.0×10-3mol/LNa2S2O3溶液恰好反应完全。
已知:
 +5I-+6H+=3I2+3H2O;I2+2
+5I-+6H+=3I2+3H2O;I2+2 =2I-+
=2I-+ 。
。上述加碘盐中碘含量(以碘元素计)为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某研究性学习小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产提取镁,主要过程如下:
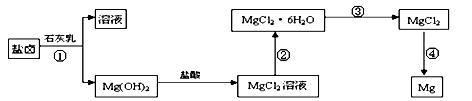
回答下列问题:
(1)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有________ 饱和溶液的烧杯中,充分搅拌后经______ 、______ (填操作方法)可得纯净的Mg(OH)2。写出有关反应的离子方程式__________ 。
(2)右图是该研究性学习小组设计进行过程③的实验装置图。其中装置A的作用是_______ 。
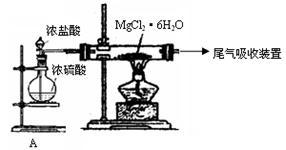
若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是________________ 。
(3)写出过程④中发生反应的化学方程式_______________ 。

回答下列问题:
(1)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有
(2)右图是该研究性学习小组设计进行过程③的实验装置图。其中装置A的作用是

若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是
(3)写出过程④中发生反应的化学方程式
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4·7H2O的流程如下。

相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
(1)“滤渣1”的主要成分为_________ (填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________ (填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________ 。
(3)“氧化”一步中,发生氧化还原反应的离子方程式为_______________________ 。溶液pH控制在[3.2,6.4)之间的目的是_______________________________ 。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
(5)ZnSO4·7H2O可用于配制铁件上镀锌电镀池的电解液,下列说法不正确的是_______
A.配制一定物质的量浓度ZnSO4溶液时必需的玻璃仪器为容量瓶、烧杯、玻璃棒
B.电镀池的阳极为铁件
C.阴极质量增加65g时,理论上导线中通过2mol电子
D.电镀过程中电解质溶液的浓度不变

相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为
(3)“氧化”一步中,发生氧化还原反应的离子方程式为
(4)“母液”中含有的盐类物质有
(5)ZnSO4·7H2O可用于配制铁件上镀锌电镀池的电解液,下列说法不正确的是
A.配制一定物质的量浓度ZnSO4溶液时必需的玻璃仪器为容量瓶、烧杯、玻璃棒
B.电镀池的阳极为铁件
C.阴极质量增加65g时,理论上导线中通过2mol电子
D.电镀过程中电解质溶液的浓度不变
您最近半年使用:0次



