1 . 下列说法不正确的是
| A.Ksp只能与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.①0.01mol/L的盐酸,②0.01mol/L的醋酸溶液。将①和②均稀释100倍,稀释后的溶液的pH:①>② |
| D.两种难溶电解质,Ksp越小的电解质,其溶解度不一定小 |
您最近一年使用:0次
名校
2 . 下列说法正确的是
| A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B.25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸) >V(NaOH) |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D.在由水电离的c(H+) = 1×10—12 mol/L的溶液中:NO3—、Na+、Cl—、MnO4—一定能大量共存 |
您最近一年使用:0次
2017-11-17更新
|
183次组卷
|
2卷引用:江西省临川第二中学2017-2018学年高二上学期期中考试化学试题
名校
3 . 一种测定水样中溴离子的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1 mL c1 mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2 mol·L-1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL 。
(已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-= AgSCN(白色)↓,Ksp(AgSCN)=1×10-12),下列说法不正确的是
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1 mL c1 mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2 mol·L-1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL 。
(已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-= AgSCN(白色)↓,Ksp(AgSCN)=1×10-12),下列说法不正确的是
| A.滴定终点时,溶液变为红色 |
| B.该滴定法需在碱性条件下进行 |
C.AgBr(s)+SCN- AgSCN(s)+Br-(aq)的平衡常数K=0.77 AgSCN(s)+Br-(aq)的平衡常数K=0.77 |
| D.该水样中溴离子浓度为:c(Br-)=(c1V1-c2V2)/25.00mol/L |
您最近一年使用:0次
2017-05-23更新
|
510次组卷
|
6卷引用:江西省南昌市第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
4 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题。
(1)生活中明矾常作净水剂,其净水的原理是_____________ (用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________ 。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
①该溶液中c(H2A)_______________ c(A2-)(填“>”、“<”或“=”)
②作出上述判断的依据是_____________ (用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
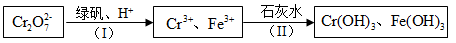
绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________ 。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=___________ 。{Ksp[Cr(OH)3]=6.0×10-31}
(1)生活中明矾常作净水剂,其净水的原理是
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
①该溶液中c(H2A)
②作出上述判断的依据是
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
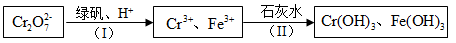
绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=
您最近一年使用:0次
2016-12-09更新
|
563次组卷
|
4卷引用:江西省吉水县第二中学2020-2021学年高二上学期期中考试化学试题
14-15高二上·湖南长沙·阶段练习
名校
5 . 已知在25℃时,Ksp(AgCl)=1.8×10—10,Ksp(AgI)=8.3×10—17,下列说法错误的是
| A.在100mL0.01mol/LKCl溶液中,加入1mL0.01mol/LAgNO3溶液,有沉淀析出 |
| B.往氯化银的悬浊液中加硝酸银,c(Cl—)、c(Ag+)均减小 |
| C.由于Ksp(AgCl)>Ksp(AgI),AgCl沉淀在一定条件下可转化为AgI沉淀 |
| D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小 |
您最近一年使用:0次
6 . 现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
该同学得出的结论正确的是( )。
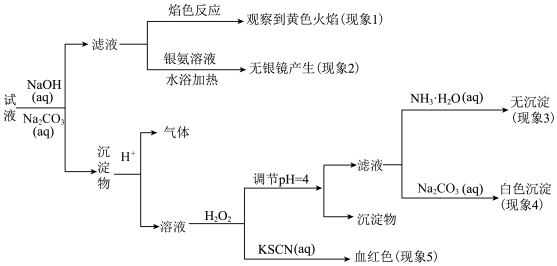
该同学得出的结论正确的是( )。
| A.根据现象1可推出该试液中含有Na+ |
| B.根据现象2可推出该试液中并不含有葡萄糖酸根 |
| C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ |
| D.根据现象5可推出该试液中一定含有Fe2+ |
您最近一年使用:0次
2016-12-09更新
|
3838次组卷
|
27卷引用:江西省南昌市2023-2024学年高三上学期11月期中三校联考化学试题
江西省南昌市2023-2024学年高三上学期11月期中三校联考化学试题湖南省岳阳县第一中学2019届高三上学期期中考试化学试题山西省太原市第二十一中学2020届高三上学期期中考试化学试题福建省福清西山学校高中部2021届高三上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高三上学期9月月考化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷)(已下线)2013-2014河南省商丘市高三第三次模拟考试理综化学试卷2014-2015学年湖北省武汉市第二中学高一下期末化学试卷湖南省双峰县一中、邵东县一中、邵阳市一中、邵阳市二中、武冈县二中、隆回县一中2017-2018学年高二优生1月联考化学试题福建省三明市第一中学2018届高三上学期第二次月考化学试题浙江省杭十四中2018年高三化学选考3月考试试题卷(1)(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【押题专练】上海市黄浦区2016届高三4月第二次模拟考试化学试题2019-2020学年高三化学二轮复习选择题强化训练:实验选择题训练(三)——叙述类实验020届高三化学实验复习——物质分离、提纯的常用化学方法选择【选择突破26题】湖北省武汉市部分学校2021届高三起点质量检测化学试题(已下线)小题必刷16 金属元素为载体的化工流程选择题——2021年高考化学一轮复习小题必刷(通用版)北京市人大附中2021届高三10月月考化学试题北京市第一七一中学2021届高三上学期10月月考化学试题甘肃省白银市会宁县第四中学2021届高三上学期第二次月考化学试题重庆市2021届高三上学期第二次预测性考试化学试题黑龙江省实验中学2021届高三上学期12月月考化学试题河北正定中学2022届高三第四次月考化学试题(已下线)专题04.离子反应-十年(2012-2021)高考化学真题分项汇编(浙江专用)湖南省株洲市南方中学2021-2022学年高三下学期4月月考化学试题全书综合测评2福建省泉州市安溪县2023-2024学年高二下学期期末质量监测化学试题
10-11高一上·江西宜春·期中
解题方法
7 . (1)Na2SO3溶液蒸干得到的固体物质是___________ ,原因是_____ .
(2)碳酸氢钡溶液蒸干得到的固体物质是___________ ,原因是_________ .
(3)盐酸与硫酸浓度各为1mol/L 的混合酸10mL,加热浓缩至1mL,最后得到的溶液浓度
为_________ ,原因是_____________________________________ 。
(4)与c(H+)·c(OH-)=Kw类似,FeS饱和溶液中存在:FeS(s)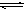 Fe
Fe
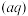 +S
+S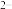
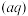 ,c(Fe
,c(Fe )·c(s
)·c(s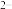 )=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为
)=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为___________________ 。
(2)碳酸氢钡溶液蒸干得到的固体物质是
(3)盐酸与硫酸浓度各为1mol/L 的混合酸10mL,加热浓缩至1mL,最后得到的溶液浓度
为
(4)与c(H+)·c(OH-)=Kw类似,FeS饱和溶液中存在:FeS(s)
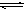 Fe
Fe
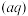 +S
+S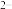
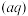 ,c(Fe
,c(Fe )·c(s
)·c(s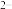 )=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为
)=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为
您最近一年使用:0次
11-12高二上·江西·期中
名校
8 . 硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
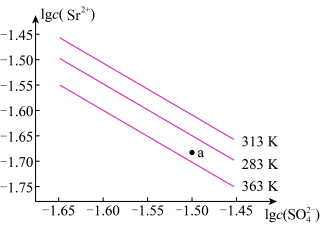

| A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小 |
| B.三个不同温度中,363K时Ksp(SrSO4)最大 |
| C.283K时,图中a点对应的溶液是不饱和溶液 |
| D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
您最近一年使用:0次
2016-12-08更新
|
597次组卷
|
14卷引用:2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷
(已下线)2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷(已下线)2014秋江西省吉安市白鹭洲中学高二上学期期中化学试卷(已下线)2011-2012学年广东省深圳高级中学高二下学期期中化学试卷(已下线)2012-2013学年山东省聊城市某重点中学高二第四次模块检测化学试卷(已下线)2013-2014学年吉林省白山市第一中学高二上学期期末考试化学试卷2016届山东省枣庄八中南校区高三上学期10月阶段测化学试卷2016届湖南长沙市长郡中学三上学期第四次月考化学试卷2016-2017学年广西柳州铁路一中高二上段考理化学卷黑龙江省齐齐哈尔市第八中学2017-2018学年高二12月月考化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】广东省深圳市耀华实验学校2018届高三上学期期末考试化学试题云南省会泽县茚旺高级中学2018-2019学年高二上学期12月月考化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期1月月考化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
9 . 下列说法正确的是
| A.用冰醋酸、蒸馏水和容量瓶等可以配制pH=1的醋酸溶液 |
| B.在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 |
| C.反应SiO2(s)+ 3C(s)="SiC(s)" + 2CO(g)室温下不能自发进行,则该反应的△H<0 |
| D.对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
您最近一年使用:0次
2016-05-30更新
|
166次组卷
|
3卷引用:江西省高安二中2018-2019学年高二上学期期中考试化学试题
10 . 已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式:_______________________ 。
(2)白色固体转化成黑色固体的原因是:_______________________________ 。
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式:
(2)白色固体转化成黑色固体的原因是:
您最近一年使用:0次



