1 . 科学家开发出的新型太阳能铜铟镓二硒(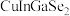 )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含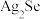 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
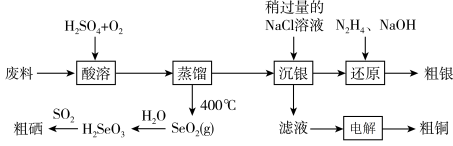
(1)NaOH的电子式为___________ 。
(2)下列事实能说明硫的非金属性比硒的强的是___________ (填标号)。
A.溶解度: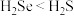
B.沸点: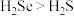
C.酸性: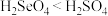
(3)“酸溶”时,能提高反应速率的措施有___________ (答1条即可)。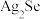 、
、 和
和 反应的化学方程式为
反应的化学方程式为___________ 。
(4)“电解”时,阳极生成的气体为___________ (填化学式),电解结束后,电解液的pH___________ (填“增大”、“减小”或“不变”)。
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下___________ LSO2参与反应。
(6)“沉银”时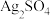 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
___________ 。[已知:常温下,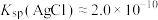 ,
,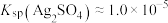 ]
]
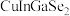 )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含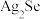 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
(1)NaOH的电子式为
(2)下列事实能说明硫的非金属性比硒的强的是
A.溶解度:
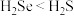
B.沸点:
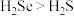
C.酸性:
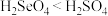
(3)“酸溶”时,能提高反应速率的措施有
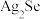 、
、 和
和 反应的化学方程式为
反应的化学方程式为(4)“电解”时,阳极生成的气体为
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下
(6)“沉银”时
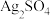 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
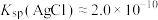 ,
,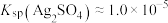 ]
]
您最近一年使用:0次
名校
2 . 含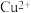 的废水常用
的废水常用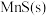 作沉淀剂,原理为
作沉淀剂,原理为 。一定温度下,下列有关该反应的推理正确的是
。一定温度下,下列有关该反应的推理正确的是
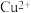 的废水常用
的废水常用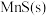 作沉淀剂,原理为
作沉淀剂,原理为 。一定温度下,下列有关该反应的推理正确的是
。一定温度下,下列有关该反应的推理正确的是A.该反应达到平衡时,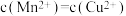 |
B.平衡体系中加入少量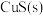 后, 后,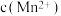 变小 变小 |
C.平衡体系中加入少量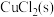 后, 后,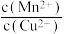 变大 变大 |
D.该反应平衡常数: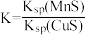 |
您最近一年使用:0次
2022-10-13更新
|
447次组卷
|
3卷引用:江西省宜春市宜丰中学2022-2023学年高三上学期11月期中考试化学试题
江西省宜春市宜丰中学2022-2023学年高三上学期11月期中考试化学试题浙江省10校联盟2022-2023学年高三上学期10月月考化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题16-20)
名校
解题方法
3 . I.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过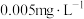 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[ ]沉淀溶解平衡常数的表达式:
]沉淀溶解平衡常数的表达式: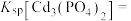
_______ 。
(2)一定温度下, 的
的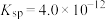 ,
, 的
的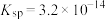 ,该温度下
,该温度下_______ [填“ ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。
(3)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到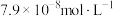 时,废水中
时,废水中 的浓度为
的浓度为____  [已知:
[已知: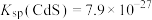 ],此时
],此时____ (填“符合”或“不符合”)《生活饮用水卫生标准》。
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,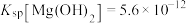 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,向 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_______ 。
(5)常温下,向50mL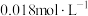 的
的 溶液中加入50mL
溶液中加入50mL 的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。
①反应后,溶液中
_______  。
。
②反应后,溶液的
_______ 。
③如果向反应后的溶液中继续加入50mL 的盐酸,
的盐酸,____ (填“有”或“无”)白色沉淀生成。
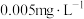 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。(1)写出磷酸镉[
 ]沉淀溶解平衡常数的表达式:
]沉淀溶解平衡常数的表达式: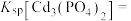
(2)一定温度下,
 的
的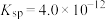 ,
, 的
的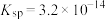 ,该温度下
,该温度下 ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。(3)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到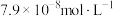 时,废水中
时,废水中 的浓度为
的浓度为 [已知:
[已知: ],此时
],此时II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,
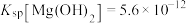 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:| pH |  | 8.0~9.6 | 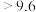 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为(5)常温下,向50mL
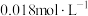 的
的 溶液中加入50mL
溶液中加入50mL 的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。①反应后,溶液中

 。
。②反应后,溶液的

③如果向反应后的溶液中继续加入50mL
 的盐酸,
的盐酸,
您最近一年使用:0次
2022-09-04更新
|
1648次组卷
|
5卷引用:江西省南昌市第一中学2023-2024学年高二上学期11月期中考试化学试题
江西省南昌市第一中学2023-2024学年高二上学期11月期中考试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期中考试化学试题第三章水溶液中的离子反应与平衡广东省揭阳市惠来县第一中学2022-2023学年高二上学期12月月考化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)
名校
解题方法
4 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向某溶液中滴加 溶液,有白色沉淀生成 溶液,有白色沉淀生成 | 溶液中一定含 |
| B | 向 溶液中滴加稀硫酸酸化,再滴加 溶液中滴加稀硫酸酸化,再滴加 溶液,溶液变成血红色 溶液,溶液变成血红色 |  溶液已变质 溶液已变质 |
| C | 向 溶液中逐滴加入少量稀盐酸,无现象 溶液中逐滴加入少量稀盐酸,无现象 | 酸性: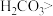 盐酸 盐酸 |
| D | 在足量 溶液中滴入几滴 溶液中滴入几滴 溶液有白色沉淀生成,再滴入 溶液有白色沉淀生成,再滴入 溶液,沉淀变为黑色 溶液,沉淀变为黑色 | 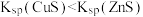 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-22更新
|
315次组卷
|
6卷引用:江西省吉安市第一中学2022-2023学年高三上学期11月期中考试化学试题
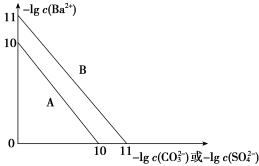
5 . 硫酸钡是一种比碳酸钡更难溶的物质。常温下-lg c(Ba2+)随-lg c(CO )或-lg c(SO
)或-lg c(SO )的变化趋势如图,下列说法正确的是
)的变化趋势如图,下列说法正确的是
 )或-lg c(SO
)或-lg c(SO )的变化趋势如图,下列说法正确的是
)的变化趋势如图,下列说法正确的是
| A.趋势线A表示硫酸钡 |
B.向100 mL含有CO 、SO 、SO 混合溶液中逐滴加入BaCl2溶液,SO 混合溶液中逐滴加入BaCl2溶液,SO 一定先沉淀 一定先沉淀 |
C.将碳酸钡和硫酸钡固体置于水中,此时溶液中的 =10 =10 |
| D.向碳酸钡悬浊液中加入饱和硫酸钠溶液,若碳酸钡转化成了硫酸钡,则可证明硫酸钡Ksp更小 |
您最近一年使用:0次
2022-08-16更新
|
598次组卷
|
7卷引用:江西省上饶市第一中学2022-2023学年高二上学期11月期中考试化学试题
江西省上饶市第一中学2022-2023学年高二上学期11月期中考试化学试题湖南省衡阳市衡阳县第二中学2023-2024学年高二上学期期中考试化学试题重庆市第七中学校2021-2022学年高二上学期第二次月考化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)【定心卷】3.4.2 沉淀溶解平衡的应用随堂练习-人教版2023-2024学年选择性必修1黑龙江省牡丹江市第一高级中学2023-2024学年高二下学期开学初测试 化学试题
名校
6 . 某温度下,向体积均为20.00mL、浓度均为0.1mol•L-1的NaCl溶液、Na2CrO4溶液中分别滴加0.1mol•L-1的AgNO3溶液,滴定过程中的pX(PX=-lgX,X=Cl-、CrO )与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是
)与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是

 )与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是
)与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是
| A.曲线II表示AgNO3溶液滴定NaCl溶液的过程 |
| B.Ksp(Ag2CrO4)=10-2b |
| C.其他条件不变,如果NaCl溶液浓度改为0.05mol•L-1,则滴定终点向上移动 |
| D.若a=5 b=4,则用AgNO3标准液滴定NaCl时可用K2CrO4溶液做指示剂 |
您最近一年使用:0次
2022-05-09更新
|
620次组卷
|
5卷引用:江西省南昌市第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
7 . 一种从废旧锂电池(主要含 ,及少量Al、Cu中制备钴酸钾(
,及少量Al、Cu中制备钴酸钾( )的工艺流程如下;
)的工艺流程如下;
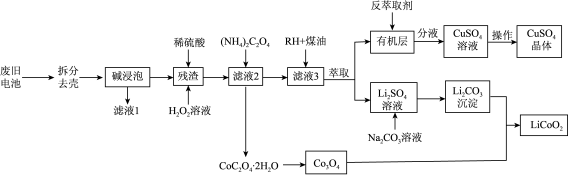
查阅资料: 具有很强的氧化性
具有很强的氧化性
(1)“碱浸泡”用来除去废旧电池中的Al,为提高该物质的去除率可采取的措施有___________ (任写一条)。
(2)向“残渣"中加入稀硫酸和 ,写出
,写出 参与反应的化学方程式
参与反应的化学方程式___________ 。
(3)向“滤液2”中加入沉淀剂时,若不采用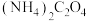 而采用
而采用 ,产物中会混有
,产物中会混有 ,试分析原因
,试分析原因___________ 。
(4)RH蒸取 的原理可表示为:
的原理可表示为: 。实验室进行萃取实验用到的玻璃仪器是
。实验室进行萃取实验用到的玻璃仪器是___________ ;向有机层中加入反萃取剂___________ (填化学式)可将 反萃取至水层。
反萃取至水层。
(5)某 样品中可能含有的杂质为
样品中可能含有的杂质为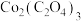 、
、 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取m g样品于锥形瓶中,加入稀 溶解,水浴加热至75℃,用c
溶解,水浴加热至75℃,用c  的
的 溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗
溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗 溶液
溶液 mL。
mL。
Ⅱ.向上述溶液中加入适量还原剂将 完全还原为
完全还原为 ,加入稀
,加入稀 后,在75℃继续用c
后,在75℃继续用c 
 溶液滴定至溶液出现粉红色且30s内不褪色,又消耗
溶液滴定至溶液出现粉红色且30s内不褪色,又消耗 溶液
溶液 mL。
mL。
样品中所含 (
( )的质量分数表达式为
)的质量分数表达式为___________ 。若盛装 溶液的滴定管没有润洗,则测得样品中Co元素含量
溶液的滴定管没有润洗,则测得样品中Co元素含量___________ 。(填“偏高”、“偏低”、“无影响”)
 ,及少量Al、Cu中制备钴酸钾(
,及少量Al、Cu中制备钴酸钾( )的工艺流程如下;
)的工艺流程如下;
查阅资料:
 具有很强的氧化性
具有很强的氧化性(1)“碱浸泡”用来除去废旧电池中的Al,为提高该物质的去除率可采取的措施有
(2)向“残渣"中加入稀硫酸和
 ,写出
,写出 参与反应的化学方程式
参与反应的化学方程式(3)向“滤液2”中加入沉淀剂时,若不采用
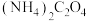 而采用
而采用 ,产物中会混有
,产物中会混有 ,试分析原因
,试分析原因(4)RH蒸取
 的原理可表示为:
的原理可表示为: 。实验室进行萃取实验用到的玻璃仪器是
。实验室进行萃取实验用到的玻璃仪器是 反萃取至水层。
反萃取至水层。(5)某
 样品中可能含有的杂质为
样品中可能含有的杂质为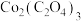 、
、 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:Ⅰ.取m g样品于锥形瓶中,加入稀
 溶解,水浴加热至75℃,用c
溶解,水浴加热至75℃,用c  的
的 溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗
溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗 溶液
溶液 mL。
mL。Ⅱ.向上述溶液中加入适量还原剂将
 完全还原为
完全还原为 ,加入稀
,加入稀 后,在75℃继续用c
后,在75℃继续用c 
 溶液滴定至溶液出现粉红色且30s内不褪色,又消耗
溶液滴定至溶液出现粉红色且30s内不褪色,又消耗 溶液
溶液 mL。
mL。样品中所含
 (
( )的质量分数表达式为
)的质量分数表达式为 溶液的滴定管没有润洗,则测得样品中Co元素含量
溶液的滴定管没有润洗,则测得样品中Co元素含量
您最近一年使用:0次
8 . 下列有关说法正确的是
| A.使用广泛pH试纸测量“84”消毒液的pH |
B.反应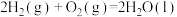 在一定条件能自发进行的原因是 在一定条件能自发进行的原因是 |
C.常温下,将稀 溶液加水稀释后,恢复至原温度,pH减小、 溶液加水稀释后,恢复至原温度,pH减小、 不变 不变 |
D.常温下,向 悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小 悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小 |
您最近一年使用:0次
名校
9 . 以碳酸锰铜矿(主要成分为MnCO3、CuCO3,还含有Fe2O3、FeO等杂质)为原料制备硫酸锰的一种工艺流程如下:
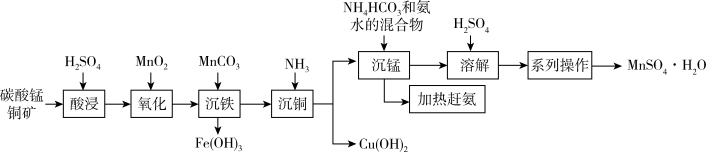
(1)“氧化”时,反应的离子方程式为_______ 。可用一种试剂检验氧化后的溶液中是否含有Fe2+,该试剂为_______ (写化学式)。
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为_______ 。
(3)“沉铜"时,若滤液中c(Mn2+)=0.21mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为_______ 。[已知:常温下,Ksp[Cu(OH)2]=1×10-20,Ksp[Mn(OH)2]=2.1×10-13,离子浓度小于或等于10-5mol/L可视为沉淀完全]
(4)本工艺中可循环使用的物质是_______ 。
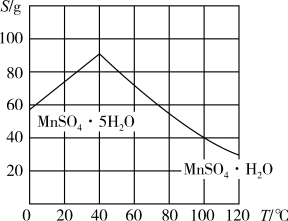
(5)结合图象,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:_______ 、_______ ,酒精洗涤,低温干燥。

(1)“氧化”时,反应的离子方程式为
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为
(3)“沉铜"时,若滤液中c(Mn2+)=0.21mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为
(4)本工艺中可循环使用的物质是
(5)结合图象,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:

您最近一年使用:0次
2022-04-13更新
|
677次组卷
|
6卷引用:江西省安义中学2022-2023学年高三上学期中考试化学试题
江西省安义中学2022-2023学年高三上学期中考试化学试题江西省九江市2022届第二次高考模拟统一考试理综化学试题山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)
名校
解题方法
10 . 某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:

已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
(1)滤渣1的主要成分为_______ 。
(2)从滤液2中获得NiSO4∙6H2O的实验操作_______ 、_______ 、过滤、洗涤、干燥。
(3)用离子方程式解释加入H2O2的作用______ 。
(4)加NiO调节溶液的pH至3.2,则生成沉淀的离子方程式_______ 。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:

若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni______ g。

已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀时pH | 1.5 | 3.6 | 7.3 | 7.0 | 9.6 |
| 完全沉淀时pH | 3.8 | 4.7 | 9.3 | 9.0 | 12.0 |
(1)滤渣1的主要成分为
(2)从滤液2中获得NiSO4∙6H2O的实验操作
(3)用离子方程式解释加入H2O2的作用
(4)加NiO调节溶液的pH至3.2,则生成沉淀的离子方程式
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:

若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni
您最近一年使用:0次



