1 . 25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法不正确的是( )


| A.Ksp[Cu(OH)2]的数量级为10-20 |
| B.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1 |
| C.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
| D.向Z点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液 |
您最近一年使用:0次
2019-04-25更新
|
1845次组卷
|
6卷引用:江西省南昌市第二中学2019-2020学年高二上学期期中考试化学试题
名校
2 . 某温度下,向10mL 0.1mol·L-1 CuCl2溶液中滴加0.1mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。下列有关说法正确的是
已知:Ksp(ZnS)=3×10-25

已知:Ksp(ZnS)=3×10-25

| A.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) |
| B.a、b、c三点对应的溶液中,水的电离程度最大的为b点 |
| C.该温度下,Ksp(CuS)=1×10-35.4 |
| D.向100mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀 |
您最近一年使用:0次
2019-02-04更新
|
1853次组卷
|
9卷引用:江西省南昌市第二中学2019-2020学年高二上学期期中考试化学试题
江西省南昌市第二中学2019-2020学年高二上学期期中考试化学试题江西省南昌市顶级名校2019-2020学年高二上学期12月月考化学考试题【市级联考】湖南省永州市2019届高三上学期第二次模拟考试化学试题(已下线)2019年高考总复习巅峰冲刺-专题07 电解质溶液应试策略(已下线)2019年12月31日《每日一题》 人教版(选修4)——沉淀的生成与溶解河北省武邑中学2019-2020学年高二下学期3月线上考试化学试题甘肃省兰州市第一中学2019-2020学年高二上学期期末考试化学试题重庆育才中学2021-2022学年高二上学期第四次定时练习化学试题河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期5月半月考化学试题
3 . 实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+ Cl-(aq) Ag+(aq)+ Cl-(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl 转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
您最近一年使用:0次
2019-01-30更新
|
3230次组卷
|
46卷引用:江西省宜春市宜丰中学2022-2023学年高三上学期11月期中考试化学试题
江西省宜春市宜丰中学2022-2023学年高三上学期11月期中考试化学试题【全国百强校】广西桂林市第十八中学2017-2018学年高二下学期期中考试化学试题山西省祁县第二中学校2019-2020学年高二上学期期中考试化学试题北京牛山一中2020届高三上学期期中考试化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(北京卷)(已下线)2014届黑龙江阿城一中高三上学期期末考试化学试卷(已下线)2014届甘肃省天水市秦安县高三上学期期末检测化学试卷(已下线)2013-2014学年湖北省三校高二上学期期末联考化学试卷(已下线)2013-2014学年湖北省部分重点中学高二上学期期末考试化学试卷(已下线)2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化2014-2015甘肃省兰州一中高二上学期期末化学试卷2016届山东省枣庄八中南校区高三上学期10月阶段测化学试卷2016届吉林省松原油田高中高三上学期期末模拟化学试卷福建省华安一中2016-2017学年高二上学期期末考化学试卷安徽省淮北市濉溪中学2017-2018学年高二上学期第三次月考(12月)化学试题山西省晋城一中2017--2018学年度高二12月月考化学试题山东省菏泽市第一中学2018届高三12月月考化学试题河南省信阳市2017-2018学年高二上学期期末测试化学试题河南省三门峡市2018届高三上学期期末考试化学试题(已下线)2018年11月19日 《每日一题》人教选修4-沉淀的转化河南省辉县市一中2018-2019学年高二上学期第二次阶段性考试化学试题(已下线)第8章 单元测试(测)-《2020年高考一轮复习讲练测》山西省朔州市怀仁一中2018-2019学年高二上学期第五次月考化学试题(已下线)考点14 化学基本理论——《备战2020年高考精选考点专项突破题集》2020届人教版高三专题基础复习专题8《水溶液中的离子平衡》测试卷云南省曲靖市陆良县第十中学2019-2020学年高二上学期期末考试化学试题北京市通州区2019-2020学年高二下学期期末考试化学试题(已下线)第21讲 难溶电解质的溶解平衡-2021年高考化学一轮复习名师精讲练广东省广州市越秀区2020-2021学年高二上学期期末考试化学试题河北省张家口市宣化一中2020-2021学年高二下学期期初考试化学试题安徽省安庆市第十中学2020-2021学年高二5月月考化学试题(已下线)第26讲 难溶电解质的溶解平衡(精讲)-2022年一轮复习讲练测(已下线)第24讲 沉淀溶解平衡(练) — 2022年高考化学一轮复习讲练测(新教材新高考)人教2019版选择性必修一第三章 第四节 沉淀溶解平衡 课后习题(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)云南省开远市第一中学校2021-2022学年高二下学期开学考试化学试题云南省丘北县第一中学2021-2022学年高二下学期3月份考试 化学试题河南省洛阳市2021-2022学年高二下学期5月质量检测化学试题(已下线)第26讲 难溶电解质的溶解平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)山西省稷山中学2021-2022学年高二上学期第二次月考化学试题(已下线)3.4 沉淀溶解平衡-同步学习必备知识四川省绵阳市三台中学2022-2023学年高二下学期第三次月考化学试题第2课时 沉淀溶解平衡的应用作业(二十二) 沉淀的溶解与生成、转化及应用第三章 第四节 沉淀溶解平衡 第1课时 沉淀溶解平衡与溶度积(已下线)BBWYhjhx1109.pdf
真题
4 . 下列叙述正确的是
| A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-) |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
| D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
您最近一年使用:0次
2019-01-30更新
|
581次组卷
|
5卷引用:2010年江西省新余九中高二上学期期中考试化学试卷
(已下线)2010年江西省新余九中高二上学期期中考试化学试卷2009年普通高等学校招生统一考试理综试题化学部分(天津卷)(已下线)2012届浙江省海盐元济高级中学高三上学期摸底考试化学试卷(已下线)2012届高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 盐类水解的应用(提升练习)
名校
5 . 已知在25℃时,AgCl的Ksp为1.8×10-10,Ag2S的Ksp为6.3×10-50,将AgCl与Ag2S的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
| A.只有Ag2S沉淀生成 | B.AgCl和Ag2S等物质的量生成 |
| C.AgCl沉淀多于Ag2S沉淀 | D.Ag2S沉淀多于AgCl沉淀 |
您最近一年使用:0次
6 . 已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是_____________ .
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中KW=Ka·Kh
(2)25℃时,将a mol·L−1的氨水与0.01mol·L−1的盐酸等体积混合所得溶液中c(NH4 +)=c(Cl−),则溶液显____________ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=_______________ .
(3)25℃时,H2SO3⇌HSO3−+H+的电离常数Ka=1×10−2mol·L−1,则该温度下pH=3、c(HSO3−)=0.1mol·L−1的NaHSO3溶液中c(H2SO3)=_____________________ ,
已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10−38、1.0×10−11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__________________ .(已知lg 2=0.3)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中KW=Ka·Kh
(2)25℃时,将a mol·L−1的氨水与0.01mol·L−1的盐酸等体积混合所得溶液中c(NH4 +)=c(Cl−),则溶液显
(3)25℃时,H2SO3⇌HSO3−+H+的电离常数Ka=1×10−2mol·L−1,则该温度下pH=3、c(HSO3−)=0.1mol·L−1的NaHSO3溶液中c(H2SO3)=
已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10−38、1.0×10−11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
7 . 已知在25 ℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)= 8.7×10-17。
(1)根据以上信息,判断AgX、AgY、AgZ的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为_________ 。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)_____ (填“增大”、“减小”或“不变”)。
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的浓度为______ 。
(4)由上述Ksp判断,在上述(3)的体系中,____ (填“能”或“不能”)实现AgY向AgZ的转化,理由为______ 。
(1)根据以上信息,判断AgX、AgY、AgZ的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的浓度为
(4)由上述Ksp判断,在上述(3)的体系中,
您最近一年使用:0次
2018-11-23更新
|
553次组卷
|
6卷引用:2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷
(已下线)2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷(已下线)2018年11月14日 《每日一题》人教选修4-溶度积的有关计算鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 作业帮陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题(已下线)3.4 沉淀溶解平衡-同步学习必备知识
8 . 下列由实验得出的结论正确的是
| 选项 | 实验 | 结论 |
| A | 向某钠盐中滴加浓盐酸。将产生的气体通入品红溶液,品红溶液褪色 | 该钠盐为Na2SO3或NaHSO3 |
| B | 用乙酸浸泡水壶中的水垢。可将其清除 | 乙酸的酸性大于碳酸 |
| C | 向某盐溶液中先加入少量氯水、再滴加几滴KSCN溶液,溶液变血红色 | 原溶液中一定含有Fe2+ |
| D | 室温下。向饱和Na2CO3溶液中加入少量BaSO4粉末。过滤,向洗净的沉淀中加稀盐酸有气泡产生 | Ksp(BaCO3)< Ksp(BaSO4) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-04-28更新
|
530次组卷
|
7卷引用:江西省临川一中暨临川一中实验学校2020-2021学年高二上学期期中考试化学试题
名校
9 . 在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是
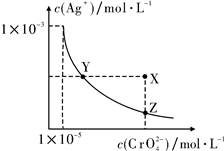

| A.T ℃时,Ag2CrO4的Ksp为1×10-11 |
| B.T ℃时,Y点和Z点的Ag2CrO4的Ksp相等 |
| C.T ℃时 , X点的溶液不稳定,会自发转变到Z点 |
| D.T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀 |
您最近一年使用:0次
2018-02-06更新
|
477次组卷
|
5卷引用:江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题
2011·山东济南·一模
名校
10 . 已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17。下列叙述中正确的是
| A.常温下,AgCl 在NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B.将0.001mol·L-1的AgNO3溶液滴入KC1和KI 的混合溶液中,一定先析出AgI 沉淀 |
| C.向AgCl的悬浊液中加入少量KI 溶液,沉淀由白色转化为黄色 |
| D.向AgCl饱和溶液中加入NaCl晶体,有AgC1析出且溶液中c(Ag+)=c(C1-) |
您最近一年使用:0次
2018-01-18更新
|
196次组卷
|
19卷引用:江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题
江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题2015-2016学年江西省赣州市高二上学期期末考试化学试卷江西省抚州市临川第一中学2019-2020学年高二下学期第十次周测化学试题四川省达州市渠县中学2018-2019学年高二下学期化期中考试化学试题青海省湟川中学2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题湖南省衡阳县第四中学2023-2024年高二上学期期中考试化学B卷(已下线)2011届山东省济南市高三教学质量调研(一模)化学试卷(已下线)2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷(已下线)2013届安徽省怀宁中学高三上学期开学水平检测考试化学试卷(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷2016届安徽省蚌埠市高三上学期第一次教学质检化学试卷2015-2016学年四川省雅安市高二下学期期末化学试卷宁夏吴忠中学2017-2018学年高二上学期期末考试化学试题宁夏吴忠市吴忠中学2017-2018学年第一学期高二化学期末考试试卷吉林省吉林地区普通高中友好学校联合体2017-2018学年高二上学期期末考试化学试题第25届(2011年)高中生化学竞赛(河北赛区)初赛试题四川省广安第二中学校2023-2024学年高二上学期第二次月考化学试题



