| A.Na2CO3溶液可用带玻璃塞的试剂瓶保存。 |
| B.将饱和的AlCl3溶液蒸干并灼烧,可得到AlCl3固体。 |
| C.配制FeCl3溶液时,可将FeCl3固体溶解在硫酸中,然后再加水稀释。 |
| D.除去Cu2+中含有的Fe3+杂质,可加入CuO、Cu(OH)2、Cu2(OH)2CO3,充分反应后,过滤。 |
①常温下,某酸性MgCl2溶液中含有少量的FeCl3,为了得到纯净的MgCl2·2H2O晶体,应加入
②常温下,若将0.01 mol·L-1 MgCl2溶液与
(2)已知肼(N2H4)是一种清洁高效的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。该反应的热化学方程式:
(3)燃料电池是一种高效低污染的新型电池,肼(N2H4)-空气燃料电池是一种碱性燃料电池,其工作原理如图所示:

①写出电池中通入电池中通入N2H4的一极的电极的反应:
②电池工作时,正极附近的pH

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为
(2)第1步除杂中加入H2O2的目的是
(3)第1步除杂中形成滤渣l的主要成分为
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式
(5)采用“趁热过滤”操作的原因是
 (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO (aq) K(298K)=0.1
(aq) K(298K)=0.1(1)若平衡溶液中c(SO
 )为0.1mol·L-1,则c(CO
)为0.1mol·L-1,则c(CO )=
)=(2)锅炉经过碳酸钠处理后,倒出溶液,再向锅中加入一定量的醋酸溶液,目的是
(3)需要处理0.1molBaSO4,加入1LNa2CO3溶液,碳酸钠的物质的量浓度是
 )=
)= CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达到平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K=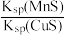 |
 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色) 等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色) 等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题: (1)Cr3+与Al3+的化学性质相似, 在Cr2(SO4) 3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
(2)
 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的Na2CrO4溶液中c(
在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的Na2CrO4溶液中c( )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应
②由图可知,溶液酸性增大,
 的平衡转化率
的平衡转化率③升高温度,溶液中
 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的
 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
| A.25℃时,CuS的溶解度大于MnS的溶解度 |
| B.25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol/L |
| C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
| D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂 |
8 . 已知氢氧化钙和钨酸钙(CaWO4都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应I: (aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:
(aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:

(1)①计算T1时,Ksp(CaWO4)=
②T1
(2)①反应I平衡常数K的表达式为
②该反应的△H
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值直相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol/L]中,加入过量Ca(OH)2,反应达到平衡后 的沉淀率为60%,此时
的沉淀率为60%,此时 的平衡浓度为
的平衡浓度为
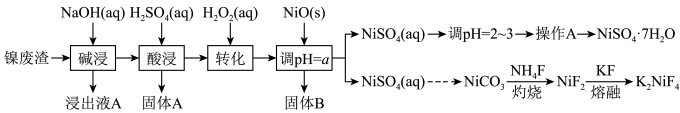
几种金属离子的氢氧化物沉淀pH如表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 5.2 |
Fe2+ | 7.6 | 9.7 |
Ni2+ | 7.1 | 9.2 |
(1)“碱浸”过程中,为提高浸出率,可采取的措施是
(2)“转化”过程中加入H2O2的目的是
(3)调节pH=a,其中a的取值范围是
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:
(5)准确称取ωg翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250mL溶液,取25.00mL所配溶液于锥形瓶中,用cmol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生反应Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02mL、19.98mL、19.50mL,则翠矾的纯度为
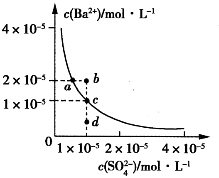
(1)下列说法正确的是
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)将100mL1mol•L-1H2SO4溶液加入100mL含Ba2+0.137g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为
(3)若沉淀分别用100mL纯水和100mL0.01mol•L-1的H2SO4溶液洗涤,两种情况下损失的BaSO4的质量之比为



