1 . 常温下,难溶物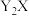 与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,
与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,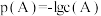 ,
, 表示
表示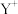 或
或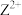 。下列说法错误的是
。下列说法错误的是
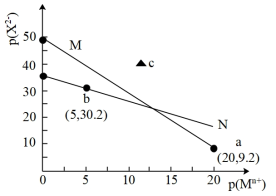
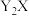 与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,
与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,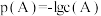 ,
, 表示
表示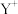 或
或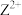 。下列说法错误的是
。下列说法错误的是
A.N表示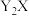 的溶解平衡曲线 的溶解平衡曲线 |
B.常温下,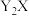 的分散系在c点时为悬浊液 的分散系在c点时为悬浊液 |
C.向b点溶液中加入 饱和溶液,析出ZX固体 饱和溶液,析出ZX固体 |
D.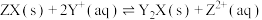 的平衡常数 的平衡常数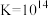 |
您最近一年使用:0次
2022-12-06更新
|
127次组卷
|
2卷引用:江西省丰城中学2022-2023学年高二下学期开学考试化学试题
名校
2 . 下列实验方案能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明 沉淀可以转化为 沉淀可以转化为 沉淀 沉淀 | 向 溶液中先加入3滴 溶液中先加入3滴 溶液,再加入3滴 溶液,再加入3滴 溶液 溶液 |
| B | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
| C | 测定未知浓度的NaOH溶液 | 用甲基橙作指示剂,标准盐酸溶液滴定NaOH溶液时,当溶液颜色由黄色变为橙色,且半分钟内不视色即为滴定终点 |
| D | 验证可溶性MR为强酸强碱盐 | 25℃,测得可溶性正盐MR的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-06更新
|
263次组卷
|
4卷引用:2023-2024学年高二化学下学期月考1试卷
3 . 根据下列图示所得出的结论正确的是
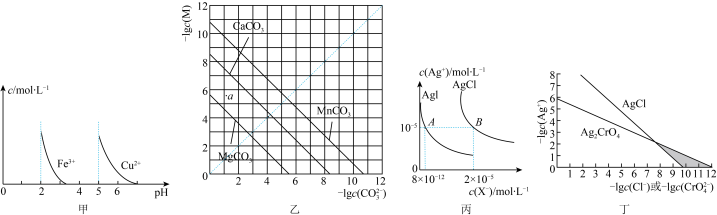

| A.由图甲可知,除去CuSO4溶液中的Fe3+可加入适量NaOH溶液调节pH至4左右 |
B.图乙是一定温度下三种碳酸盐的沉淀溶解平衡曲线,a点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO ) ) |
| C.图丙是室温下AgCl和AgI的饱和溶液中离子浓度的关系曲线,该温度下反应AgCl(s)+I-(aq)⇌AgI(s)+Cl-(aq)的平衡常数K=2.5×106 |
| D.图丁是室温下AgCl和Ag2CrO4的沉淀溶解平衡曲线,阴影区域中的点可以同时生成Ag2CrO4沉淀和AgCl沉淀 |
您最近一年使用:0次
2022-11-26更新
|
398次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
名校
解题方法
4 . 根据下列实验操作和实验现象,得出的实验结论正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 常温下,分别测定0.01mol/L的NaHSO3溶液和0.01mol/L的NaHCO3溶液的pH值 | NaHCO3的pH值大 | 非金属性:S>C |
| B | 向某钠盐中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 该钠盐可能为Na2S2O3 |
| C | 将 样品溶于稀硫酸,滴加KSCN溶液 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 |  样品已变质 样品已变质 |
| D | 向盛有过量AgNO3溶液的试管中滴加少量NaCl溶液,再向其中滴加Na2CrO4溶液 | 先观察到白色沉淀,后产生砖红色沉淀 | AgCl沉淀可转化为更难溶的沉淀Ag2CrO4 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-26更新
|
268次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
名校
解题方法
5 . 水溶液中的离子反应与平衡在工农业生产和日常生活中有着广泛的应用,下列说法错误的是
| A.明矾净水的原理与Al3+的水解有关 |
| B.用醋酸浸泡可以除去锅炉水垢中的CaSO4 |
| C.误服BaCl2或BaCO3后可用Na2SO4溶液解毒 |
D.长期使用 化肥的土壤酸性会增强 化肥的土壤酸性会增强 |
您最近一年使用:0次
2022-11-26更新
|
297次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
6 . 向10mL浓度均为0.1mol·L-1的FeSO4和ZnSO4的混合溶液中加入等浓度的氨水,溶液中金属元素有不同的存在形式,它们的物质的量浓度与氨水(K b=1.8×10-5)体积关系如图所示,测得M、N点溶液pH分别为8.04、8.95。
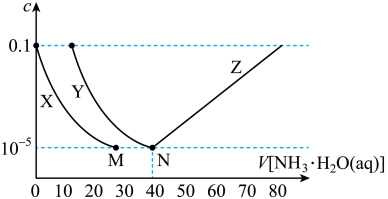
已知:i.Zn2++4NH3 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06
ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是

已知:i.Zn2++4NH3
 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是
| A.曲线X表示Zn2+ |
| B.Ksp[Fe(OH)2]=10-15.1 |
| C.N点锌元素的主要存在形式是[Zn(NH3)4]2+ |
D.Zn(OH)2+4NH3 [Zn(NH3)4]2++2OH- K=10-7.86 [Zn(NH3)4]2++2OH- K=10-7.86 |
您最近一年使用:0次
2022-11-18更新
|
1216次组卷
|
5卷引用:江西省宜春市九校2023届高三下学期第二次联考理科综合化学试题
名校
解题方法
7 . I.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过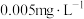 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[ ]沉淀溶解平衡常数的表达式:
]沉淀溶解平衡常数的表达式: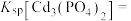
_______ 。
(2)一定温度下, 的
的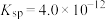 ,
, 的
的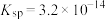 ,该温度下
,该温度下_______ [填“ ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。
(3)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到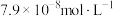 时,废水中
时,废水中 的浓度为
的浓度为____  [已知:
[已知: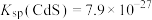 ],此时
],此时____ (填“符合”或“不符合”)《生活饮用水卫生标准》。
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,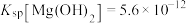 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,向 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_______ 。
(5)常温下,向50mL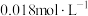 的
的 溶液中加入50mL
溶液中加入50mL 的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。
①反应后,溶液中
_______  。
。
②反应后,溶液的
_______ 。
③如果向反应后的溶液中继续加入50mL 的盐酸,
的盐酸,____ (填“有”或“无”)白色沉淀生成。
 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。(1)写出磷酸镉[
 ]沉淀溶解平衡常数的表达式:
]沉淀溶解平衡常数的表达式: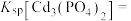
(2)一定温度下,
 的
的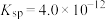 ,
, 的
的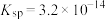 ,该温度下
,该温度下 ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。(3)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到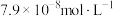 时,废水中
时,废水中 的浓度为
的浓度为 [已知:
[已知: ],此时
],此时II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,
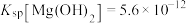 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:| pH |  | 8.0~9.6 | 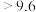 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为(5)常温下,向50mL
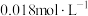 的
的 溶液中加入50mL
溶液中加入50mL 的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。①反应后,溶液中

 。
。②反应后,溶液的

③如果向反应后的溶液中继续加入50mL
 的盐酸,
的盐酸,
您最近一年使用:0次
2022-09-04更新
|
1648次组卷
|
5卷引用:江西省南昌市第一中学2023-2024学年高二上学期11月期中考试化学试题
江西省南昌市第一中学2023-2024学年高二上学期11月期中考试化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)第三章水溶液中的离子反应与平衡黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期中考试化学试题广东省揭阳市惠来县第一中学2022-2023学年高二上学期12月月考化学试题
名校
解题方法
8 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 向溶液X中滴加浓盐酸,将产生气体通入品红溶液,溶液褪色 | 证明溶液X中含有 或 或 |
| B | 室温下,向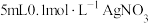 溶液中加入几滴 溶液中加入几滴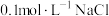 溶液出现白色沉淀,再滴加几滴 溶液出现白色沉淀,再滴加几滴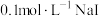 溶液,出现黄色沉淀 溶液,出现黄色沉淀 | 证明相同温度下: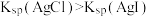 |
| C | 常温下,测得相同浓度溶液的 : : | 证明常温下的水解程度: |
| D | 将 溶液滴入酸性 溶液滴入酸性 溶液中,紫红色褪去 溶液中,紫红色褪去 | 证明 有还原性 有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-02更新
|
1369次组卷
|
4卷引用:江西省新余市2022-2023学年高二上学期期末质量检测化学试题
9 . 工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)制备PbSO4晶体的工艺流程如图:

已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq) PbCl
PbCl (aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是
(aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是

已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)
 PbCl
PbCl (aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是
(aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是| A.“浸取”时的主要离子反应为MnO2+PbS+4H++2Cl-=PbCl2 +S+Mn2++2H2O |
| B.“滤渣2”的主要成分是Fe(OH)3 |
C.“沉降”时加入冰水,PbCl2(s)+2Cl-(aq) PbCl PbCl (aq)平衡左移,有利于PbCl2沉淀更完全 (aq)平衡左移,有利于PbCl2沉淀更完全 |
D.“沉淀转化”过程达平衡时,溶液中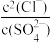 =1.6×103 =1.6×103 |
您最近一年使用:0次
2022-07-19更新
|
729次组卷
|
4卷引用:江西省九校2022-2023学年高二下学期开学联考化学试题
江西省九校2022-2023学年高二下学期开学联考化学试题河北省石家庄市第二中学教育集团2021-2022学年高二下学期期末考试化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖南省长沙麓山国际实验学校2023-2024学年高二下学期第一次学情检测化学试卷
名校
解题方法
10 . 以印刷线路板酸性蚀刻废液(含有CuCl2、FeCl2、FeCl3)为原料制备纳米CuO的流程如图:
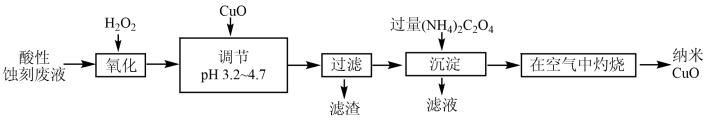
下列说法错误的是

下列说法错误的是
| A.“沉淀”产生的CuC2O4,不洗涤直接灼烧不影响产品质量 |
| B.“在空气中灼烧”时发生了非氧化还原反应 |
| C.调节pH为3.2~4.7的目的是使Fe3+完全沉淀,Cu2+不沉淀 |
| D.“沉淀”过程中用Na2C2O4代替(NH4)2C2O4,得到的CuC2O4中可能混有Cu(OH)2 |
您最近一年使用:0次
2022-06-01更新
|
725次组卷
|
6卷引用:江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题



