2024高三下·全国·专题练习
解题方法
1 . 一种由菱镁矿(主要成分 ,还含少量
,还含少量 和
和 )制备高纯
)制备高纯 的工艺流程如下:
的工艺流程如下:
(1)“浸取”时加入的盐酸不宜过量太多的原因是___________ 。
(2)“调pH”时,发生反应的离子方程式为___________ 。某同学认为“氧化”步骤可省略,直接用 调节pH值得到
调节pH值得到 沉淀,该想法不合理的原因是
沉淀,该想法不合理的原因是___________ 。
 ,还含少量
,还含少量 和
和 )制备高纯
)制备高纯 的工艺流程如下:
的工艺流程如下:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 7.6 | 1.9 | 8.4 |
| 沉淀完全的pH | 9.6 | 3.2 | 10.8 |
(2)“调pH”时,发生反应的离子方程式为
 调节pH值得到
调节pH值得到 沉淀,该想法不合理的原因是
沉淀,该想法不合理的原因是
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 工业上利用软锰矿(主要成分为 ,含
,含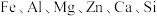 等元素)与纤维素制备
等元素)与纤维素制备 ,工艺如下图所示。
,工艺如下图所示。 范围如下:
范围如下:
“中和”步骤要调节溶液 ,最适宜的
,最适宜的 范围是
范围是_____ 。
(2)“氧化”时,氧化时间对产品中的锰含量及溶液pH的影响如下图。最佳的氧化时间为_____  ;下列说法错误的是
;下列说法错误的是_____ 。 ,主要发生的反应是
,主要发生的反应是 下降较慢
下降较慢
B.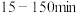 ,主要发生的反应是
,主要发生的反应是 ,
, 下降较快
下降较快
C.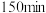 之后,
之后, 趋于稳定,则
趋于稳定,则 已完全氧化
已完全氧化
D. 后,继续通入空气,可能将产品氧化生成
后,继续通入空气,可能将产品氧化生成 及
及 ,使产品中锰含量下降
,使产品中锰含量下降
 ,含
,含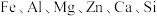 等元素)与纤维素制备
等元素)与纤维素制备 ,工艺如下图所示。
,工艺如下图所示。
 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 1.5 | 3.0 | 8.9 | 6.0 | 8.1 |
完全沉淀的 | 2.8 | 4.7 | 10.9 | 8.0 | 10.1 |
 ,最适宜的
,最适宜的 范围是
范围是(2)“氧化”时,氧化时间对产品中的锰含量及溶液pH的影响如下图。最佳的氧化时间为
 ;下列说法错误的是
;下列说法错误的是
 ,主要发生的反应是
,主要发生的反应是 下降较慢
下降较慢B.
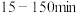 ,主要发生的反应是
,主要发生的反应是 ,
, 下降较快
下降较快C.
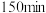 之后,
之后, 趋于稳定,则
趋于稳定,则 已完全氧化
已完全氧化D.
 后,继续通入空气,可能将产品氧化生成
后,继续通入空气,可能将产品氧化生成 及
及 ,使产品中锰含量下降
,使产品中锰含量下降
您最近一年使用:0次
解题方法
3 . 常温下,在指定的溶液中一定能大量共存的离子组是
A. 的溶液: 的溶液: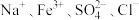 |
B.加入酚酞显红色的溶液: |
C.使 试纸变红的溶液: 试纸变红的溶液: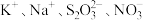 |
D.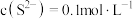 的溶液: 的溶液: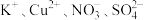 |
您最近一年使用:0次
4 . 下列应用与沉淀溶解平衡无关的是
A.在工业废水处理过程中,以 作沉淀剂,除去 作沉淀剂,除去 、 、 等 等 |
B.如果要除去某溶液中的 ,最好选择钡盐 ,最好选择钡盐 |
| C.用醋酸除水垢 |
| D.配制FeCl3溶液时加适量的HCl |
您最近一年使用:0次
5 . 下表是常温下 的电离常数和
的电离常数和 的溶度积常数:
的溶度积常数:
下列推断正确的是
 的电离常数和
的电离常数和 的溶度积常数:
的溶度积常数: |  |  |
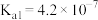 , ,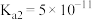 |  |  |
A.误饮 的溶液会引起钡中毒,需用一定浓度的 的溶液会引起钡中毒,需用一定浓度的 溶液给钡中毒者洗胃解毒 溶液给钡中毒者洗胃解毒 |
B.温度一定,向含 固体的饱和 固体的饱和 溶液中加入少量 溶液中加入少量 固体, 固体, 的溶解能力保持不变 的溶解能力保持不变 |
C.由 粉末和水形成的饱和 粉末和水形成的饱和 溶液中存在: 溶液中存在: |
D. 的 的 溶液,可将 溶液,可将 完全转化为 完全转化为 |
您最近一年使用:0次
6 . 要使工业废水中的Pb2+沉淀,可用硫酸盐、碳酸盐等作沉淀剂。已知某温度时,Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-21,p(Pb)=-lgc(Pb2+),p(B)=-lgc( )或-lgc(
)或-lgc( )。为研究沉淀效果,在物质的量浓度相同的Na2SO4和Na2CO3的混合溶液中滴加PbCl2溶液产生两种沉淀(温度升高,PbSO4、PbCO3的Ksp均增大),上述反应过程溶液中离子浓度的负对数关系如图所示。下列说法错误的是
)。为研究沉淀效果,在物质的量浓度相同的Na2SO4和Na2CO3的混合溶液中滴加PbCl2溶液产生两种沉淀(温度升高,PbSO4、PbCO3的Ksp均增大),上述反应过程溶液中离子浓度的负对数关系如图所示。下列说法错误的是
 )或-lgc(
)或-lgc( )。为研究沉淀效果,在物质的量浓度相同的Na2SO4和Na2CO3的混合溶液中滴加PbCl2溶液产生两种沉淀(温度升高,PbSO4、PbCO3的Ksp均增大),上述反应过程溶液中离子浓度的负对数关系如图所示。下列说法错误的是
)。为研究沉淀效果,在物质的量浓度相同的Na2SO4和Na2CO3的混合溶液中滴加PbCl2溶液产生两种沉淀(温度升高,PbSO4、PbCO3的Ksp均增大),上述反应过程溶液中离子浓度的负对数关系如图所示。下列说法错误的是
| A.常温下PbSO4的溶解度大于PbCO3的溶解度 |
| B.向d点对应的溶液中加入对应阴离子的钠盐,溶液组成由d点向b点方向移动 |
C.e约为4且对应的阴离子是 |
| D.对于曲线Ⅰ,对b点的溶液加热(忽略水分蒸发),溶液组成由b点向c点移动 |
您最近一年使用:0次
名校
7 . 将浓盐酸加到NaCl饱和溶液中,会析出NaCl晶体,对这种现象正确的解释是
| A.由于c平(Cl-)增加,使溶液中c平(Na+)·c平(Cl-)>Ksp(NaCl),故产生NaCl晶体 |
| B.HCl是强酸,所以它能使NaCl沉淀出来 |
| C.由于c平(Cl-)增加,使NaCl的溶解平衡向析出NaCl的方向移动,故有NaCl沉淀析出 |
| D.酸的存在,降低了盐的溶解度 |
您最近一年使用:0次
2023-08-26更新
|
472次组卷
|
4卷引用:题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
解题方法
8 . 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,以卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)为原料制备少量Mg(ClO3)2·6H2O的流程如下:
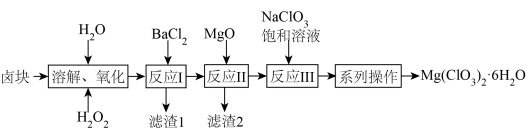
下列说法错误的是

下列说法错误的是
| A.“溶解、氧化”时,温度不能太高 |
B.“反应Ⅰ”离子方程式为 |
| C.“反应Ⅱ”发生的依据是Mg(OH)2和Fe(OH)3的Ksp |
| D.“系列操作”需用到的玻璃仪器有烧杯、玻璃棒、分液漏斗等 |
您最近一年使用:0次
2023-08-14更新
|
416次组卷
|
4卷引用:第3讲 物质制备实验的设计与评价
2023高二上·全国·专题练习
9 . 沉淀转化的应用
(1)锅炉除水垢(含有CaSO4):CaSO4(s) CaCO3(s)
CaCO3(s) Ca2+(aq),反应为:
Ca2+(aq),反应为:_______ 。
(2)自然界中矿物的转化:原生铜的硫化物 CuSO4溶液
CuSO4溶液 铜蓝(CuS),反应为:
铜蓝(CuS),反应为:_______ 。
(3)工业废水处理:工业废水处理过程中,重金属离子可利用沉淀转化原理用FeS等难溶物转化为HgS、Ag2S、PbS等沉淀。用FeS除去Hg2+的离子方程式:_______ 。
(1)锅炉除水垢(含有CaSO4):CaSO4(s)
 CaCO3(s)
CaCO3(s) Ca2+(aq),反应为:
Ca2+(aq),反应为:(2)自然界中矿物的转化:原生铜的硫化物
 CuSO4溶液
CuSO4溶液 铜蓝(CuS),反应为:
铜蓝(CuS),反应为:(3)工业废水处理:工业废水处理过程中,重金属离子可利用沉淀转化原理用FeS等难溶物转化为HgS、Ag2S、PbS等沉淀。用FeS除去Hg2+的离子方程式:
您最近一年使用:0次
2023高二上·全国·专题练习
解题方法
10 . 难溶电解质沉淀溶解平衡的影响因素
已知沉淀溶解平衡:Mg(OH)2(s)=Mg2+(aq)+2OH-(aq)
Q:离子积对于AmBn(s)=mAn+(aq)+nBm-(aq)任意时刻Q=cm(An+)·cn(Bm-)。
(1)Q>Ksp,溶液过饱和,有_______ 析出,直至溶液_______ ,达到新的平衡。
(2)Q=Ksp,溶液饱和,沉淀与溶解处于_______ 。
(3)Q<Ksp,溶液未饱和,无_______ 析出,若加入过量难溶电解质,难溶电解质_______ 直至溶液_______ 。
已知沉淀溶解平衡:Mg(OH)2(s)=Mg2+(aq)+2OH-(aq)
| 条件改变 | 移动方向 | c(Mg2+) | c(OH-) |
| 加少量水 | |||
| 升温 | |||
| 加MgCl2(s) | |||
| 加盐酸 | |||
| 加NaOH(s) |
(1)Q>Ksp,溶液过饱和,有
(2)Q=Ksp,溶液饱和,沉淀与溶解处于
(3)Q<Ksp,溶液未饱和,无
您最近一年使用:0次



