1 . 下列由实验现象所得结论正确的是
选项 | 实验操作和实验现象 | 结论 |
| A |  样品溶于水,滴加盐酸酸化的 样品溶于水,滴加盐酸酸化的 溶液,产生白色沉淀 溶液,产生白色沉淀 样品已变质 样品已变质 |  样品已变质 样品已变质 |
| B | 向 溶液中滴加3滴 溶液中滴加3滴 溶液,出现白色沉淀后,再滴加3滴 溶液,出现白色沉淀后,再滴加3滴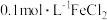 溶液,出现红褐色沉淀 溶液,出现红褐色沉淀 |  |
| C | 向硫酸铜溶液中逐滴加入氨水至过量,先生成蓝色沉淀,后沉淀溶解,得到深蓝色透明溶液 |  沉淀溶于氨水生成 沉淀溶于氨水生成 |
| D | 向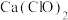 溶液中通入 溶液中通入 气体,有沉淀生成 气体,有沉淀生成 | 酸性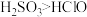 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验过程 | 实验结论 |
| A | 常温下,向等体积、pH=4的HA、HB溶液中分别加入质量相等、表面积大致相同的锌粒。相同时间内,HA产生气体较多 | HA酸性较弱 |
| B | 25℃时,测得0.1mol/L 、 、 溶液的pH分别为11.6、9.7 溶液的pH分别为11.6、9.7 | 非金属性:S>C |
| C | 将亚硫酸钠样品溶于水,加入硝酸酸化后再滴加 溶液,有白色沉淀产生 溶液,有白色沉淀产生 | 亚硫酸钠样品已变质 |
| D | 常温下,将 放入饱和 放入饱和 溶液中充分反应;向过滤后所的固体中加入足量稀盐酸,固体部分溶解且有气泡产生 溶液中充分反应;向过滤后所的固体中加入足量稀盐酸,固体部分溶解且有气泡产生 | 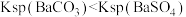 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 下列实验操作能达到实验目的的是
| 目的 | 操作 | |
| A | 测定NaClO溶液的pH | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比 |
| B | 验证Ksp(AgCl)>Ksp( AgI) | 取2 mL0. 1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀 |
| C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
| D | 检验Fe(NO3)2晶体是否已 氧化变质 | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-24更新
|
624次组卷
|
8卷引用:山东省聊城市2020-2021学年高二上学期期中考试化学试题
名校
解题方法
4 . 根据下列实验操作和现象所得到的结论正确的是 ( )
| 选项 | 实验操作和现象 | 结论 |
| A | 取室温下少量0.5 mol·L-1 CH3COONa溶液,加热至60 ℃,并测定溶液的pH,pH减小 | CH3COONa的水解是放热反应 |
| B | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,溶液变红 | Fe(NO3)2样品溶于酸前已氧化变质 |
| C | 室温下,用pH试纸测得NaF 溶液的pH约为8,NaNO2 溶液的pH约为9 | 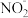 结合H+的能力比F-的强 结合H+的能力比F-的强 |
| D | 将0.1 mol·L-1 MgSO4溶液滴入0.1 mol·L-1 NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-30更新
|
252次组卷
|
2卷引用:江苏省泰州市2021届高三上学期期中调研考试化学试题
名校
5 . 根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中滴加少量稀硝酸 | 产生白色沉淀 | 该溶液中一定含有SiO32- |
| B | 室温下,测定等浓度的Na2A和NaB溶液的pH | Na2A溶液的pH较大 | 酸性:H2A<HB |
| C | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已氧化变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 下列说法或推理正确的是
| A.将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(NO3)2晶体已氧化变质 |
| B.常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9 |
| C.25℃时,Ksp(BaCO3)>Ksp(BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好 |
| D.将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解 |
您最近一年使用:0次
2016-09-01更新
|
195次组卷
|
5卷引用:2015-2016学年贵州省习水县一中高二下学期期中考试化学试卷
7 . 下列实验方案中,不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 除去CO2气体中的SO2气体 | 将混合气体通入饱和碳酸氢钠溶液,洗气 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 向少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
198次组卷
|
2卷引用:吉林省长春市实验中学2023-2024学年高一上学期期中化学试题
8 . 下述实验不能达到预期目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 验证Ksp(AgCl)>Ksp(AgI) | 向NaCl溶液中滴加少量AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
| D | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2015-01-07更新
|
231次组卷
|
2卷引用:2015届江苏省无锡市普通高中高三期中化学试卷
名校
解题方法
9 . 工业上电解精炼铜的阳极泥是重要的二次资源,从中间产物分金渣(主要成分为:AgCl、 Ag2S、PbSO4、 BaSO4)中获取高纯银的流程如图所示:
已知:在上述反应的温度下Ksp(AgCl)=1.8×10-10,Ksp(Ag2s)=6.38×10-50,
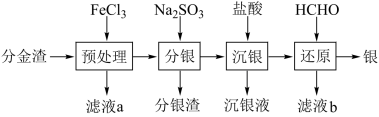
(1)银的一种晶胞如图1所示,银原子周围距离最近且相等的银原子为_______ 。
(2)“预处理”加入FeCl3溶液将Ag2S转化为AgCl。若将AgCl放在KI溶液中振荡,则有部分AgCl转化为AgI。 AgI有α、β、γ三种晶型,其中α- AgI在电场作用下,Ag+不需要克服太大的阻力,就可以发生迁移。因此α- AgI晶体在电池中,可作为_______ 。
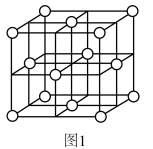
(3)已知: Ag+ +2SO = [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=
= [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=_______ 。
(4)“分银”时,[Ag(SO3)2]3-的浓度与溶液pH的关系如图2; SO 及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
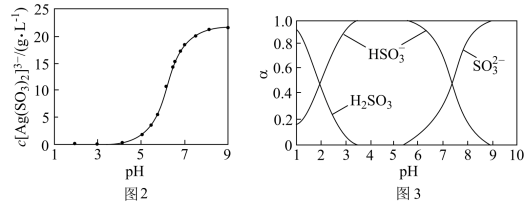
“沉银”时的终点pH需控制在3.5-5.5范围内,不能过低的原因是_______ 。
(5)“还原"时HCHO转化为HCOOH,其化学方程式为_______ 。
(6)已如Ag+ +SCN- =AgSCN↓ (白色),实验室可通过如下过程测定所制银样品的纯度(杂质不参与反应):
①称取制备的银样品1.000g,加适量稀硝酸溶解,定容到100mL容量瓶中。
②准确称取25.00 mL溶液置于锥形瓶中,般化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.1000 mol / L NH4SCN标准溶液滴定,滴定终点的实验现象为溶液变为(血)红色。
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为22. 00mL。则样品中银的质量分数为_______ 。(写出计算过程)

已知:在上述反应的温度下Ksp(AgCl)=1.8×10-10,Ksp(Ag2s)=6.38×10-50,
(1)银的一种晶胞如图1所示,银原子周围距离最近且相等的银原子为

(2)“预处理”加入FeCl3溶液将Ag2S转化为AgCl。若将AgCl放在KI溶液中振荡,则有部分AgCl转化为AgI。 AgI有α、β、γ三种晶型,其中α- AgI在电场作用下,Ag+不需要克服太大的阻力,就可以发生迁移。因此α- AgI晶体在电池中,可作为
(3)已知: Ag+ +2SO
 = [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=
= [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=(4)“分银”时,[Ag(SO3)2]3-的浓度与溶液pH的关系如图2; SO
 及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
“沉银”时的终点pH需控制在3.5-5.5范围内,不能过低的原因是
(5)“还原"时HCHO转化为HCOOH,其化学方程式为
(6)已如Ag+ +SCN- =AgSCN↓ (白色),实验室可通过如下过程测定所制银样品的纯度(杂质不参与反应):
①称取制备的银样品1.000g,加适量稀硝酸溶解,定容到100mL容量瓶中。
②准确称取25.00 mL溶液置于锥形瓶中,般化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.1000 mol / L NH4SCN标准溶液滴定,滴定终点的实验现象为溶液变为(血)红色。
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为22. 00mL。则样品中银的质量分数为
您最近一年使用:0次
2022-12-29更新
|
409次组卷
|
3卷引用:江苏省南京市六校联合体2022-2023学年高三上学期11月联考化学试题
江苏省南京市六校联合体2022-2023学年高三上学期11月联考化学试题(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(17-20)陕西师范大学附属中学2023-2024学年高二上学期期末考试化学试题



