1 . 下列实验的设计方案、现象和结论有错误的是
| 选项 | 实验目的 | 设计方案和实验现象 | 结论 |
| A | 检验菠菜中是否含有铁元素 | 取少量菠菜叶剪碎研磨后加水搅拌,取上层清液于试管中,加入稀硝酸后,再加入 溶液,溶液变红 溶液,溶液变红 | 菠菜中含有铁元素 |
| B | 检验尿液中是否含有葡萄糖 | 取尿液适量,向其中加入 至溶液呈碱性,加入新制的 至溶液呈碱性,加入新制的 悬浊液,加热煮沸,产生砖红色沉淀 悬浊液,加热煮沸,产生砖红色沉淀 | 尿液中含有葡萄糖 |
| C | 比较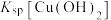 和 和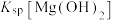 大小 大小 | 向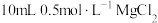 溶液中滴加 溶液中滴加 溶液,充分反应产生白色沉淀,再滴加 溶液,充分反应产生白色沉淀,再滴加 溶液,沉淀变蓝 溶液,沉淀变蓝 | 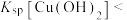 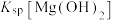 |
| D | 比较配离子 、 、 的稳定性 的稳定性 | 将 \固体溶于水,加入适量浓盐酸后,再加入少量 \固体溶于水,加入适量浓盐酸后,再加入少量 固体。溶液先由粉红色变为蓝色,再由蓝色变成粉红色(已知: 固体。溶液先由粉红色变为蓝色,再由蓝色变成粉红色(已知: 呈粉红色, 呈粉红色, 呈蓝色, 呈蓝色, 呈无色) 呈无色) | 稳定性: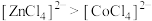 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-27更新
|
225次组卷
|
3卷引用:山东省威海市2023-2024学年高三上学期期末考试化学试题
2 . 下列关于沉淀的叙述不正确的是
| A.生产、科研中常利用生成沉淀来达到分离或除杂的目的 |
| B.沉淀的溶解只能通过酸碱中和反应来实现 |
| C.沉淀转化的实质就是沉淀溶解平衡的移动 |
| D.一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现 |
您最近一年使用:0次
2022-12-20更新
|
67次组卷
|
3卷引用:山东省威海市文登新一中2021-2022学年高二上学期期中考试化学试题
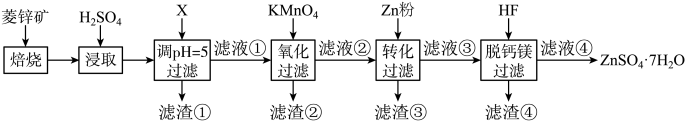
3 . 硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______ 。
(2)为了提高锌的浸取效果,可采取的措施有_______ 、_______ 。
(3)加入物质X调溶液 ,最适宜使用的X是
,最适宜使用的X是_______ (填标号)。
A. B.
B. C.
C.
滤渣①的主要成分是_______ 、_______ 、_______ 。
(4)向 的滤液①中分批加入适量
的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有
溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为
,该步反应的离子方程式为_______ 。
(5)滤液②中加入锌粉的目的是_______ 。
(6)滤渣④与浓 反应可以释放HF并循环利用,同时得到的副产物是
反应可以释放HF并循环利用,同时得到的副产物是_______ 、_______ 。
| 离子 |  |  |  |  |  |
 | 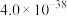 | 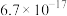 | 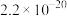 |  | 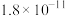 |
(1)菱锌矿焙烧生成氧化锌的化学方程式为
(2)为了提高锌的浸取效果,可采取的措施有
(3)加入物质X调溶液
 ,最适宜使用的X是
,最适宜使用的X是A.
 B.
B. C.
C.
滤渣①的主要成分是
(4)向
 的滤液①中分批加入适量
的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有
溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为
,该步反应的离子方程式为(5)滤液②中加入锌粉的目的是
(6)滤渣④与浓
 反应可以释放HF并循环利用,同时得到的副产物是
反应可以释放HF并循环利用,同时得到的副产物是
您最近一年使用:0次
2022-06-08更新
|
25577次组卷
|
33卷引用:山东省威海乳山市银滩高级中学2022-2023学年高二12月月考化学试题
山东省威海乳山市银滩高级中学2022-2023学年高二12月月考化学试题2022年高考全国甲卷化学真题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题15 工艺流程综合题-备战2023年高考化学母题题源解密(全国通用)陕西省西安市长安区第一中学2021-2022学年高二下学期期末考试化学试题江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题河南省商丘市夏邑县第一高级中学2021-2022学年高二下学期6月份月考化学试题云南省部分重点中学2022-2023学年高三上学期月考化学试题河北省石家庄市第四十三中学2022-2023学年高三上学期10月月考化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期9月月考化学试题黑龙江省大庆市肇州县第二中学2022-2023学年高三上学期第二次月考化学试题河南省宋基信阳实验中学2022-2023学年高三上学期11月月考化学试题山东省德州市第一中学2022-2023学年高二上学期期末线上考试化学试题第二部分 热点专项突破——解题能力稳提升 专项1 物质制备类的工艺流程 热点1 以矿物为载体的工艺流程超重点6 高考热点命题素材——过渡金属元素湖北省襄阳市第五中学2022-2023学年高二上学期12月月考化学试题(已下线)题型38 其他金属的冶炼(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)回归教材重难点04 “9种”物质的性质及应用-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省江油中学2023-2024学年高三上学期9月月考理科综合化学试题上海市复旦大学附属中学2023-2024学年高二上学期期中考试化学试卷湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建云南省宣威市第九中学2023-2024学年高三下学期入学考试理综试题-高中化学
4 . 下列有关说法正确的是
A. 和 和 溶于水后均能导电,故 溶于水后均能导电,故 和 和 均为电解质 均为电解质 |
B.高炉炼铁中焦炭直接将 还原成铁 还原成铁 |
C.相同条件下, ,故 ,故 沉淀易转化成 沉淀易转化成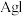 沉淀 沉淀 |
D. 能溶于 能溶于 溶液,也能溶于氢氟酸,所以是两性氧化物 溶液,也能溶于氢氟酸,所以是两性氧化物 |
您最近一年使用:0次
名校
5 . 某温度下,Ksp[Pd(OH)2]=1.0×10-30。向物质的量浓度相同的NaOH和Na2S的混合溶液中滴加Pd(NO3)2溶液产生Pd(OH)2、PdS两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。图中的p(Pd)=-lgc(Pd2+),p(B)=-lgc(OH-)或-lgc(S2-)。下列说法错误的是( )
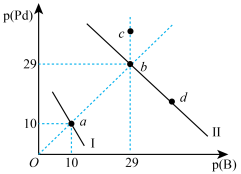

| A.曲线Ⅰ表示的是Pd2+与OH-浓度关系的曲线 |
| B.该温度下,Ksp(PdS)=1.0×10 -58 |
| C.升高温度时,b点可能会向c点移动 |
| D.该温度下,向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动 |
您最近一年使用:0次
2019-10-13更新
|
395次组卷
|
3卷引用:山东省威海市文登新一中2021-2022学年高二上学期期中考试化学试题
名校
6 . 尿素[CO(NH2)2] 是一种重要的氮肥,在工农业生产中广泛应用。
(1)工业制备尿素的反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是
CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是____________ 。
a.平衡时,NH3的浓度为0.02 mol•L‾1
b.当v(NH3)正=2v(H2O)逆时,反应达到平衡状态
c.若在恒温恒压条件下充入稀有气体,平衡发生正向移动
d.加入适当的催化剂可提高CO2的转化率
(2)尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是___________ ;碳酸铵溶液中离子浓度由大到小的顺序为_____________ ;如果将一定浓度的碳酸铵溶液加入到相同浓度的稀BaCl2和ZnCl2混合液中,首先析出的沉淀是__________ 。(已知Ksp(BaCO3)=5.1×10-9mol2•L-2,Ksp(ZnCO3)=1.4×10-11 mol2•L-2)
(3)用甲醛法可以间接测定尿素含氮量。尿素通过处理转化为铵盐,甲醛与NH4+作用,其反应如下:4NH4++6HCHO=(CH2)6N4H++3H++6H2O。所生成的H+和(CH2)6N4H+都可与NaOH溶液反应,用NaOH标准溶液滴定时采用酚酞作指示剂。
称取Wg尿素样品,经转化后得到1000mL溶液,量取25.00mL放入锥形瓶中,滴加2滴酚酞,用0.1000mol•L-1NaOH标准溶液滴定,滴定至终点时,消耗碱液体积20.50mL。
① 滴定至终点的现象是__________________________ 。
② 该尿素样品的纯度为__________________________ 。
(1)工业制备尿素的反应2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是
CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是a.平衡时,NH3的浓度为0.02 mol•L‾1
b.当v(NH3)正=2v(H2O)逆时,反应达到平衡状态
c.若在恒温恒压条件下充入稀有气体,平衡发生正向移动
d.加入适当的催化剂可提高CO2的转化率
(2)尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是
(3)用甲醛法可以间接测定尿素含氮量。尿素通过处理转化为铵盐,甲醛与NH4+作用,其反应如下:4NH4++6HCHO=(CH2)6N4H++3H++6H2O。所生成的H+和(CH2)6N4H+都可与NaOH溶液反应,用NaOH标准溶液滴定时采用酚酞作指示剂。
称取Wg尿素样品,经转化后得到1000mL溶液,量取25.00mL放入锥形瓶中,滴加2滴酚酞,用0.1000mol•L-1NaOH标准溶液滴定,滴定至终点时,消耗碱液体积20.50mL。
① 滴定至终点的现象是
② 该尿素样品的纯度为
您最近一年使用:0次
7 . 已知常温下,几种难溶电解质的溶度积(Ksp):
下列说法不正确的是( )
| 化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
| 溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
| A.在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| B.在Mg(OH)2 的悬浊液中加入NaF 溶液后,Mg(OH)2 不可能转化为MgF2 |
| C.CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质 |
| D.向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀 |
您最近一年使用:0次
2018-01-18更新
|
713次组卷
|
6卷引用:山东省荣成市第六中学2018-2019学年高二上学期12月月考化学试题



