1 . 利用平衡移动原理,分析一定温度下 在不同
在不同 的
的 体系中的可能产物。
体系中的可能产物。
已知:i.图1中曲线表示 体系中各含碳粒子的物质的量分数与
体系中各含碳粒子的物质的量分数与 的关系。
的关系。
ii.2中曲线Ⅰ的离子浓度关系符合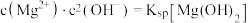 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合 [注:起始
[注:起始 ,不同
,不同 下
下 由图1得到]。
由图1得到]。
 在不同
在不同 的
的 体系中的可能产物。
体系中的可能产物。已知:i.图1中曲线表示
 体系中各含碳粒子的物质的量分数与
体系中各含碳粒子的物质的量分数与 的关系。
的关系。ii.2中曲线Ⅰ的离子浓度关系符合
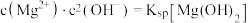 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合 [注:起始
[注:起始 ,不同
,不同 下
下 由图1得到]。
由图1得到]。
A.由图1, |
B.由图2,初始状态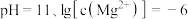 ,无沉淀生成 ,无沉淀生成 |
C.由图2,初始状态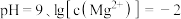 ,平衡后溶液中存在 ,平衡后溶液中存在 |
D.由图1和图2,初始状态 、 、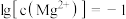 ,发生反应: ,发生反应: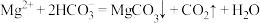 |
您最近一年使用:0次
2023-06-28更新
|
9357次组卷
|
28卷引用:2023年高考北京卷化学真题
2023年高考北京卷化学真题(已下线)2023年北京卷高考真题变式题(选择题11-14)(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题江苏省常州市联盟学校2023-2024学年高三上学期10月学情调研化学试题(已下线)第32讲难溶电解质的溶解平衡(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京市清华大学附属中学2023-2024学年高三上学期12月统练(六)化学试题北京市清华大学附属中学朝阳学校2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 福建省厦门市 第一中学2023-2024上学期高三上学期12月考化学试题河北省石家庄二中实验学校2023-2024学年高二上学期12月月考化学试题北京市铁路第二中学2023-2024学年高三上学期期中考试化学试题北京市第三中学2023-2024学年高二上学期期中练习化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)山东省滕州市第一中学2023-2024学年高二上学期12月月考化学试题北京市2023-2024学年北京三中高二(上)期中化学试卷 (已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)黑龙江省鸡西实验中学2023-2024学年高三上学期期末考试化学试题(已下线)北京市第四中学2023-2024学年高二上学期期末考试化学试题北京市海淀区教师进修学校附属实验学校2023-2024学年高二上学期12 月月考化学练习北京市中国人民大学附属中学2023-2024学年高三下学期一模模拟化学试题(已下线)选择题6-10
2 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:

已知:最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________ ;pH>9时,会导致___________ 。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。

已知:最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
2023-06-10更新
|
18511次组卷
|
18卷引用:2023年高考新课标理综化学真题
2023年高考新课标理综化学真题(已下线)T26-工业流程题(已下线)2023年高考化学真题完全解读(新课标卷:适用安徽、云南、山西、吉林、黑龙江五省)(PPT+Word)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省滨州市2023-2024学年高三上学期11月期中考试化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建
3 . 白云石的主要化学成分为 ,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
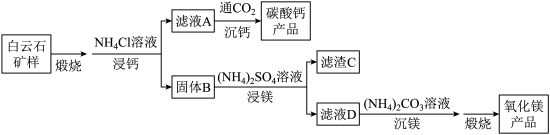
已知:
(1)白云石矿样煅烧完全分解的化学方程式为___________ 。
(2)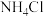 用量对碳酸钙产品的影响如下表
用量对碳酸钙产品的影响如下表
备注:ⅰ、 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量) (M代表Ca或Mg)
(M代表Ca或Mg)
ⅱ、 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。
①解释“浸钙”过程中主要浸出 的原因是
的原因是___________ 。
②沉钙反应的离子方程式为___________ 。
③“浸钙”过程不适宜选用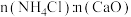 的比例为
的比例为___________ 。
④产品中 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是___________ 。
(3)“浸镁”过程中,取固体B与一定浓度的 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是___________ 。
(4)滤渣C中含有的物质是___________ 。
(5)该流程中可循环利用的物质是___________ 。
 ,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
已知:
| 物质 |  |  |  |  |
 | 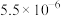 |  |  | 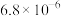 |
(1)白云石矿样煅烧完全分解的化学方程式为
(2)
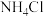 用量对碳酸钙产品的影响如下表
用量对碳酸钙产品的影响如下表| n(NH4Cl)/n(CaO) | 氧化物( )浸出率/% )浸出率/% | 产品中 纯度/% 纯度/% | 产品中Mg杂质含量/% (以  计) 计) | ||
 |  | 计算值 | 实测值 | ||
| 2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
| 2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
| 2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量) (M代表Ca或Mg)
(M代表Ca或Mg)ⅱ、
 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。①解释“浸钙”过程中主要浸出
 的原因是
的原因是②沉钙反应的离子方程式为
③“浸钙”过程不适宜选用
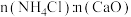 的比例为
的比例为④产品中
 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是(3)“浸镁”过程中,取固体B与一定浓度的
 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是(4)滤渣C中含有的物质是
(5)该流程中可循环利用的物质是
您最近一年使用:0次
2022-09-08更新
|
10085次组卷
|
14卷引用:2022年北京市高考真题化学试题(部分试题)
(已下线)2022年北京市高考真题化学试题(部分试题)2022年北京市高考真题化学试题(已下线)第08讲 铝、镁及其重要化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)2022年北京高考真题变式题15-19天津市耀华中学2022-2023学年高三上学期第一次月考化学试题(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题(已下线)易错点33 物质的制备-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十 工艺流程中的新工艺(已下线)北京市第四中学2022-2023学年高三上学期阶段测试2化学试题(已下线)2022年北京高考真题化学试题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)北京交通大学附属中学2023-2024学年高三下学期开学考化学试题
4 . 硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______ 。
(2)为了提高锌的浸取效果,可采取的措施有_______ 、_______ 。
(3)加入物质X调溶液 ,最适宜使用的X是
,最适宜使用的X是_______ (填标号)。
A. B.
B. C.
C.
滤渣①的主要成分是_______ 、_______ 、_______ 。
(4)向 的滤液①中分批加入适量
的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有
溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为
,该步反应的离子方程式为_______ 。
(5)滤液②中加入锌粉的目的是_______ 。
(6)滤渣④与浓 反应可以释放HF并循环利用,同时得到的副产物是
反应可以释放HF并循环利用,同时得到的副产物是_______ 、_______ 。
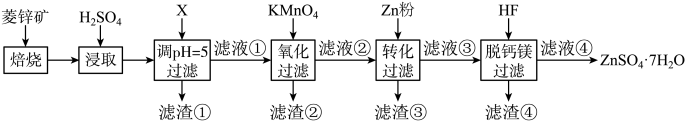
| 离子 |  |  |  |  |  |
 |  |  | 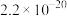 |  | 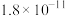 |
(1)菱锌矿焙烧生成氧化锌的化学方程式为
(2)为了提高锌的浸取效果,可采取的措施有
(3)加入物质X调溶液
 ,最适宜使用的X是
,最适宜使用的X是A.
 B.
B. C.
C.
滤渣①的主要成分是
(4)向
 的滤液①中分批加入适量
的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有
溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为
,该步反应的离子方程式为(5)滤液②中加入锌粉的目的是
(6)滤渣④与浓
 反应可以释放HF并循环利用,同时得到的副产物是
反应可以释放HF并循环利用,同时得到的副产物是
您最近一年使用:0次
2022-06-08更新
|
25466次组卷
|
33卷引用:2022年高考全国甲卷化学真题
2022年高考全国甲卷化学真题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题15 工艺流程综合题-备战2023年高考化学母题题源解密(全国通用)陕西省西安市长安区第一中学2021-2022学年高二下学期期末考试化学试题江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题河南省商丘市夏邑县第一高级中学2021-2022学年高二下学期6月份月考化学试题云南省部分重点中学2022-2023学年高三上学期月考化学试题河北省石家庄市第四十三中学2022-2023学年高三上学期10月月考化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期9月月考化学试题黑龙江省大庆市肇州县第二中学2022-2023学年高三上学期第二次月考化学试题河南省宋基信阳实验中学2022-2023学年高三上学期11月月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高二12月月考化学试题山东省德州市第一中学2022-2023学年高二上学期期末线上考试化学试题第二部分 热点专项突破——解题能力稳提升 专项1 物质制备类的工艺流程 热点1 以矿物为载体的工艺流程超重点6 高考热点命题素材——过渡金属元素湖北省襄阳市第五中学2022-2023学年高二上学期12月月考化学试题(已下线)题型38 其他金属的冶炼(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)回归教材重难点04 “9种”物质的性质及应用-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省江油中学2023-2024学年高三上学期9月月考理科综合化学试题上海市复旦大学附属中学2023-2024学年高二上学期期中考试化学试卷湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建云南省宣威市第九中学2023-2024学年高三下学期入学考试理综试题-高中化学
5 . 以菱镁矿(主要成分为MgCO3,含少量SiO2,Fe2O3和A12O3)为原料制备高纯镁砂的工艺流程如下:
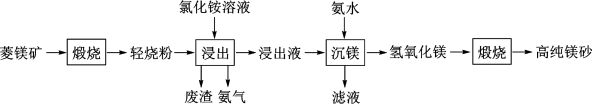
A.浸出镁的反应为 |
| B.浸出和沉镁的操作均应在较高温度下进行 |
| C.流程中可循环使用的物质有NH3、NH4Cl |
| D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同 |
您最近一年使用:0次
2020-07-11更新
|
10465次组卷
|
75卷引用:2020年山东省高考化学试卷(新高考)
2020年山东省高考化学试卷(新高考)(已下线)专题15 工艺流程题-2020年高考真题和模拟题化学分项汇编(已下线)第七单元 水溶液中的离子平衡测试题-2021年高考化学一轮复习名师精讲练黑龙江省大庆实验中学2021届高三8月开学考试化学试题广东省仲元中学、中山一中等七校联合体2021届高三上学期第一次联考化学试题(已下线)小题必刷16 金属元素为载体的化工流程选择题——2021年高考化学一轮复习小题必刷(通用版)山东省枣庄市第三中学2021届高三上学期9月阶段性检测化学试题(已下线)小题必刷20 氮及其化合物——2021年高考化学一轮复习小题必刷(通用版)福建省福州市第四中学2021届高三10月月考化学试题山东省临沂市莒南第二中学2021届高三10月月考化学试题广东省珠海市第二中学2021届高三10月月考化学试题广东省云浮市郁南县蔡朝焜纪念中学2021届高三10月月考化学试题河南省南阳市2021届高三期中质量评估化学试题广东省汕头市金山中学2021届高三上学期期中考试化学试题吉林松原市油田第十一中学2021届高三第二次阶段考试化学试题重庆市第七中学2021届高三上学期期中化学试题湖南省邵东县第一中学2021届高三上学期第三次月考化学试题湖北省随州市第一中学2021届高三11月月考化学试题(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)热点5 常见元素及其化合物的性质与应用-2021年高考化学专练【热点·重点·难点】(已下线)热点5 常见元素及其化合物的性质与相互转化-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)热点8 无机化工流程分析(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)河南省南阳市2021届高三上期期中考试化学试题(已下线)【苏州新东方】2021.04江苏省苏州市十中三中期中联考.(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)难点1 化工流程微设计-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)考向07 铁及其重要化合物-备战2022年高考化学一轮复习考点微专题(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)北京市十一学校2022 届高三上学期开学考试(暑期学习检测)化学试题安徽省合肥市第九中学2022届高三第一次阶段测验化学试卷(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省聊城市高唐县第一中学2021-2022学年高三上学期开学考试化学试题(已下线)第3周 周测卷-备战2022年高考化学周测与晚练(新高考专用)江西省宜春市丰城市第九中学2021-2022学年高三上学期第三次月考化学试题河南省温县第一高级中学2021-2022学年高三上学期10月月考化学试题江苏省淮安市高中校协作体2021-2022学年高三上学期期中考试化学试题辽宁省沈阳市重点高中联合体2021-2022学年高三12月考试化学试题河北省石家庄市新华中学2020-2021学年高三上学期10月月考化学试题(已下线)第十单元 化学实验基础(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)河南省信阳市罗山县2021-2022学年高三上学期高中毕业班第二次调研考试化学试题(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)河南省驻马店市2021-2022学年高二上学期期末考试化学试题福建省龙岩第一中学2021-2022学年高三上学期第三次月考化学试题陕西省西北农林科技大学附属中学2021-2022学年高二上学期期末考试化学试题(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)山西省长治市沁源县第一中学等名校2021-2022学年高二下学期5月联考化学试题(已下线)2020年山东卷化学高考真题变式题1-10(已下线)考点50 物质的分离、提纯和检验-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第08练 金属材料-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第21练 自然资源的开发利用-2023年高考化学一轮复习小题多维练(全国通用)重庆市第七中学校2021-2022学年高二上学期第二次月考化学试题(已下线)第08讲 金属材料(练)-2023年高考化学一轮复习讲练测(新教材新高考)第三章 综合拔高练(已下线)专题讲座(八) 无机化工流程题的解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)湖南省常德市汉寿县第一中学2022-2023学年高三上学期第一次月考化学试题福建省厦门市湖滨中学2022-2023学年高三上学期期中考试化学试题山东省淄博市桓台第二中学2021-2022学年高一9月月考化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题09 常见金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第三章 金属及其化合物 第15讲 金属材料 金属冶炼进阶训练5(已下线)题型26 碱土金属元素及其化合物北京市一零一中学2022-2023学年高三下学期3月统练二化学试题(已下线)专题10 物质的反应及转化(已下线)第5讲 铝、镁及其重要化合物安徽六校教育研究会2024届高三上学期入学素质测试化学试题福建省三明第一中学2022-2023学年高三上学期期中考试化学试题江苏省苏南八校2023-2024学年高二上学期12月联考化学(创新班)试卷云南省大理州实验中学2021-2022学年高二上学期化学期中考试题福建省福建师范大学附属中学2023-2024学年高三上学期开学考化学试题湖南省长沙市一中2024届高三高考适应性演练(二)化学试题
6 . 已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1mol·L—1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是
A.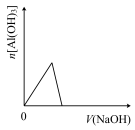 | B. | C.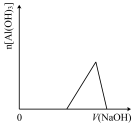 | D.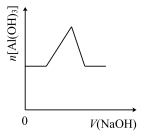 |
您最近一年使用:0次
2019-01-30更新
|
1795次组卷
|
16卷引用:2012年普通高等学校招生全国统一考试理综化学部分(安徽卷)
2012年普通高等学校招生全国统一考试理综化学部分(安徽卷)(已下线)2013届江西省吉安一中、新余一中高三联考化学试卷(已下线)2014-2015河北保定某重点中学同步作业(必修1苏教版)3.1.2铝的化合物2016届天津一中高三零月考化学试卷2016届河南省宜阳县实验学校高三第二次月考化学试卷2015-2016学年山东省淄博市淄川一中等三校高二上期末联考化学试卷2015-2016学年西藏日喀则一中高二下学期期末化学试卷2017届广东省广东实验中学高三上8月月考化学试卷2017届陕西省西安一中高三上期中化学试卷2017届河北省八所重点中学高三下学期第一次联考化学试卷山东省枣庄市第三中学2017-2018学年高二第六学段学情调查(1月)化学试题福建省永春县第一中学等校2018届高三上学期第一次四校联考化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高二上学期第一次月考化学试题江西省抚州市黎川县第一中学2021-2022学年上学期高三第三次同步考试化学试题湖南省三湘名校教育联盟、五市十校教研教改共同体2021-2022学年高二下学期期中考试化学试题(已下线)电离 水解 溶解平衡图像



