名校
解题方法
1 . 下表是几种弱电解质的电离平衡常数(25℃)
回答下列问题:
(1)由上表分析,若①CH3COOH② ③HA④
③HA④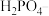 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为___________ (填序号)。
(2)试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:___________ ;试写出HA与Na3PO4反应的离子方程式:_______ 。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中: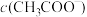
___________ 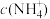 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是_____。
(5)已知BaSO4的溶解度随温度升高而增大。如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
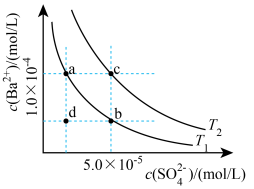
①T1_______ T2(填>、=、<)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是_______ 。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
| 电解质 | 电离方程式 | 平衡常数K |
 |  | 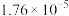 |
 |   | 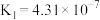 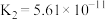 |
 |  | 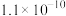 |
 | 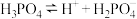   |   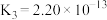 |
 | 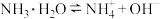 | 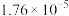 |
(1)由上表分析,若①CH3COOH②
 ③HA④
③HA④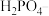 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为(2)试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:
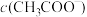
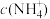 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(4)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是_____。
| A.若混合液pH>7,则V≥10 |
B.若混合液pH<7,则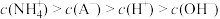 |
| C.V=10时,混合液中水电离程度大于10mL0.01mol/LHA溶液中水的电离程度 |
D.V=5时, |
(5)已知BaSO4的溶解度随温度升高而增大。如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
您最近半年使用:0次
名校
2 . 下列实验中,由实验现象不能得到正确结论的是
| 选项 | 实验 | 现象 | 结论 |
| A | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 沉淀由白色变为红褐色 | Fe(OH)3的溶解度小于Mg(OH)2的溶解度 |
| B | 在醋酸钠溶液中滴入酚酞溶液并加热 | 加热后红色加深 | 证明盐类水解是吸热反应 |
| C | 向1.0 mol·L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 |
| D | 相同的铝片分别与同温同体积,且c(H+)=1 mol·L-1的盐酸、硫酸反应 | 铝与盐酸反应产生气泡较快 | 可能是Cl-对该反应起到促进作用 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-11-16更新
|
243次组卷
|
4卷引用:上海市控江中学2023-2024学年高二上学期等级班阶段测验卷二 化学试题
3 . 25℃,向少量BaSO4中加入足量Na2CO3饱和溶液,充分搅拌、静置、过滤、洗涤,向滤渣中加盐酸,滤渣溶解且有CO2产生(已知:①部分物质的溶解度如下表;②稀溶液的密度看作1.0g· mL-1)。下列分析正确的是
物质 | BaSO4 | BaCO3 | Ba(OH)2 |
| 25℃溶解度g/100g水 | 2.33×10- 4 | 1.38×10-3 | 5 |
| A.BaSO4饱和溶液中c(Ba2+)约为1×10-4 mol·L- 1 |
B.BaSO4的电离方程式为:BaSO4 Ba2++ Ba2++ |
C. 与Ba2+生成BaCO3,使BaSO4电离平衡右移 与Ba2+生成BaCO3,使BaSO4电离平衡右移 |
| D.将Na2CO3换成0.5mol·L-1NaOH溶液,得不到Ba(OH)2沉淀 |
您最近半年使用:0次
2022-06-03更新
|
253次组卷
|
3卷引用:上海市复旦大学附属中学2022届高三下学期5月线上测试化学试题
上海市复旦大学附属中学2022届高三下学期5月线上测试化学试题上海市杨浦高级中学2021-2022学年高三下学期5月线上教学质量评估化学试题(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)
名校
4 . t℃时将NaOH溶液蒸去8.2g水后,恢复至t℃时,析出5.8gNaOH·H2O晶体,再蒸去1.2g水,恢复至t℃时,又析出5.8gNaOH·H2O晶体,则t℃时无水NaOH的溶解度约为
| A.483.3g/100g水 | B.61.5g/100g水 | C.133.3g/100g水 | D.333.3g/100g水 |
您最近半年使用:0次
2021-08-06更新
|
158次组卷
|
2卷引用:上海市青浦高级中学2019年TI数理实验班选拔测试化学试题
名校
解题方法
5 . 下列实验中根据现象得出的结论错误的是
| 选项 | 实验 | 现象 | 结论 |
| A | 相同条件下,用0.1mol·L−1的CH3COOH和0.1mol·L−1的HCl分别做导电性实验 | CH3COOH溶液对应的灯泡较暗 | CH3COOH是弱电解质 |
| B | 向某溶液中加铜和浓H2SO4 | 试管口有红棕色气体产生 | 原溶液可能含有NO |
| C | 向某钠盐中滴加浓盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐为Na2SO3或NaHSO3 |
| D | 向浓度均为0.1mol·L−1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | 溶解度:Cu(OH)2<Mg(OH)2 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-03-30更新
|
393次组卷
|
15卷引用:上海市七宝中学2021届高三下学期3月摸底考试化学试题
上海市七宝中学2021届高三下学期3月摸底考试化学试题【全国百强校】山东省师范大学附属中学2018届高三第十一次模拟化学试题【全国校级联考】江西省红色七校2019届高三第一次联考化学试题湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题【全国百强校】河南省许昌市许昌高级中学2019届高三上学期第一次诊断考试化学试题河北省衡水中学2019届高三下学期二调考试理科综合化学试题四川省射洪县射洪中学2018-2019学年高二下学期期中考试化学试题四川省成都外国语学校2018-2019学年高二5月月考化学试题山东济宁市兖州区2020届高三网络模拟考试化学试题菏泽一中2020届高三3月份化学质量检测肥城一中2020届高三3月份在线检测化学试题内蒙古自治区乌兰察布市集宁一中2019-2020学年高二下学期第三次月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测海南省三亚市第一中学2021-2022学年高三下学期最后一卷化学试题辽宁省辽阳县第一高级中学2022-2023学年高三上学期1月月考化学试题
6 . 下列实验不能达到预期目的是( )
| 实验操作 | 实验目的 | |
| A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 苯酚和水的浊液中,加少量浓碳酸钠溶液 | 比较苯酚与碳酸氢钠的酸性 |
| D | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 | 确定NaHCO3溶液中是否混有Na2CO3 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
7 . 向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象。_______________________________
您最近半年使用:0次
2019-12-22更新
|
99次组卷
|
2卷引用:【全国百强校】上海市复旦大学附属中学2019—2020学年高三上学期期中考试化学试题
名校
8 . 下列叙述正确的是
| A.两种难溶性盐,Ksp较小的,其溶解度也一定较小 |
| B.稀释氨水溶液,溶液中所有离子的浓度都降低 |
| C.稀释醋酸钠溶液,CH3COO- 水解程度变大,故溶液的pH增大 |
| D.相同条件下,HA比HB易电离,则NaA溶液的pH比NaB溶液的pH小 |
您最近半年使用:0次
2017-07-13更新
|
199次组卷
|
3卷引用:沪科版化学高二拓展性课程3《化学中的平衡》测试题
名校
9 . 如图,向烧杯中滴加几滴浓盐酸,CaCO3 固体还有剩余(忽略体积、温度的变化),下列数值变小的是


| A.c(Ca 2 ) | B.c(CO32 ) | C.c(H ) | D.碳酸钙的溶解度 |
您最近半年使用:0次
2017-04-12更新
|
307次组卷
|
5卷引用:2017届上海市杨浦区高三上学期期末等级考质量调研(一模)化学试卷



