下表是几种弱电解质的电离平衡常数(25℃)
回答下列问题:
(1)由上表分析,若①CH3COOH② ③HA④
③HA④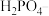 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为___________ (填序号)。
(2)试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:___________ ;试写出HA与Na3PO4反应的离子方程式:_______ 。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中: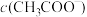
___________ 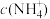 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是_____。
(5)已知BaSO4的溶解度随温度升高而增大。如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
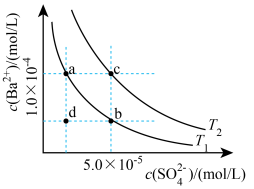
①T1_______ T2(填>、=、<)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是_______ 。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
| 电解质 | 电离方程式 | 平衡常数K |
 |  | 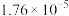 |
 |   | 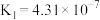 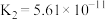 |
 |  | 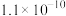 |
 | 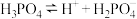   |   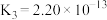 |
 | 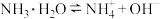 | 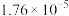 |
(1)由上表分析,若①CH3COOH②
 ③HA④
③HA④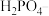 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为(2)试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:
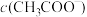
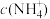 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(4)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是_____。
| A.若混合液pH>7,则V≥10 |
B.若混合液pH<7,则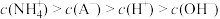 |
| C.V=10时,混合液中水电离程度大于10mL0.01mol/LHA溶液中水的电离程度 |
D.V=5时, |
(5)已知BaSO4的溶解度随温度升高而增大。如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
更新时间:2023-11-29 03:04:25
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
(1)滴定Ti3+时可选用___________ 作指示剂,滴定过程中发生反应的离子方程式为___________ ,
(2)达到滴定终点的现象是___________ 。
(3)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列)___________ 。
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(4)TiCl4两步反应可制得TiO2,第一步水解反应生成TiO2•xH2O,第一步水解反应的方程式为___________ 。
(1)滴定Ti3+时可选用
(2)达到滴定终点的现象是
(3)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列)
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(4)TiCl4两步反应可制得TiO2,第一步水解反应生成TiO2•xH2O,第一步水解反应的方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】回答下列问题
(1)常温下向一定浓度的 溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:
溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知: 是二元弱酸,Y表示
是二元弱酸,Y表示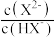 或
或 ,
, 。回答下列问题:
。回答下列问题:
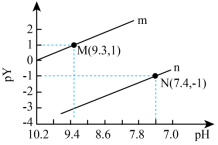
①曲线n表示p_______ (填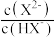 或
或 )与pH的变化关系。
)与pH的变化关系。
②
_______ 。
③NaHX溶液呈_______ 性(填“酸”、“碱”或“中”)。
(2)在 溶液中,加入
溶液中,加入 固体可制备莫尔盐[
固体可制备莫尔盐[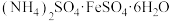 ]晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表:(已知莫尔盐的分子量为392)
]晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表:(已知莫尔盐的分子量为392)
滴定终点的现象是_______ ,通过实验数据,计算该产品的纯度为_______ (用含字母a、c的式子表示)。表中第一次实验中记录数据明显大于后两次,其原因可能是_______ 。
A.第一次滴定时,锥形瓶用待装液润洗
B.读数时:滴定前平视,滴定后俯视
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
(1)常温下向一定浓度的
 溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:
溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知: 是二元弱酸,Y表示
是二元弱酸,Y表示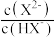 或
或 ,
, 。回答下列问题:
。回答下列问题:
①曲线n表示p
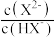 或
或 )与pH的变化关系。
)与pH的变化关系。②

③NaHX溶液呈
(2)在
 溶液中,加入
溶液中,加入 固体可制备莫尔盐[
固体可制备莫尔盐[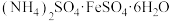 ]晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表:(已知莫尔盐的分子量为392)
]晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表:(已知莫尔盐的分子量为392)| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液体积/mL 溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.第一次滴定时,锥形瓶用待装液润洗
B.读数时:滴定前平视,滴定后俯视
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
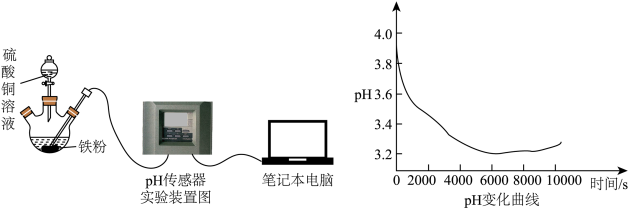
【推荐3】I.某化学兴趣小组探究铁粉与硫酸铜溶液反应时溶液pH变化。
(1)甲同学提出硫酸铜溶液显酸性,理由是_______ (写离子方程式),加入铁粉消耗了 和
和 ,溶液pH会
,溶液pH会_______ (填“增大”、“不变”或“减小”;已知相同条件下, 的水解程度强于
的水解程度强于 )。
)。
Ⅱ.乙同学用pH传感器测铁粉和 溶液反应时溶液pH的变化。
溶液反应时溶液pH的变化。
【实验用品】仪器:pH传感器、笔记本电脑、带橡皮塞的 三颈烧瓶、铁架台、分液漏斗等。
三颈烧瓶、铁架台、分液漏斗等。
试剂: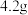 铁粉、
铁粉、 溶液。
溶液。
【实验步骤】向三颈烧瓶中加入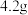 铁粉,将
铁粉,将 溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
(2)乙同学猜想反应过程中pH下降与亚铁离子和溶液中氧气反应有关,理由是_______ (写离子方程式;常温下, 在
在 时完全沉淀)。
时完全沉淀)。
(3)为了验证猜想,乙同学用煮沸后冷却的蒸馏水新配制 溶液,重新进行实验。
溶液,重新进行实验。
①配制 溶液所用的蒸馏水需提前煮沸、冷却的目的是
溶液所用的蒸馏水需提前煮沸、冷却的目的是_______ ,配制 溶液需要称量
溶液需要称量_______ (保留小数点后一位)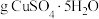 。
。
②下列实验操作会使所配制的溶液浓度偏高的是_______ (填标号)。
a.所称量的 失去部分结晶水
失去部分结晶水
b.容量瓶洗净后刻度线下残留少量水未处理
c.移液后未洗涤烧杯和玻璃棒
d.未用 溶液润洗容量瓶
溶液润洗容量瓶
③改进之后测得溶液pH的变化趋势为_______ ,证明乙同学的猜想正确(忽略容器内空气对实验的影响)。
(1)甲同学提出硫酸铜溶液显酸性,理由是
 和
和 ,溶液pH会
,溶液pH会 的水解程度强于
的水解程度强于 )。
)。Ⅱ.乙同学用pH传感器测铁粉和
 溶液反应时溶液pH的变化。
溶液反应时溶液pH的变化。【实验用品】仪器:pH传感器、笔记本电脑、带橡皮塞的
 三颈烧瓶、铁架台、分液漏斗等。
三颈烧瓶、铁架台、分液漏斗等。试剂:
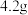 铁粉、
铁粉、 溶液。
溶液。【实验步骤】向三颈烧瓶中加入
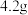 铁粉,将
铁粉,将 溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
(2)乙同学猜想反应过程中pH下降与亚铁离子和溶液中氧气反应有关,理由是
 在
在 时完全沉淀)。
时完全沉淀)。(3)为了验证猜想,乙同学用煮沸后冷却的蒸馏水新配制
 溶液,重新进行实验。
溶液,重新进行实验。①配制
 溶液所用的蒸馏水需提前煮沸、冷却的目的是
溶液所用的蒸馏水需提前煮沸、冷却的目的是 溶液需要称量
溶液需要称量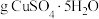 。
。②下列实验操作会使所配制的溶液浓度偏高的是
a.所称量的
 失去部分结晶水
失去部分结晶水b.容量瓶洗净后刻度线下残留少量水未处理
c.移液后未洗涤烧杯和玻璃棒
d.未用
 溶液润洗容量瓶
溶液润洗容量瓶③改进之后测得溶液pH的变化趋势为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】三氯氧磷(POCl3)可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化 PCl3 制备 POCl3,反应原理为:P4(白磷)+6Cl2 4PCl3,2PCl3+O2
4PCl3,2PCl3+O2 2POCl3。
2POCl3。
已知:PCl3、POCl3的部分性质如下:
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置和加热装置已略去):
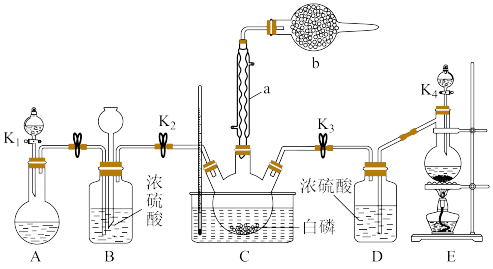
(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为___________ ,B装置的作用是___________ 。
(2)装置 E 反应的离子方程式为___________ 。
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是___________ 。分离提纯获得 POCl3 的实验方法是___________ 。
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:___________ 。实验过程中加入硝基苯覆盖沉淀的目的是___________ ,若无此操作,则所测POCl3的含量将___________ (填“偏高”“偏低”或“不变”)。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12]
(5)产品中POCl3的质量分数为___________ 。
 4PCl3,2PCl3+O2
4PCl3,2PCl3+O2 2POCl3。
2POCl3。已知:PCl3、POCl3的部分性质如下:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 |
| PCl3 | -112 | 75.5 | 137.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 153.5 | 遇水生成H3PO4和HCl |

(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为
(2)装置 E 反应的离子方程式为
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:
(5)产品中POCl3的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】氟及其化合物在生产生活中被广泛使用,造福人类。
(1)LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下
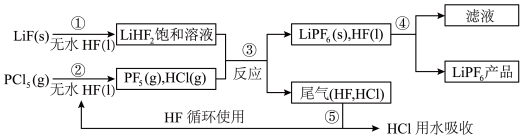
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
①反应设备不能用玻璃材质的原因是_________ (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的____ 溶液冲洗。
②该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:__________________________________________________ 。
③第④步分离采用的方法是_______ ;第⑤步分离尾气中HF、HCl采用的方法是________ 。
(2)工业上制备氟气通常采用电解氧化法,如图是电解熔融的氟氢化钾(KHF2)的实验装置:
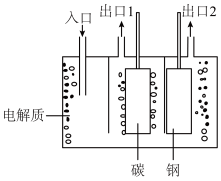
① 已知阴极的电极反应式为2 +2e-=H2↑+4F-,则电解的总反应为
+2e-=H2↑+4F-,则电解的总反应为 __________________
② 出口1处的物质是__________ (填化学式)。
(3)牙齿表面有一层釉质,其组成为羟基磷灰石Ca5(PO4)3OH(Ksp=6.8×10-21),容易受到酸的侵蚀,研究表明氟磷灰石Ca5(PO4)3F(Ksp=1.0×10-37)更能抵抗酸的腐蚀。请用平衡移动原理解释为什么人们常使用含氟牙膏防治蛀牙___________________ 。
(1)LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下

已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
①反应设备不能用玻璃材质的原因是
②该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:
③第④步分离采用的方法是
(2)工业上制备氟气通常采用电解氧化法,如图是电解熔融的氟氢化钾(KHF2)的实验装置:

① 已知阴极的电极反应式为2
 +2e-=H2↑+4F-,则电解的总反应为
+2e-=H2↑+4F-,则电解的总反应为 ② 出口1处的物质是
(3)牙齿表面有一层釉质,其组成为羟基磷灰石Ca5(PO4)3OH(Ksp=6.8×10-21),容易受到酸的侵蚀,研究表明氟磷灰石Ca5(PO4)3F(Ksp=1.0×10-37)更能抵抗酸的腐蚀。请用平衡移动原理解释为什么人们常使用含氟牙膏防治蛀牙
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】(1)室温时氢氧化钙的溶度积Ksp=4.7×10-6,室温时将9mL 0.02mol·L-1的氯化钙溶液与1mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中_____ 沉淀析出(填有或无)。
(2)2.24升(标准状态)氨气通入250mL浓度为0.1mol·L-1的硫酸溶液中,充分反应后溶液中各离子浓度由大到小的顺序为________ 。
(3)用下图完成相应实验。
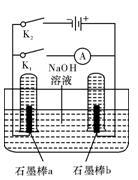
①断开K1,闭合K2接通直流电源,写出阳极的电极反应式__________ ;
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电路中有电流通过。写出a极的电极反应式______________________ 。
(2)2.24升(标准状态)氨气通入250mL浓度为0.1mol·L-1的硫酸溶液中,充分反应后溶液中各离子浓度由大到小的顺序为
(3)用下图完成相应实验。

①断开K1,闭合K2接通直流电源,写出阳极的电极反应式
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电路中有电流通过。写出a极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】完成下列问题。
(1)已知常温下,在 溶液中
溶液中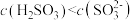 ,且
,且 的电离平衡常数为
的电离平衡常数为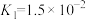 ,
,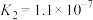 ;氨水的电离平衡常数为
;氨水的电离平衡常数为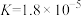 。则等物质的量浓度的下列五种溶液:①
。则等物质的量浓度的下列五种溶液:① ②
②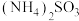 ③
③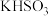 ④
④ ⑤
⑤ ,其中水的电离程度由大到小排列顺序为
,其中水的电离程度由大到小排列顺序为___________ (填序号)。
(2)已知 的电离常数
的电离常数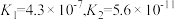 。下列微粒可以大量共存的是
。下列微粒可以大量共存的是___________ (填字母)。
a、 、
、 b、
b、 、
、 c、
c、 、
、 d、
d、 、
、
(3) 的含量(含杂质
的含量(含杂质 )通常利用“间接碘量法”测定。已知
)通常利用“间接碘量法”测定。已知 与
与 不反应,而
不反应,而 与
与 反应生成
反应生成 ,氧化性
,氧化性 ;
; 。步骤如下:
。步骤如下:
①称取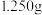 产品配成
产品配成 溶液。
溶液。
②取其中 溶液,加入足量的
溶液,加入足量的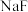 溶液后,滴加
溶液后,滴加 溶液至不再产生沉淀。
溶液至不再产生沉淀。
③用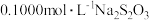 标准溶液滴定,平行滴定3次。
标准溶液滴定,平行滴定3次。
步骤②中,若不加足量的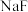 溶液,最终的测量值将
溶液,最终的测量值将___________ (填“偏大”“偏小”或“无影响”)。
若 标准溶液的平均用量为
标准溶液的平均用量为 ,则胆矾产品纯度为
,则胆矾产品纯度为___________ %。
(1)已知常温下,在
 溶液中
溶液中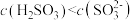 ,且
,且 的电离平衡常数为
的电离平衡常数为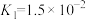 ,
,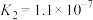 ;氨水的电离平衡常数为
;氨水的电离平衡常数为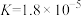 。则等物质的量浓度的下列五种溶液:①
。则等物质的量浓度的下列五种溶液:① ②
②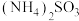 ③
③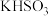 ④
④ ⑤
⑤ ,其中水的电离程度由大到小排列顺序为
,其中水的电离程度由大到小排列顺序为(2)已知
 的电离常数
的电离常数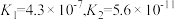 。下列微粒可以大量共存的是
。下列微粒可以大量共存的是a、
 、
、 b、
b、 、
、 c、
c、 、
、 d、
d、 、
、
(3)
 的含量(含杂质
的含量(含杂质 )通常利用“间接碘量法”测定。已知
)通常利用“间接碘量法”测定。已知 与
与 不反应,而
不反应,而 与
与 反应生成
反应生成 ,氧化性
,氧化性 ;
; 。步骤如下:
。步骤如下:①称取
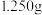 产品配成
产品配成 溶液。
溶液。②取其中
 溶液,加入足量的
溶液,加入足量的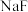 溶液后,滴加
溶液后,滴加 溶液至不再产生沉淀。
溶液至不再产生沉淀。③用
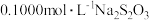 标准溶液滴定,平行滴定3次。
标准溶液滴定,平行滴定3次。步骤②中,若不加足量的
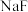 溶液,最终的测量值将
溶液,最终的测量值将若
 标准溶液的平均用量为
标准溶液的平均用量为 ,则胆矾产品纯度为
,则胆矾产品纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】H2O2在工业、农业、医药上都有广泛的用途.
(1)H2O2是二元弱酸,写出第一步的电离方程式__ ,第二步的电离平衡常数表达式Ka2=_________ .
(2)许多物质都可以做H2O2分解的催化剂.一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化).下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是________ .
①I - ②Fe3+ ③Cu2+ ④Fe2+
(3)H2O2是一种环境友好的强氧化剂.电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+等)制备硫酸镍的一种流程如下:

①第(ⅰ)步,加入H2O2反应的离子方程式_________________ .
②为测定NiSO4•nH2O的组成,进行如下实验:称取2.627g样品,配制成250.00mL溶液.准确量取配制的溶液25.00mL,用0.04000mol•L﹣1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2﹣=NiY2﹣+2H+),消耗EDTA标准溶液25.00mL.则硫酸镍晶体的化学式为__________________ .
(1)H2O2是二元弱酸,写出第一步的电离方程式
(2)许多物质都可以做H2O2分解的催化剂.一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化).下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是
①I - ②Fe3+ ③Cu2+ ④Fe2+
(3)H2O2是一种环境友好的强氧化剂.电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+等)制备硫酸镍的一种流程如下:

①第(ⅰ)步,加入H2O2反应的离子方程式
②为测定NiSO4•nH2O的组成,进行如下实验:称取2.627g样品,配制成250.00mL溶液.准确量取配制的溶液25.00mL,用0.04000mol•L﹣1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2﹣=NiY2﹣+2H+),消耗EDTA标准溶液25.00mL.则硫酸镍晶体的化学式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】化学反应原理与生产、生活密切相关。请回答以下问题。
(1)山西老陈醋是中国四大名醋之首,食醋的主要成分为醋酸。已知:25℃时 的电离常数
的电离常数 ,
, 的
的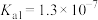 、
、 。请回答:25℃时,浓度均为
。请回答:25℃时,浓度均为 的
的 和
和 的缓冲溶液,
的缓冲溶液, ,该缓冲溶液中离子浓度由大到小的顺序是
,该缓冲溶液中离子浓度由大到小的顺序是___________ ,等浓度的 、
、 两种溶液的碱性较强的是
两种溶液的碱性较强的是___________ 。
(2)亚磷酸(H3PO3)是二元弱酸。已知25℃时, ,
,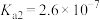 ,
, 属于
属于______ (填“酸式盐”或“正盐”); 溶液显
溶液显______ (填“酸性”“碱性”或“中性”)。
(3)在25℃下,将 的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=
的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=________ 。
(4)现有浓度均为 的几种溶液:①
的几种溶液:① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ,以上溶液中
,以上溶液中 由大到小的顺序
由大到小的顺序______ (填序号)。
(1)山西老陈醋是中国四大名醋之首,食醋的主要成分为醋酸。已知:25℃时
 的电离常数
的电离常数 ,
, 的
的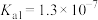 、
、 。请回答:25℃时,浓度均为
。请回答:25℃时,浓度均为 的
的 和
和 的缓冲溶液,
的缓冲溶液, ,该缓冲溶液中离子浓度由大到小的顺序是
,该缓冲溶液中离子浓度由大到小的顺序是 、
、 两种溶液的碱性较强的是
两种溶液的碱性较强的是(2)亚磷酸(H3PO3)是二元弱酸。已知25℃时,
 ,
,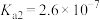 ,
, 属于
属于 溶液显
溶液显(3)在25℃下,将
 的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=
的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=(4)现有浓度均为
 的几种溶液:①
的几种溶液:① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ,以上溶液中
,以上溶液中 由大到小的顺序
由大到小的顺序
您最近一年使用:0次



