用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
(1)滴定Ti3+时可选用___________ 作指示剂,滴定过程中发生反应的离子方程式为___________ ,
(2)达到滴定终点的现象是___________ 。
(3)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列)___________ 。
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(4)TiCl4两步反应可制得TiO2,第一步水解反应生成TiO2•xH2O,第一步水解反应的方程式为___________ 。
(1)滴定Ti3+时可选用
(2)达到滴定终点的现象是
(3)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列)
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(4)TiCl4两步反应可制得TiO2,第一步水解反应生成TiO2•xH2O,第一步水解反应的方程式为
22-23高二上·浙江杭州·期中 查看更多[1]
(已下线)【2022】【高二上】【期中考】【高中化学】61
更新时间:2023-01-30 10:10:54
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是___________ (用离子方程式说明)。
(2)几种均为0.1mol•L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol•L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字),导致NH4HSO4溶液的pH随温度变化的原因是_________ 。
②20℃时,0.1mol•L-1NH4Al(SO4)2溶液中2c( )-C(
)-C( )-3c(Al3+)
)-3c(Al3+)_____ mol•L-1(列计算式不必化简)
(3)室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。

①试分析图中a、b、c、d四个点,水的电离程度最大的是___________ 点。
②在b点,溶液中各离子浓度由大到小的排列顺序是___________ 。
③由b到c发生反应的离子方程式为___________ 。
④a点之前发生反应的离子方程式为___________ 。
(1)NH4Al(SO4)2可作净水剂,其原理是
(2)几种均为0.1mol•L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol•L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20℃时,0.1mol•L-1NH4Al(SO4)2溶液中2c(
 )-C(
)-C( )-3c(Al3+)
)-3c(Al3+)(3)室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。

①试分析图中a、b、c、d四个点,水的电离程度最大的是
②在b点,溶液中各离子浓度由大到小的排列顺序是
③由b到c发生反应的离子方程式为
④a点之前发生反应的离子方程式为
您最近一年使用:0次
【推荐2】工业上用方铅矿(主要成分为PbS,含有少量FeS等杂质)和软锰矿(主要成分为 ,含有少量
,含有少量 、
、 、
、 等杂质)制备
等杂质)制备 和
和 ,工艺流程如图所示。
,工艺流程如图所示。
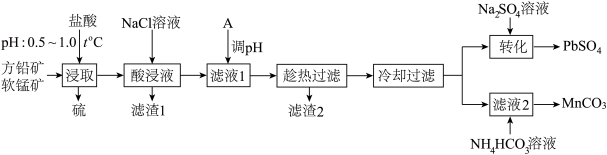
已知:① 难溶于冷水,不溶于乙醇,易溶于热水;
难溶于冷水,不溶于乙醇,易溶于热水;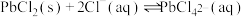
 ;
;
②部分金属离子开始沉淀和沉淀完全的pH如下表:
③25℃时,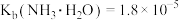 ,
,
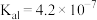 ,
, ;
;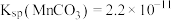 。
。
回答下列问题:
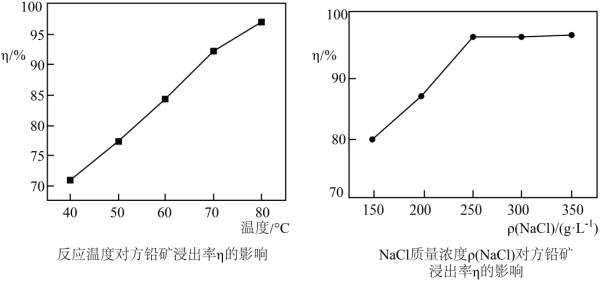
(1)为提高方铅矿的浸出率,结合下图信息,选择“浸取”的合适条件_______ 。“浸取”过程中发生的主要反应的化学方程式为_______ ,“酸浸液”中含有的金属阳离子有 、
、_______ 。
(2)加入NaCl溶液的目的是_______ ;“调pH”前检验滤液1中是否含 所用的试剂是
所用的试剂是_______ ,物质A调节pH的范围是_______ 。
(3)“滤液2”中加入的 溶液显
溶液显_______ (填“酸性”、“碱性”或“中性”),发生反应的离子方程式为_______ 。
 ,含有少量
,含有少量 、
、 、
、 等杂质)制备
等杂质)制备 和
和 ,工艺流程如图所示。
,工艺流程如图所示。
已知:①
 难溶于冷水,不溶于乙醇,易溶于热水;
难溶于冷水,不溶于乙醇,易溶于热水;
 ;
;②部分金属离子开始沉淀和沉淀完全的pH如下表:
| 金属离子 |  |  |  |  |  |
| 开始沉淀的pH | 7.0 | 1.7 | 3.7 | 7.6 | 7.0 |
| 沉淀完全的pH | 9.6 | 3.2 | 4.7 | 9.8 | 9.0 |
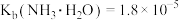 ,
,
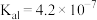 ,
, ;
;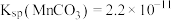 。
。回答下列问题:
(1)为提高方铅矿的浸出率,结合下图信息,选择“浸取”的合适条件
 、
、
(2)加入NaCl溶液的目的是
 所用的试剂是
所用的试剂是(3)“滤液2”中加入的
 溶液显
溶液显
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】I.完成下列问题
(1)25℃时,1 mol/L的 NH4Cl、 CH3COONH4、NH4HSO4溶液中,测得它们的 c( ) 分别为a、b、c,则a、b、c由大到小的顺序是
) 分别为a、b、c,则a、b、c由大到小的顺序是___________ 。
(2)物质的量浓度相同的下列溶液: ①氢氧化钾 ②氯化铵 ③氯化钠 ④硫酸氢钠 ⑤碳酸氢钠 ⑥氢氧化钡 ⑦醋酸钠,按pH由小到大的顺序排列的是________
Ⅱ.常温下,部分酸的电离常数如表所示。
(3)写出HCN在水溶液中的电离方程式___________ 。
(4)中和等量的NaOH,消耗等pH的HF和HCN的体积分别为aL、bL,则a___________ b(填“大于”“小于”或“等于”)。
(5)若CH3COOH的起始浓度为2mol•L-1,平衡时c(H+)约为___________ mol•L-1,使此溶液中CH3COOH的电离程度增大且c(H+)也增大的方法是___________ 。
(6)向NaCN溶液中通入少量CO2,发生反应的离子方程式为___________ 。
(1)25℃时,1 mol/L的 NH4Cl、 CH3COONH4、NH4HSO4溶液中,测得它们的 c(
 ) 分别为a、b、c,则a、b、c由大到小的顺序是
) 分别为a、b、c,则a、b、c由大到小的顺序是(2)物质的量浓度相同的下列溶液: ①氢氧化钾 ②氯化铵 ③氯化钠 ④硫酸氢钠 ⑤碳酸氢钠 ⑥氢氧化钡 ⑦醋酸钠,按pH由小到大的顺序排列的是________
| A.②④⑤③①⑦⑥ | B.④②⑤③①⑥⑦ |
| C.④②③⑦⑤①⑥ | D.⑥⑦①③⑤④② |
Ⅱ.常温下,部分酸的电离常数如表所示。
| 化学式 | HF | HCN | H2CO3 | CH3COOH |
| 电离常数 | Ka=3.5×10-4 | Ka=3.6×10-10 | Ka1=4.3×10-7,Ka2=5.6×10-11 | Ka=1.8×10-5 |
(3)写出HCN在水溶液中的电离方程式
(4)中和等量的NaOH,消耗等pH的HF和HCN的体积分别为aL、bL,则a
(5)若CH3COOH的起始浓度为2mol•L-1,平衡时c(H+)约为
(6)向NaCN溶液中通入少量CO2,发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】为了探究 的溶度积常数
的溶度积常数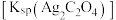 的测定,某兴趣小组设计如下步骤。
的测定,某兴趣小组设计如下步骤。

(1)步骤Ⅰ中需要配制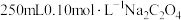 溶液、
溶液、 溶液、
溶液、 标准溶液。
标准溶液。
①配制 溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为
溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为_______ 。
②用 固体配制该溶液时,需要用电子天平称量
固体配制该溶液时,需要用电子天平称量_______ 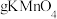 固体(该电子天平称量时可读数到
固体(该电子天平称量时可读数到 )。
)。
(2)用碱性滴定管量取 溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的
溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的 溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化
溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化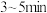 ,用过滤器过滤,滤液用干燥洁净的烧杯盛接。
,用过滤器过滤,滤液用干燥洁净的烧杯盛接。
①量取 溶液时选用碱式滴定管的主要原因为
溶液时选用碱式滴定管的主要原因为_______ (用离子方程式表示)。
②为方便数据处理,“一定体积”最好是_______  。
。
(3)准确量取 所得滤液注入锥形瓶中,加入足量的
所得滤液注入锥形瓶中,加入足量的 的硫酸,用所配
的硫酸,用所配 标准溶液滴定,实验三次,消耗
标准溶液滴定,实验三次,消耗 标准溶液的平均值为
标准溶液的平均值为 (已知:
(已知: )。
)。
①滴定终点现象为_______ 。
②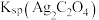 的溶度积测定值为
的溶度积测定值为_______ (用含b的计算式表示)。
③若步骤Ⅱ中烧杯盛接的滤液浑浊,会使测量值___ (填“偏高”“偏低”或“无影响”,下同);若锥形瓶有少量水存在,会使测量值__ 。
 的溶度积常数
的溶度积常数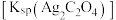 的测定,某兴趣小组设计如下步骤。
的测定,某兴趣小组设计如下步骤。
(1)步骤Ⅰ中需要配制
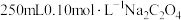 溶液、
溶液、 溶液、
溶液、 标准溶液。
标准溶液。①配制
 溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为
溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为②用
 固体配制该溶液时,需要用电子天平称量
固体配制该溶液时,需要用电子天平称量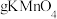 固体(该电子天平称量时可读数到
固体(该电子天平称量时可读数到 )。
)。(2)用碱性滴定管量取
 溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的
溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的 溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化
溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化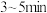 ,用过滤器过滤,滤液用干燥洁净的烧杯盛接。
,用过滤器过滤,滤液用干燥洁净的烧杯盛接。①量取
 溶液时选用碱式滴定管的主要原因为
溶液时选用碱式滴定管的主要原因为②为方便数据处理,“一定体积”最好是
 。
。(3)准确量取
 所得滤液注入锥形瓶中,加入足量的
所得滤液注入锥形瓶中,加入足量的 的硫酸,用所配
的硫酸,用所配 标准溶液滴定,实验三次,消耗
标准溶液滴定,实验三次,消耗 标准溶液的平均值为
标准溶液的平均值为 (已知:
(已知: )。
)。①滴定终点现象为
②
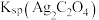 的溶度积测定值为
的溶度积测定值为③若步骤Ⅱ中烧杯盛接的滤液浑浊,会使测量值
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】水中溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化,滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2 S2O +I2=2I−+ S4O
+I2=2I−+ S4O )。
)。
回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为_______ 。
(2)Na2S2O3溶液不稳定,使用前需标定。蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除_______ 及二氧化碳。
(3)取100.00 mL水样经固氧、酸化后,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为_______ ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_______ mg·L−1。
(4)上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏_______ 。(填“高”或“低”)
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化,滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2 S2O
 +I2=2I−+ S4O
+I2=2I−+ S4O )。
)。回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为
(2)Na2S2O3溶液不稳定,使用前需标定。蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除
(3)取100.00 mL水样经固氧、酸化后,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为
(4)上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
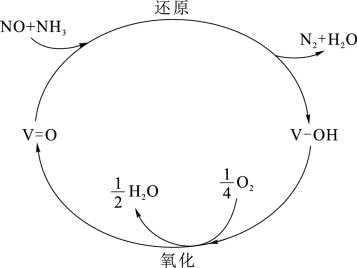
(1)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓 反应制备并收集
反应制备并收集 ,应选择的装置是
,应选择的装置是___________ (填字母)。___________ 。___________ ,脱硝(NO)反应的离子方程式为___________ 。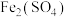 溶液吸收含
溶液吸收含 的尾气(其余气体均与溶液不反应),实验装置如图所示,装置A中发生反应的离子方程式为
的尾气(其余气体均与溶液不反应),实验装置如图所示,装置A中发生反应的离子方程式为___________ 。 全部被装置A吸收。反应后将装置A中溶液全部转移至烧杯中,向其中逐滴加入0.1000
全部被装置A吸收。反应后将装置A中溶液全部转移至烧杯中,向其中逐滴加入0.1000
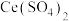 溶液,发生反应
溶液,发生反应
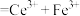 ,当反应恰好完全时,共消耗
,当反应恰好完全时,共消耗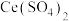 溶液18.00mL。请通过计算确定尾气中
溶液18.00mL。请通过计算确定尾气中 的体积分数为
的体积分数为___________ 。
(1)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓
 反应制备并收集
反应制备并收集 ,应选择的装置是
,应选择的装置是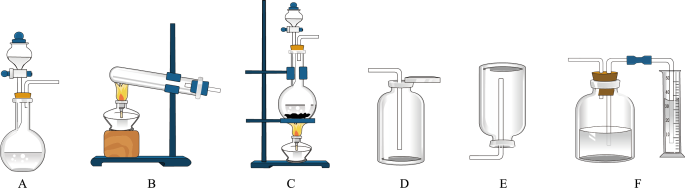
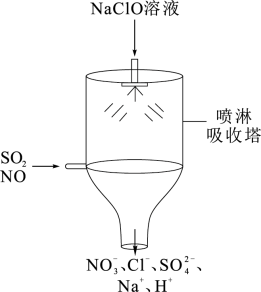
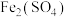 溶液吸收含
溶液吸收含 的尾气(其余气体均与溶液不反应),实验装置如图所示,装置A中发生反应的离子方程式为
的尾气(其余气体均与溶液不反应),实验装置如图所示,装置A中发生反应的离子方程式为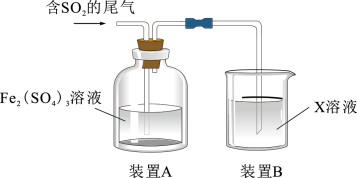
 全部被装置A吸收。反应后将装置A中溶液全部转移至烧杯中,向其中逐滴加入0.1000
全部被装置A吸收。反应后将装置A中溶液全部转移至烧杯中,向其中逐滴加入0.1000
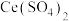 溶液,发生反应
溶液,发生反应
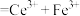 ,当反应恰好完全时,共消耗
,当反应恰好完全时,共消耗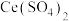 溶液18.00mL。请通过计算确定尾气中
溶液18.00mL。请通过计算确定尾气中 的体积分数为
的体积分数为
您最近一年使用:0次



