名校
解题方法
1 . 常温下,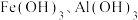 和
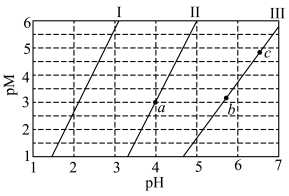
和 在水中达到沉淀溶解平衡时的关系如图所示{
在水中达到沉淀溶解平衡时的关系如图所示{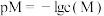 ,M代表
,M代表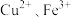 或
或 ;
; 时可认为M沉淀完全,
时可认为M沉淀完全,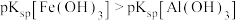 }。下列叙述正确的是
}。下列叙述正确的是
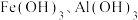 和
和 在水中达到沉淀溶解平衡时的关系如图所示{
在水中达到沉淀溶解平衡时的关系如图所示{ ,M代表
,M代表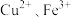 或
或 ;
; 时可认为M沉淀完全,
时可认为M沉淀完全,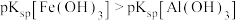 }。下列叙述正确的是
}。下列叙述正确的是
A.I代表的是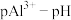 的关系 的关系 |
B.由a点可求得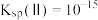 |
C.b、c两点对应物质的 和溶解度均相同 和溶解度均相同 |
D.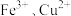 的混合溶液中, 的混合溶液中,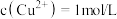 时不能同时沉淀 时不能同时沉淀 |
您最近一年使用:0次
名校
2 . AlPO4的沉淀溶解平衡曲线如图所示(已知AlPO4溶解为吸热过程)。下列说法不正确的是
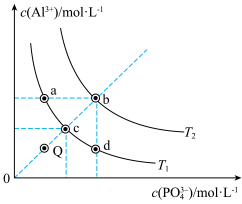

| A.T1>T2 | B.AlPO4在b点对应的溶解度大于c点 |
| C.T1下Q点溶液无AlPO4固体析出 | D.图中Ksp:a=c=d<b |
您最近一年使用:0次
2023-11-20更新
|
861次组卷
|
3卷引用:四川省成都市第七中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
3 . 三氯氧磷(POCl3)可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化 PCl3 制备 POCl3,反应原理为:P4(白磷)+6Cl2 4PCl3,2PCl3+O2
4PCl3,2PCl3+O2 2POCl3。
2POCl3。
已知:PCl3、POCl3的部分性质如下:
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置和加热装置已略去):
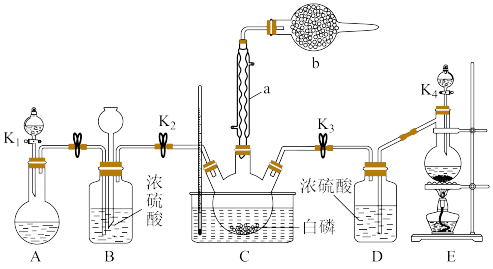
(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为___________ ,B装置的作用是___________ 。
(2)装置 E 反应的离子方程式为___________ 。
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是___________ 。分离提纯获得 POCl3 的实验方法是___________ 。
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:___________ 。实验过程中加入硝基苯覆盖沉淀的目的是___________ ,若无此操作,则所测POCl3的含量将___________ (填“偏高”“偏低”或“不变”)。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12]
(5)产品中POCl3的质量分数为___________ 。
 4PCl3,2PCl3+O2
4PCl3,2PCl3+O2 2POCl3。
2POCl3。已知:PCl3、POCl3的部分性质如下:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 |
| PCl3 | -112 | 75.5 | 137.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 153.5 | 遇水生成H3PO4和HCl |

(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为
(2)装置 E 反应的离子方程式为
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:
(5)产品中POCl3的质量分数为
您最近一年使用:0次
解题方法
4 . 硝酸铜晶体[Cu(NO3)2•6H2O],是一种重要的化工原料,常用于农药、镀铜、搪瓷等工业。以辉铜矿(主要成分为Cu2S,含少量Fe2O3,、SiO2等杂质)为原料制备硝酸铜晶体的某工艺如图所示:

回答下列问题:
(1)“浸取”时,为了提高浸取率可采取的措施有____ (任写一点),浸取时在生成S的反应中还原剂与氧化剂的物质的量之比为____ 。
(2)滤渣2的主要成分是____ ,滤渣2与稀硝酸反应时,需向装置内通入适量空气,这样做的目的是____ 。
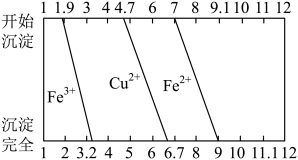
(3)调节溶液pH时选用的物质a可以是_____ ,几种金属离子沉淀的pH范围如图所示,“调pH”时应将溶液pH调至____ 。
(4)操作X主要包括____ 、____ 、过滤、洗涤、干燥。
(5)用碱性锌锰干电池为电源电解硝酸铜溶液可制得铜单质。请写出电解过程中阳极的电极反应式____ 。

回答下列问题:
(1)“浸取”时,为了提高浸取率可采取的措施有
(2)滤渣2的主要成分是
(3)调节溶液pH时选用的物质a可以是

(4)操作X主要包括
(5)用碱性锌锰干电池为电源电解硝酸铜溶液可制得铜单质。请写出电解过程中阳极的电极反应式
您最近一年使用:0次
名校
5 . 下列说法中,正确的是
| A.25 ℃时,在含有大量PbI2的饱和溶液中加入KI溶液,溶液中Pb2+浓度增大 |
| B.常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好 |
| C.两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| D.同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小 |
您最近一年使用:0次
2021-09-09更新
|
776次组卷
|
4卷引用:四川省江油中学2020-2021学年高二下学期4月月考化学试题
四川省江油中学2020-2021学年高二下学期4月月考化学试题(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)湖北省鄂州市2021-2022学年高二上学期期末质量监测化学试题
名校
解题方法
6 . 常温下,下列有关电解质溶液的说法错误的是
| A.在1mol•L-1Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1mol•L-1 |
| B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Ka(HCOOH)>Ka(HF) |
| D.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS) |
您最近一年使用:0次
名校
7 . 常温下,金属离子(Mn+)浓度的负对数pM [ pM=-lgc(Mn+) ] 随溶液pH变化关系如图所示。当c(Mn+)≤10-6 mol/L时认为该金属离子已沉淀完全,下列叙述正确的是
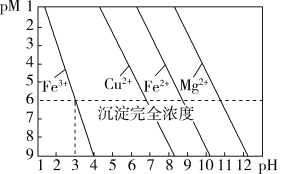

| A.常温下,Mg(OH)2的溶解度比Cu(OH)2的溶解度小 |
| B.可以通过调节溶液pH的方法分步沉淀Mg2+和Fe2+ |
| C.除去含Cu2+溶液中的少量Fe2+,可加入适量H2O2后控制溶液3≤pH<4 |
| D.pM与Ksp之间的关系式为pM=lgKsp+n(14-pH) |
您最近一年使用:0次
2021-07-14更新
|
395次组卷
|
2卷引用:四川省绵阳市2020-2021学年高二下学期期末考试化学试题
8 .  溶液中常含有少量的
溶液中常含有少量的 ,可通过添加过量的难溶电解质MnS使得
,可通过添加过量的难溶电解质MnS使得 形成沉淀而除去
形成沉淀而除去 室温时
室温时 。下列说法说法不正确的是
。下列说法说法不正确的是
 溶液中常含有少量的
溶液中常含有少量的 ,可通过添加过量的难溶电解质MnS使得
,可通过添加过量的难溶电解质MnS使得 形成沉淀而除去
形成沉淀而除去 室温时
室温时 。下列说法说法不正确的是
。下列说法说法不正确的是A.溶解度: |
B. |
C.室温时MnS的溶解度为 |
D.溶液中发生的反应是: |
您最近一年使用:0次
9 . 根据下列实验操作和现象所得结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测溶液中含有Fe2+ |
| B | 向浓度均为0.1mo/L的NaHCO3溶液和NaHSO3溶液中滴加几滴酚酞试剂 | 前者溶液变红,后者不变色 | NaHCO3水解,而NaHSO3不水解 |
| C | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一支试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| D | 甲烷与氯气在光照下反应 | 产生混合气体能使湿润的石蕊试纸变红 | 生成的氯甲烷具有酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 由下列实验及现象能推出相应结论的是
| 实验 | 现象 | 结论 | |
| A | 将BaSO4固体放入饱和Na2CO3溶液中,过滤之后向沉淀中滴加滴稀盐酸 | 有气体产生 | 溶解度: BaSO4>BaCO3 |
| B | 将Zn与Fe用导线相连后插入酸化的食盐水中,一段时间后,取出电极,向溶液中滴加K3[Fe(CN)6]溶液 | 无明显现象 | 这是牺牲阳极的阴极保护法,Fe未被腐蚀 |
| C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向2支盛有2mL银氨溶液的试管中分别加入2滴NaCl和NaI溶液 | 一支试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



