名校
解题方法
1 . 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
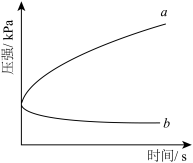

| A.两容器中负极反应均为Fe-2e-═Fe2+ |
| B.曲线a记录的是pH=2的盐酸中压强的变化 |
| C.曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH- |
| D.在弱酸性溶液中,生铁能发生吸氧腐蚀 |
您最近一年使用:0次
2018-01-10更新
|
1117次组卷
|
9卷引用:第14练 金属腐蚀和防护-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)
(已下线)第14练 金属腐蚀和防护-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)北京市第四中学2022-2023学年高三上学期期中考试化学试题湖北省宜昌市第一中学2018届高三年级适应性训练(二)理综化学试题河北省定州中学2018届高三上学期高中毕业班期末考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第三节 金属的腐蚀与防护江西省南昌市第二中学2020-2021学年高二上学期期末考试化学试题选择性必修1专题1第三单元 金属的腐蚀与防护1.3金属的腐蚀和防护 课后
2 . 羰基硫是一种粮食熏蒸剂,能防治某些害虫和真菌的危害,利用CO等制备羰基硫原理:CO+H2S⇌COS+H2。
(1)用FeOOH作催化剂,CO(g)+H2S(g)⇌COS(g)+H2(g)的反应分两步进行,其反应过程能量变化如图1所示。
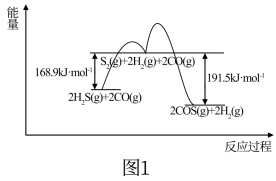
①CO(g)+H2S(g)⇌COS(g)+H2(g) △H=___________ 。
②决定COS生成速率的主要步骤是___________ (填“第1步”或“第2步”)。
(2)在2L的密闭容器中,保持温度不变,开始投入9molH2S和amolCO,经10min达到平衡,Kp=0.2(Kp为以分压表示的平衡常数),n(H2S)=5mol,则CO的平衡转化率α=___________ 。
(3)在2L的密闭容器中,开始时投入amolCO和1molH2S,图2中曲线I和II表示某温度下,CO和H2S投料比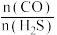 不同时,CO转化率随时间变化关系,则曲线I和II中a值的大小关系为:I
不同时,CO转化率随时间变化关系,则曲线I和II中a值的大小关系为:I___________ II(填“>”“<”或“=”),理由是___________ 。
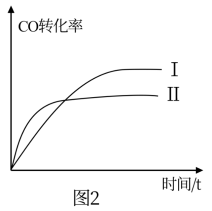
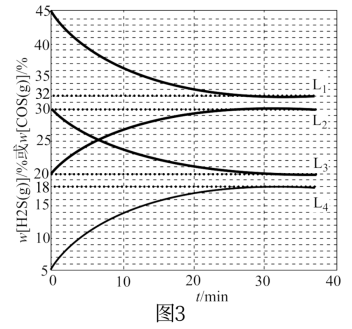
(4)已知起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等,在240℃时该反应平衡常数K=1,在300℃、340℃时反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图3所示。则300℃时,ω[COS(g)]随时间变化的曲线为___________ ,340℃时,ω[H2S(g)]随时间变化的曲线为___________ 。
(5)羰基硫在水存在时会缓慢水解生成H2S,会使钢铁设备发生析氢腐蚀,则其正极的电极反应式为___________ ,负极的反应产物为___________ (填化学式)。
(1)用FeOOH作催化剂,CO(g)+H2S(g)⇌COS(g)+H2(g)的反应分两步进行,其反应过程能量变化如图1所示。

①CO(g)+H2S(g)⇌COS(g)+H2(g) △H=
②决定COS生成速率的主要步骤是
(2)在2L的密闭容器中,保持温度不变,开始投入9molH2S和amolCO,经10min达到平衡,Kp=0.2(Kp为以分压表示的平衡常数),n(H2S)=5mol,则CO的平衡转化率α=
(3)在2L的密闭容器中,开始时投入amolCO和1molH2S,图2中曲线I和II表示某温度下,CO和H2S投料比
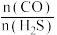 不同时,CO转化率随时间变化关系,则曲线I和II中a值的大小关系为:I
不同时,CO转化率随时间变化关系,则曲线I和II中a值的大小关系为:I
(4)已知起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等,在240℃时该反应平衡常数K=1,在300℃、340℃时反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图3所示。则300℃时,ω[COS(g)]随时间变化的曲线为

(5)羰基硫在水存在时会缓慢水解生成H2S,会使钢铁设备发生析氢腐蚀,则其正极的电极反应式为
您最近一年使用:0次
3 . 某学习小组探究 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
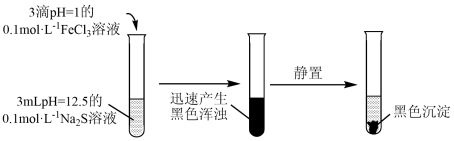
已知:FeS、 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。
(1) 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是___________ (用化学用语回答)。
(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是
①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式___________ 。经检验后确认黑色沉淀中无S单质,猜想1不成立。
②乙同学根据 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。
向 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。
该实验现象能确定的结论是___________ ;不能确定的是___________ 。
(3)丙同学利用电化学原理继续进行探究并设计实验:
丙同学依据实验得出结论:pH=1的0.1mol/L  溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液___________ (填“能”或“不能”)发生氧化还原反应。
(4)综合以上研究,分析试管b中黑色沉淀是 而不是FeS的原因
而不是FeS的原因___________ 。
 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
已知:FeS、
 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。(1)
 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是

①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式
②乙同学根据
 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。向
 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。该实验现象能确定的结论是
(3)丙同学利用电化学原理继续进行探究并设计实验:
| 装置 | 操作及现象 |
 | ①电流计指针有微弱偏转 ②2分钟后,取左侧烧杯溶液,滴加  溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加 溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加 溶液,有大量蓝色沉淀。 溶液,有大量蓝色沉淀。 |
 溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液(4)综合以上研究,分析试管b中黑色沉淀是
 而不是FeS的原因
而不是FeS的原因
您最近一年使用:0次
名校
4 . 下列图示内容的对应说明正确的是
| 编号 | A | B | C | D |
| 图示 | 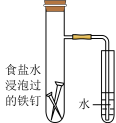 食盐水 |  片刻后在Fe 电极附近滴入K3[Fe(CN)6]溶液 | 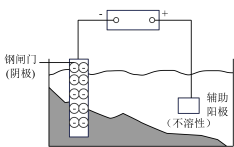 |  |
| 说明 | 验证铁钉发生 吸氧腐蚀 | 验证 Fe 电极被保护 | 该装置是牺牲阳极的阴极保护法 | 该化学反应为放热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-04更新
|
430次组卷
|
4卷引用:专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)北京市八一学校2019-2020学年高二下学期期末考试化学试题模拟卷03(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)
名校
5 . 下列关于金属防护的说法中正确的是
| A.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| B.地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀 |
| C.在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 |
| D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
您最近一年使用:0次
2019-02-04更新
|
590次组卷
|
3卷引用:内蒙古赤峰二中2021-2022学年高二上学期期末考试化学试题
名校
解题方法
6 . 有关下列说法中,正确的是
| A.用标准盐酸滴定未知浓度的NaOH溶液,滴定前酸式滴定管尖嘴有气泡未排出,滴定后气泡消失,会造成测定结果偏低 |
| B.工业废水中的Cu2+、Hg2+等重金属阳离子可以通过加入FeS除去 |
| C.工业上常在铁板表面镀上一层锡(俗称马口铁)来防止铁板表面破损后发生电化学腐蚀 |
| D.等体积的pH均为2的酸HA和HB的溶液分别与足量的铁粉反应,HA放出的H2多,说明HA酸性强 |
您最近一年使用:0次
2020-01-24更新
|
390次组卷
|
4卷引用:山东省淄博市高青县第一中学2021-2022学年高二下学期开学收心考试化学试题
山东省淄博市高青县第一中学2021-2022学年高二下学期开学收心考试化学试题山东省济宁市2019-2020学年高二上学期期末考试化学试题湖北省恩施土家族苗族自治州高级中学2019-2020学年高二下学期第二次双周考试化学试题(已下线)练习10 金属的腐蚀与防护-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)
名校
7 . 下图所示各烧杯中均盛有海水,铁在其中被腐蚀最快和被保护最好的分别为( )
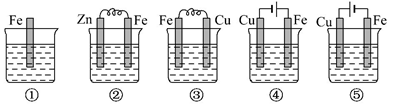

| A.①⑤ | B.③② | C.④⑤ | D.④① |
您最近一年使用:0次
2018-12-24更新
|
638次组卷
|
4卷引用:安徽省宿州市十三所重点中学2022-2023学年高二上学期期中质量检测化学试题
2019高三下·江苏·专题练习
名校
8 . 下列说法正确的是
| A.SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| B.向0.1 mol·L−1 CH3COONa溶液中加入少量水,溶液中c(H+)/c(CH3COO−)减小 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀采用了牺牲阳极的阴极保护法 |
| D.反应2CO(g)=2C(s) + O2(g) ΔH>0可以自发进行 |
您最近一年使用:0次
名校
解题方法
9 . 如图所示,将铁棒和石墨棒插入l L l mol·L-1食盐水中。下列说法正确的是
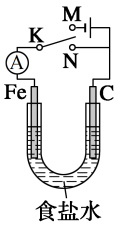

| A.若电键K与N连接,铁会发生还原反应而被腐蚀 |
| B.若电键K与N连接,负极反应式是:4OH-_4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,可实现铜棒上镀铁 |
| D.若电键K与M连接,当两极共产生5.6 L(标准状况)气体时,生成了0.25 mol NaOH |
您最近一年使用:0次
2022-12-02更新
|
170次组卷
|
3卷引用:湖南省邵阳邵东市第四中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
10 . 在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
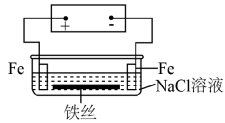

| A.原理图可理解为两个串联电解装置 |
| B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 |
| C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+ |
| D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
您最近一年使用:0次
2016-12-09更新
|
880次组卷
|
8卷引用:河南省南阳市2022-2023学年高二上学期10月期中考试化学试题



