1 . 某蓄电池反应为NiO2+Fe+2H2O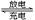 Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是_______ (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是_____________ 。
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的______ 极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用下图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示__________________________________ 。

(4)精炼铜时,粗铜应与直流电源的________ 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:

已知各离子沉淀时的情况如下表:
则加入H2O2的目的是__________________________________________________ ,
发生反应的离子方程式为_________ 。乙同学认为应将方案中的pH调节到8,你认为此观点______ (填“正确”或“不正确”),理由是______________________________ 。
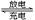 Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2(1)该蓄电池充电时,发生还原反应的物质是
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(3)以该蓄电池做电源,用下图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示

(4)精炼铜时,粗铜应与直流电源的

已知各离子沉淀时的情况如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
发生反应的离子方程式为
您最近半年使用:0次
2 . 全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。研究钢铁的腐蚀及防护有重要意义。回答下列问题:
(1)钢铁发生腐蚀的主要类型是电化学腐蚀,在电化学腐蚀中,负极反应是_____________ ,正极反应是_____________ 。
(2)某实验小组设计下列实验探究铁生锈的条件:
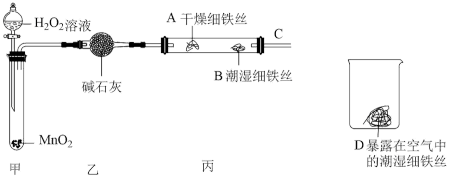
反应4min后观察,发现A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮。该实验说明铁生锈主要与_________ 和___________ 有关;B、D处实验现象对比说明:决定铁生锈的一个重要因素是___________ 。
(3)金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能。常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成。
①重铬酸中,Cr元素的化合价为________ 。
②镀铬时由CrO 放电产生铬镀层。阴极的电极反应式为
放电产生铬镀层。阴极的电极反应式为_______ 。
(4)电镀废水中Cr2O 具有高毒性,必须经处理后才能排放。电解法处理含铬的强酸性废水的原理如右图所示。
具有高毒性,必须经处理后才能排放。电解法处理含铬的强酸性废水的原理如右图所示。
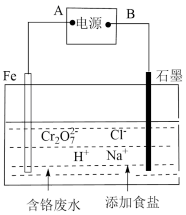
电解产生的Fe2+将Cr2O 还原为Cr3+,再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成。
还原为Cr3+,再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成。
图中A为电源__________ 极;电解时阴极产生的气体为____________ (写化学式)。
②写出Fe2+与Cr2O 反应的离子方程式:
反应的离子方程式:_________________ 。
(1)钢铁发生腐蚀的主要类型是电化学腐蚀,在电化学腐蚀中,负极反应是
(2)某实验小组设计下列实验探究铁生锈的条件:

反应4min后观察,发现A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮。该实验说明铁生锈主要与
(3)金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能。常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成。
①重铬酸中,Cr元素的化合价为
②镀铬时由CrO
 放电产生铬镀层。阴极的电极反应式为
放电产生铬镀层。阴极的电极反应式为(4)电镀废水中Cr2O
 具有高毒性,必须经处理后才能排放。电解法处理含铬的强酸性废水的原理如右图所示。
具有高毒性,必须经处理后才能排放。电解法处理含铬的强酸性废水的原理如右图所示。
电解产生的Fe2+将Cr2O
 还原为Cr3+,再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成。
还原为Cr3+,再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成。图中A为电源
②写出Fe2+与Cr2O
 反应的离子方程式:
反应的离子方程式:
您最近半年使用:0次
解题方法
3 . 人类的生产生活离不开金属材料,金属及金属材料在生产、生活中应用广泛。
(1)生活中常用的铁锅炒菜,主要是利用了铁的_______ ;铁在潮湿的空气中容易锈蚀,喷漆可以延缓汽车钢铁外壳的锈蚀,起防锈原理是隔绝___________ ,喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3),观察到溶液变黄,有无色气泡逸出,写出其中涉及到的一个化学方程式:___________________ 。
(2)化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程:
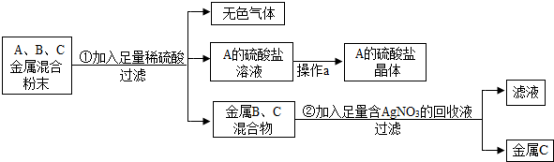
①A、B、C三种金属的活动性顺序为___________________ 。
②金属C是____________ ,已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式:________________________________________ 。
(1)生活中常用的铁锅炒菜,主要是利用了铁的
(2)化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程:

①A、B、C三种金属的活动性顺序为
②金属C是
您最近半年使用:0次
4 . 高炉炼铁过程中发生的主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
(1)写出该反应的平衡常数表达式:K=_____________________________ 。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=_______ ;平衡时,c(CO)=_______________ 。
(3)欲提高(2)中CO的反应速率,可采取的措施是_____________。
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是______________ 。
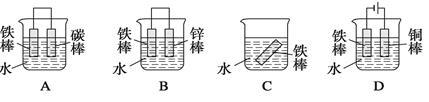
(5)铁是国家的工业基础,下列哪些装置可防止铁棒被腐蚀 ________ 。
 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.653 | 42.875 |
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=
(3)欲提高(2)中CO的反应速率,可采取的措施是_____________。
| A.减少Fe的量 |
| B.增加Fe2O3的量 |
| C.移出部分CO2 |
| D.提高反应温度 |
| E.减小容器的体积 |
| F.加入合适的催化剂 |
| n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
| n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
| n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
| n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |

您最近半年使用:0次
5 . K, Fe, C, N, O, S是中学化学常见的六种元素。
(1)K位于元素周期表的第____ 周期第_____ 族;N的基态原子核外有_____ 个未成对电子。基态Fe2+的核外电子排布式是_____
(2)用“>”或“<”填空:
(3)在250C、l01kPa下,已知CO与NO在一定条件下反应生成N2和CO2,恢复至原状态,平均每转移lmol电子放热153.9kJ,该反应的热化学方程式是_____
(4)钢铁在有电解质溶液存在的条件下易发生电化学腐蚀。某同学利用钢铁的电化学腐蚀原理,设计如图甲所示实验:
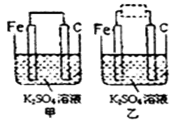
①写出石墨电极的电极反应式:_____
②将该装置作简单修改即可成为铁的电化学防护装置,请在图乙中的虚线框内所示位置作出修改。_______
(1)K位于元素周期表的第
(2)用“>”或“<”填空:
| 第一电离能 | 键的极性 | 熔点 | 稳定性 |
| N | H—S 键 | 金刚石 | CH4 |
(3)在250C、l01kPa下,已知CO与NO在一定条件下反应生成N2和CO2,恢复至原状态,平均每转移lmol电子放热153.9kJ,该反应的热化学方程式是
(4)钢铁在有电解质溶液存在的条件下易发生电化学腐蚀。某同学利用钢铁的电化学腐蚀原理,设计如图甲所示实验:

①写出石墨电极的电极反应式:
②将该装置作简单修改即可成为铁的电化学防护装置,请在图乙中的虚线框内所示位置作出修改。
您最近半年使用:0次
6 . 铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为_______ 。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是____________ (用序号填写)。
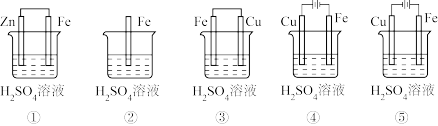
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s) H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s) H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为______________ 。
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式______ 。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是______________ 。
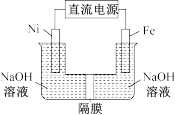
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是____________ 。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为____ 。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]=______ 。
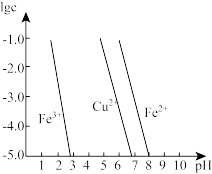
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度 10-5mol·L-1时,可认为沉淀完全)。
10-5mol·L-1时,可认为沉淀完全)。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为
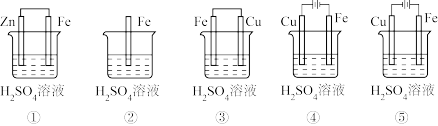
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)
 H=-1118 kJ·mol-1
H=-1118 kJ·mol-1②2Al(s)+3/2O2(g)=A12O3(s)
 H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式

(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是

已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度
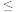 10-5mol·L-1时,可认为沉淀完全)。
10-5mol·L-1时,可认为沉淀完全)。
您最近半年使用:0次
2016-12-09更新
|
818次组卷
|
3卷引用:2015届山东省枣庄市六中高三下学期开学初检测试题理综化学试卷
12-13高三上·北京西城·期末
7 . 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)⇌ 2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a =_____ kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K =_____ ,温度升高后,K值____ (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
① 甲容器中CO的平衡转化率为_____ 。
② 下列说法正确的是_____ (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是_____ (填字母)。
②若用d装置保护铁,X极的电极材料应是_____ (填名称)。

Fe2O3(s)+3CO(g)⇌ 2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a =
(2)冶炼铁反应的平衡常数表达式K =
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2[ | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为
② 下列说法正确的是
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是
②若用d装置保护铁,X极的电极材料应是

您最近半年使用:0次
2016-12-09更新
|
1474次组卷
|
5卷引用:2012届北京市西城区高三上学期期末考试化学试卷
(已下线)2012届北京市西城区高三上学期期末考试化学试卷(已下线)2014届甘肃省武威市第六中学高三上学期第五次月考化学试卷2015-2016学年山西省重点中学协作体高二下学期第一次联考化学试卷2015-2016学年湖南省娄底市重点中学高二下学期期末化学试卷2017届宁夏石嘴山三中高三上期中化学试卷
8 . 对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,除去铁锈的化学反应的离子方程式为:________________________ 。
(2)利用右图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________ 处。
②若X为锌,开关K置于M处,该电化学防护法称为____________ 。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时, 转移的电子数为______ NA。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:___________________ 。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,除去铁锈的化学反应的离子方程式为:
(2)利用右图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于
②若X为锌,开关K置于M处,该电化学防护法称为
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时, 转移的电子数为
您最近半年使用:0次
9 . 工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3作冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
(1)赤泥中的主要成分是______ (化学式);向滤液中通入过量CO2所发生反应的离子方程式为_________ 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为____________ 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______ 。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________ 。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________ 。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________ 。
(已知:NaCl熔点为801℃;AlCl3在181℃升华)

(1)赤泥中的主要成分是
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是
您最近半年使用:0次
10 . Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒.
(1)电解NaCl溶液生成Cl2的化学方程式是____________ 。
(2)Cl 2溶于H2O、NaOH溶液即获得氯水、漂白液.
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是____________ 。
②25℃,Cl 2与H2O、NaOH的反应如下:
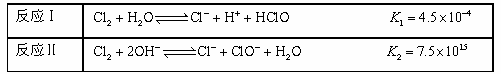
不直接使用氯水而使用漂白液做消毒剂的原因是____________ 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO-发生的电极反应式是____________ 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下:
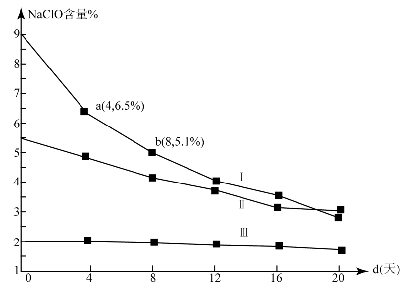
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是___________ ,原因是____________ 。
②NaClO分解的化学方程式是____________ 。
③4d~8d,I中v(NaClO)=_______ mol/(L·d)(常温下漂白液的密度约为1g / cm3,且变化忽略不计)
(1)电解NaCl溶液生成Cl2的化学方程式是
(2)Cl 2溶于H2O、NaOH溶液即获得氯水、漂白液.
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是
②25℃,Cl 2与H2O、NaOH的反应如下:
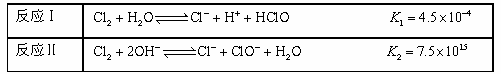
不直接使用氯水而使用漂白液做消毒剂的原因是
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO-发生的电极反应式是
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下:

①分解速v(Ⅰ)、v(Ⅱ)的大小关系是
②NaClO分解的化学方程式是
③4d~8d,I中v(NaClO)=
您最近半年使用:0次



