名校
解题方法
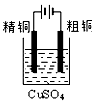
1 . (1)依据反应: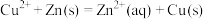 设计的原电池如图所示。
设计的原电池如图所示。
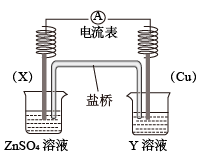
①电极X的材料是________ ;Y溶液可以是________ 溶液。
②电池放电过程中,盛有饱和 琼脂溶胶的盐桥中,向
琼脂溶胶的盐桥中,向 溶液扩散的离子是
溶液扩散的离子是________ (填离子符号)。
(2)钢铁发生电化学腐蚀可分为析氢腐蚀和吸氧腐蚀,可以采用电化学手段进行防护。
①写出钢铁在酸性较强的环境中发生电化学腐蚀的正极反应式:_________ 。
②为了减缓水库铁闸门被腐蚀的速率,可以采用下图所示的方案:
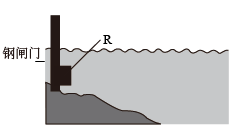
其中连接在铁闸门上的固体材料R可以采用________ (填写字母序号)。
a.铜 b.钠 c.锌 d.石墨
(3)电解原理在工业上有着广泛的用途,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
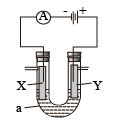
①若X、Y都是惰性电极,a是饱和 溶液,则电解的总反应式为
溶液,则电解的总反应式为________________ 。
②当电路中流通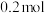 电子时,整个装置共放出气体
电子时,整个装置共放出气体________ L(标准状况下)。
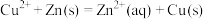 设计的原电池如图所示。
设计的原电池如图所示。
①电极X的材料是
②电池放电过程中,盛有饱和
 琼脂溶胶的盐桥中,向
琼脂溶胶的盐桥中,向 溶液扩散的离子是
溶液扩散的离子是(2)钢铁发生电化学腐蚀可分为析氢腐蚀和吸氧腐蚀,可以采用电化学手段进行防护。
①写出钢铁在酸性较强的环境中发生电化学腐蚀的正极反应式:
②为了减缓水库铁闸门被腐蚀的速率,可以采用下图所示的方案:

其中连接在铁闸门上的固体材料R可以采用
a.铜 b.钠 c.锌 d.石墨
(3)电解原理在工业上有着广泛的用途,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。

①若X、Y都是惰性电极,a是饱和
 溶液,则电解的总反应式为
溶液,则电解的总反应式为②当电路中流通
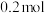 电子时,整个装置共放出气体
电子时,整个装置共放出气体
您最近一年使用:0次
2021-04-13更新
|
212次组卷
|
3卷引用:广西钦州市浦北县浦北中学2020-2021学年高二3月月考化学试题
广西钦州市浦北县浦北中学2020-2021学年高二3月月考化学试题(已下线)作业13 金属的腐蚀与防护-2021年高二化学暑假作业(人教版2019)重庆市巫山县官渡中学2020-2021年高二下学期第二次月考化学试题
2 . 铁及其化合物用途非常广泛。
(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g)  H = a kJ·mol-1
H = a kJ·mol-1
(b) Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)  H =b kJ·mol-1
H =b kJ·mol-1
(c) Fe3O4(s)+CO(g) 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g)  H = c kJ·mol-1
H = c kJ·mol-1
①上述反应(a)平衡常数表达式为K=___________________ 。
②反应FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)  H =
H =__________ kJ·mol-1(用含a、b、c的代数式表示)。
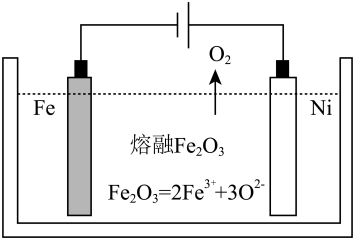
(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是__________________________________ ;电解时阳极发生的电极反应为____________ 。
(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为_________ ;如图所示,纯铁处于a、b、c三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填字母)_____________ 。

(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g)
 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g)  H = a kJ·mol-1
H = a kJ·mol-1(b) Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)  H =b kJ·mol-1
H =b kJ·mol-1(c) Fe3O4(s)+CO(g)
 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g)  H = c kJ·mol-1
H = c kJ·mol-1①上述反应(a)平衡常数表达式为K=
②反应FeO(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)  H =
H =(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是

(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为

您最近一年使用:0次
11-12高三·黑龙江大庆·期末
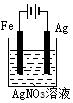
3 . 下列电化学装置及用途正确的是
A | B | C | D |
|
|
|
|
铜的精炼 | 铁上镀银 | 防止Fe被腐蚀 | 构成铜锌原电池 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-08-02更新
|
679次组卷
|
32卷引用:2012届黑龙江省大庆铁人中学高三期末考试化学试卷
(已下线)2012届黑龙江省大庆铁人中学高三期末考试化学试卷(已下线)2015届福建省八县一中高二上学期半期联考化学试卷2014-2015四川省绵阳市南山中学高二4月月考化学试卷2014-2015学年广东省深圳市明珠学校高二上学期期中化学试卷2014-2015学年河南省扶沟县高级中学高二5月月考化学试卷2015-2016学年吉林实验中学高二上学期期中考试化学试卷12015-2016学年吉林实验中学高二上学期期中考试化学试卷22015-2016学年黑龙江大庆一中高二下第二次段考化学试卷2017届山东省枣庄三中高三上10月学情调查化学试卷2016-2017学年黑龙江省鸡西市第十九中学高二上学期期末考试化学试卷吉黑两省九校2017-2018学年高二上学期期中考试化学试题内蒙古杭锦后旗奋斗中学2017级高二第一学期第二次月考化学试题山东省泰安市2017-2018学年高二上学期期末考试化学试题(已下线)2018年9月23日 《每日一题》 一轮复习-每周一测河北省唐山市玉田县2018-2019学年高二上学期期中考试化学试题【校级联考】重庆市江津中学、合川中学等七校2018-2019学年高二上学期期末考试化学试题【区级联考】山东省济南市莱芜区2019届高三第一学期期末质量检测化学试题安徽省蚌埠市第二中学2019-2020学年高二上学期期中考试化学试题福建省平和一中、南靖一中等五校2019-2020学年高二年上学期期中联考化学试题福建省漳州市第八中学2019-2020学年高二上学期期中考试化学试题安徽省淮北市第一中学2019-2020学年高二12月月考化学试题吉林省白城市通榆县第一中学2019-2020学年高二上学期第三次月考化学试题四川省绵阳市三台中学实验学校2019-2020学年高二下学期期末适应性考试化学试题四川省南充市2019-2020学年高二下学期期末考化学试题(已下线)第04章 电化学基础(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)吉林省长春汽车经济技术开发区第六中学2020-2021学年高二上学期月考化学试题陕西省黄陵中学2020-2021学年高二(本部)上学期期中考试化学试题福建省漳州市平和县第一中学2020-2021学年高二上学期期中考试化学试题宁夏银川市长庆高级中学2020-2021学年高二上学期期末考试化学试题江西省赣州市赣县第三中学2021-2022学年高二下学期5月月考化学试题陕西省延安市第一中学2021-2022学年高一下学期第二次月考化学试题山东省青岛第二中学2019-2020学年高二上学期期中考试化学试题
4 . 化学与生活密切相关,下列有关说法错误的是( )
| A.现代化建设要使用大量钢材,钢材是用途广泛的合金 |
| B.二氧化硫除具有漂白性外,还可用于杀菌、消毒 |
| C.能消杀病毒的过氧乙酸,具有强氧化性、弱酸性等性质,是强电解质 |
| D.在海轮外壳上镶入活泼金属,可减缓船体的腐蚀速率 |
您最近一年使用:0次
2020-05-25更新
|
250次组卷
|
3卷引用:天津市咸水沽第二中学2020年高三化学质量调查试题
名校
解题方法
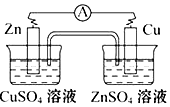
5 . 如图所示可设计成多种用途的电化学装置,下列说法错误的是


| A.a与电源正极相连时,铜做阳极 |
| B.a和b用导线连接时,SO42-向铜片移动 |
| C.a和b用导线连接时,铜片上发生的反应为:2H++2e→H2↑ |
| D.a与电源正极相连可以保护锌片 |
您最近一年使用:0次
6 . Ⅰ.高铁酸盐在能源,环保等方面有着广泛的用途。高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为_________________ ;若维持电流强度为1A,电池工作10 min,理论消耗Zn______ g(已知F=96500 C/mol,计算结果小数点后保留一位数字)。
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______ (填“左”或“右”,下同)池移动;若用阳离子交换膜代替盐桥,则钾离子向______ 移动。
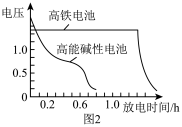
(3)图2为高铁电池和常用的高能碱性电池的放电曲线.由此可得出高铁电池的优点有______________ 。
Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力.降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(4)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为_____________ 。
(5)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:
H2+2NiOOH 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH______ (填“增大”,“减小”或“不变”),该电极的电极反应式为_______________ 。

(6)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的______ 腐蚀。利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应置于______ 处。
若X为锌,开关K置于M处,该电化学防护法称为_______ 。

(1)该电池放电时正极的电极反应式为
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
(3)图2为高铁电池和常用的高能碱性电池的放电曲线.由此可得出高铁电池的优点有

Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力.降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(4)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为
(5)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:
H2+2NiOOH
 2Ni(OH)2。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH

(6)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的

若X为碳棒,为减缓铁的腐蚀,开关K应置于
若X为锌,开关K置于M处,该电化学防护法称为
您最近一年使用:0次
名校
7 . 铁制管材在生活中有广泛的用途。下列做法不能防止铁管生锈的是
| A.保持铁管表面干燥 | B.在铁管表面镀锌 |
| C.擦去铁管表面的铁锈 | D.在铁管表面喷油漆 |
您最近一年使用:0次
2019-06-12更新
|
143次组卷
|
3卷引用:广东省江门市第二中学2018-2019学年高二5月月考(文)化学试题
广东省江门市第二中学2018-2019学年高二5月月考(文)化学试题(已下线)2019年12月13日《每日一题》 化学人教版(选修4)——金属的其他保护方法广东省江门市第二中学2020-2021学年高二上学期第二次考试(学业水平)化学试题
解题方法
8 . 下列生活中常见物质的用途与其还原性或氧化性有关的是
| A.铁粉、碳粉用于“暖宝宝”的发热剂 | B.漂白液、漂粉精用于棉麻的漂白剂 |
| C.氢氧化铝、小苏打用于治疗胃酸过多 | D.N2充入食品袋中用作防腐剂 |
您最近一年使用:0次
9 . 铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:________________________________ 。
铁锈的主要成分是____________ (填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:_____________________ 。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。

①此装置中爱迪生蓄电池的负极是________ (填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是__________ 。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式__________________________ 。
③你认为高铁酸钠作为一种新型净水剂的理由可能是______ 。
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:
铁锈的主要成分是
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O
 Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
①此装置中爱迪生蓄电池的负极是
②写出在用电解法制取高铁酸钠时,阳极的电极反应式
③你认为高铁酸钠作为一种新型净水剂的理由可能是
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
您最近一年使用:0次
2018-03-31更新
|
102次组卷
|
2卷引用:峨山县第一中学2017-2018学年第二学期3月份月考卷(高三理综 化学部分)
解题方法
10 . 下图可设计成多种用途的电化学装置。下列分析正确的是
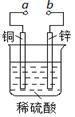

| A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动 |
| B.将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法 |
| C.当a和b用导线连接时,铜片上发生的反应为:2H++2e-=H2↑ |
| D.a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体 |
您最近一年使用:0次
2016-12-09更新
|
437次组卷
|
3卷引用:2015届上海市闵行区高三下学期质量调研考试(二模)化学试卷