1 . 铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式:____________________________ 。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式:__________________ 。
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2,该反应的还原剂是 ;当生成19.2 g Cu时,反应中转移的电子为
6Cu+SO2,该反应的还原剂是 ;当生成19.2 g Cu时,反应中转移的电子为__ mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式:_________________ 。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式:________ 。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6,平均消耗c mol/L的Na2S2O3溶液V mL。则试样中CuSO4·5H2O的质量分数为_______ 。
(1)写出铜与稀硝酸反应的化学方程式:
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式:
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2,该反应的还原剂是 ;当生成19.2 g Cu时,反应中转移的电子为
6Cu+SO2,该反应的还原剂是 ;当生成19.2 g Cu时,反应中转移的电子为(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式:
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式:
您最近一年使用:0次
解题方法
2 . Ⅰ.研究铁的腐蚀,实验步骤如下:
步骤1:将铁粉放置于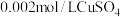 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。
步骤2:向 溶液(用盐酸调至
溶液(用盐酸调至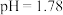 )中加入浸泡过的Fe粉。
)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。_______ 。
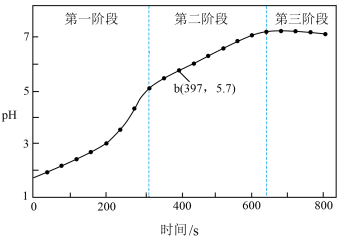
(2)第二、三阶段主要发生吸氧腐蚀。
①析氧腐蚀时Cu上发生的电极反应为_______ 。
②第一阶段和第二阶段发生不同种类腐蚀的主要影响因素是_______ 。
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知: 放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
①镀件Fe应与电源的_______ 相连。
②向 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将 转化为
转化为 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是_______ 。
(4)电镀后的废水中含有 ,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用
,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗 溶液
溶液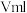 。
。
已知 (无色)
(无色) 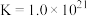
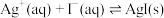 (黄色)
(黄色) 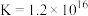
①滴定终点的现象是______________ 。
②废水中 的含量是
的含量是_______ g/L(用含C、V的代数式表示)。
步骤1:将铁粉放置于
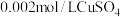 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。步骤2:向
 溶液(用盐酸调至
溶液(用盐酸调至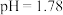 )中加入浸泡过的Fe粉。
)中加入浸泡过的Fe粉。步骤3:采集溶液pH随时间变化的数据。
(2)第二、三阶段主要发生吸氧腐蚀。
①析氧腐蚀时Cu上发生的电极反应为
②第一阶段和第二阶段发生不同种类腐蚀的主要影响因素是
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知:
 放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。①镀件Fe应与电源的
②向
 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将 转化为
转化为 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是(4)电镀后的废水中含有
 ,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用
,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗 溶液
溶液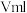 。
。已知
 (无色)
(无色) 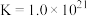
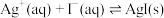 (黄色)
(黄色) 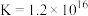
①滴定终点的现象是
②废水中
 的含量是
的含量是
您最近一年使用:0次
名校
解题方法
3 . 下列实验设计不能达到实验目的的是
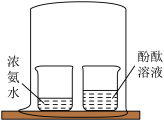 | 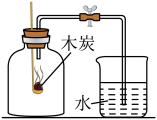 | 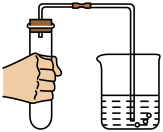 |  |
| 探究分子不断运动 | 测定空气中氧气含量 | 检查装置气密性 | 探究铁生锈条件 |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 金属腐蚀在生活中随处可见,常见的有化学腐蚀和电化学腐蚀.
I.某研究小组为探究弱酸性条件下铁发生电化学腐蚀的类型及腐蚀速率,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞,如图1所示。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计(完成表中空格):
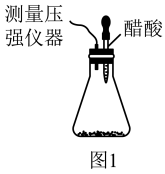
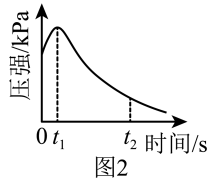
(2)编号①实验测得容器中压强随时间变化如图2。 时,容器中压强明显小于起始压强,其原因是铁发生了
时,容器中压强明显小于起始压强,其原因是铁发生了________________ (填“吸氧”或“析氢”)腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动的方向________ ;此时,炭粉表面发生了________ (填“氧化”或“还原”)反应,其电极反应式是_______ 。
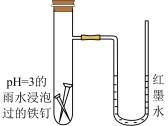
(3)图中U形管左端红墨水柱先下降,一段时间后又上升,请解释开始下降的原因是_______ 。
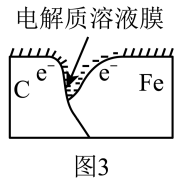
(4)图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
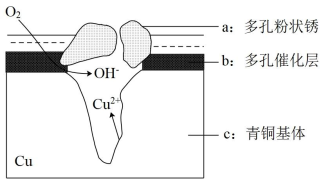
①腐蚀过程中,负极是______ (填“a”“b”或“c”)。
②环境中的 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 ,其离子方程式为
,其离子方程式为____________ 。
I.某研究小组为探究弱酸性条件下铁发生电化学腐蚀的类型及腐蚀速率,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞,如图1所示。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计(完成表中空格):
| 编号 | 实验目的 | 炭粉质量/g | 铁粉质量/g | 醋酸质量分数/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |

(2)编号①实验测得容器中压强随时间变化如图2。
 时,容器中压强明显小于起始压强,其原因是铁发生了
时,容器中压强明显小于起始压强,其原因是铁发生了

(3)图中U形管左端红墨水柱先下降,一段时间后又上升,请解释开始下降的原因是

(4)图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是
②环境中的
 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2022-05-29更新
|
570次组卷
|
5卷引用:山西省吕梁市临县第一中学2021-2022学年高二下学期5月月考化学试题
山西省吕梁市临县第一中学2021-2022学年高二下学期5月月考化学试题(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)4.3 金属的腐蚀与防护-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(15-19)(已下线)考点20 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
5 . 下列说法正确且均与化学反应速率有关的是
①将糕点存放在冰箱里,或在其包装袋中放入生石灰作为脱氧剂,可以延长保质期;
②使用粗锌小颗粒和稀硫酸反应制氢气
③炼铁高炉尾气中,总是存在一定含量CO
④工业上选择400-500°C合成氨
⑤向橡胶中加入硫粉,提高了其强度和韧性和化学稳定性
⑥面粉厂要注意防火,面粉在封闭厂房中扬起悬浮达到一定浓度时,易发生爆炸危险
⑦向门窗合页里注油或在铁制品表面刷油漆来减缓腐蚀速率
⑧汽车的三元催化器中利用铂,铑催化一氧化碳和氮氧化物转化成二氧化碳和氮气
①将糕点存放在冰箱里,或在其包装袋中放入生石灰作为脱氧剂,可以延长保质期;
②使用粗锌小颗粒和稀硫酸反应制氢气
③炼铁高炉尾气中,总是存在一定含量CO
④工业上选择400-500°C合成氨
⑤向橡胶中加入硫粉,提高了其强度和韧性和化学稳定性
⑥面粉厂要注意防火,面粉在封闭厂房中扬起悬浮达到一定浓度时,易发生爆炸危险
⑦向门窗合页里注油或在铁制品表面刷油漆来减缓腐蚀速率
⑧汽车的三元催化器中利用铂,铑催化一氧化碳和氮氧化物转化成二氧化碳和氮气
| A.②④⑥⑧ | B.①④⑥⑦ | C.③④⑤ | D.②⑥⑦ |
您最近一年使用:0次
6 . 铁的腐蚀与防护与生产生活密切相关。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于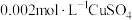 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。
步骤2:向 溶液(用盐酸调
溶液(用盐酸调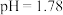 )中加入浸泡过的
)中加入浸泡过的 粉。
粉。
步骤3:采集溶液 随时间变化的数据。
随时间变化的数据。

(1)第一阶段,主要发生析氢腐蚀, 上发生的电极反应为
上发生的电极反应为___________ 。
(2)第二、三阶段主要发生吸氧腐蚀。
①选取b点进行分析,经检验溶液中含有 ,检验
,检验 并与
并与 生成蓝色沉淀的试剂是
生成蓝色沉淀的试剂是___________ (填化学式)。
②取b点溶液向其中滴加 溶液无明显现象,加入稀盐酸后立即变红。写出b点
溶液无明显现象,加入稀盐酸后立即变红。写出b点 被氧化的离子方程式:
被氧化的离子方程式:___________ 。
③第一阶段和第二阶段发生不同种类腐蚀的主要影响因素是___________ 。
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知: 放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
①镀件 应与电源的
应与电源的___________ 相连。
②向 电解液中加入
电解液中加入 溶液,将
溶液,将 转化为
转化为 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是___________ 。
(4)电镀后的废水中含有 ,一种测定其含量的方法是:取废水
,一种测定其含量的方法是:取废水 ,再加
,再加 溶液
溶液 ,用
,用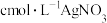 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗 溶液
溶液 。已知:
。已知: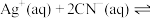
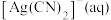 (无色)
(无色) 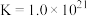 ;
; 。
。
①滴定终点的现象是___________ 。
②废水中 的含量是
的含量是___________  (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于
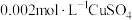 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。步骤2:向
 溶液(用盐酸调
溶液(用盐酸调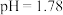 )中加入浸泡过的
)中加入浸泡过的 粉。
粉。步骤3:采集溶液
 随时间变化的数据。
随时间变化的数据。
(1)第一阶段,主要发生析氢腐蚀,
 上发生的电极反应为
上发生的电极反应为(2)第二、三阶段主要发生吸氧腐蚀。
①选取b点进行分析,经检验溶液中含有
 ,检验
,检验 并与
并与 生成蓝色沉淀的试剂是
生成蓝色沉淀的试剂是②取b点溶液向其中滴加
 溶液无明显现象,加入稀盐酸后立即变红。写出b点
溶液无明显现象,加入稀盐酸后立即变红。写出b点 被氧化的离子方程式:
被氧化的离子方程式:③第一阶段和第二阶段发生不同种类腐蚀的主要影响因素是
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知:
 放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。①镀件
 应与电源的
应与电源的②向
 电解液中加入
电解液中加入 溶液,将
溶液,将 转化为
转化为 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是(4)电镀后的废水中含有
 ,一种测定其含量的方法是:取废水
,一种测定其含量的方法是:取废水 ,再加
,再加 溶液
溶液 ,用
,用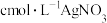 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗 溶液
溶液 。已知:
。已知: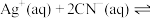
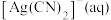 (无色)
(无色) 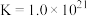 ;
; 。
。①滴定终点的现象是
②废水中
 的含量是
的含量是 (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
您最近一年使用:0次
7 . 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。下列说法不正确 的是
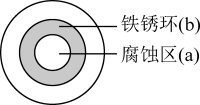

| A.铁片腐蚀过程最终生成的铁锈为Fe2O3·xH2O |
| B.液滴之下氧气含量少,铁片作负极,发生的氧化反应为:Fe-2e—=Fe2+ |
| C.液滴边缘是正极区,发生的电极反应为:O2+H2O+4e—=4OH— |
| D.铁片腐蚀最严重区域是生锈最多的区域 |
您最近一年使用:0次
解题方法
8 . I.如图为电化学原理在防止金属腐蚀方面的应用。
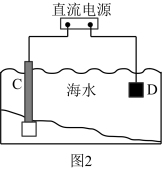
(1)图1中为了减缓海水对钢闸门A的腐蚀,材料B可以选择____ (填字母)
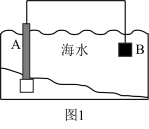
A.碳棒 B.锌板 C.铜板
(2)图2中,钢闸门C作____ 极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为____ ,检测该电极反应产物的方法是____ 。
II.已知:Ksp[Fe(OH)2]=8×10−16,Ksp[Fe(OH)3]=1×10−38,Ksp[Zn(OH)2]=4×10−17,Ksp(AgCl)=2×10−10,Ksp[Ag2CrO4(砖红色)]=2×10−12。回答下列问题:
(3)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是____ (填化学式)。常温下,若使0.4 mol∙L−1的ZnCl2溶液中的Zn2+开始沉淀,应加入NaOH溶液调整溶液的pH为____ 。
(4)要除去ZnCl2酸性溶液中混有的少量Fe2+,应先向混合溶液中加入适量____ 溶液,再加入____ (填下列选项序号)调节溶液的pH,最后过滤。
A.NH3·H2O B.Na2CO3 C.ZnO D.ZnCO3
(5)分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定终点的现象是____ ,当溶液中Cl-恰好完全沉淀(浓度为1.0×10−6 mol∙L−1)时,此时溶液中c(CrO )=
)=____ mol·L−1。
(1)图1中为了减缓海水对钢闸门A的腐蚀,材料B可以选择

A.碳棒 B.锌板 C.铜板
(2)图2中,钢闸门C作

II.已知:Ksp[Fe(OH)2]=8×10−16,Ksp[Fe(OH)3]=1×10−38,Ksp[Zn(OH)2]=4×10−17,Ksp(AgCl)=2×10−10,Ksp[Ag2CrO4(砖红色)]=2×10−12。回答下列问题:
(3)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是
(4)要除去ZnCl2酸性溶液中混有的少量Fe2+,应先向混合溶液中加入适量
A.NH3·H2O B.Na2CO3 C.ZnO D.ZnCO3
(5)分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定终点的现象是
 )=
)=
您最近一年使用:0次
9 . 化学与生活密切相关,下列有关说法错误的是
| A.新能源汽车的推广与使用,有助于减少光化学烟雾的产生 |
| B.服用铬含量超标的药用胶囊会对人体健康造成危害 |
| C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| D.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化 |
您最近一年使用:0次
2022-06-03更新
|
302次组卷
|
2卷引用:福建省福州第一中学2022届高三下学期模拟考试化学试题
名校
10 . 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后,发现液滴覆盖的圆周中心区(a)已被腐蚀变暗,在液滴外沿出现棕色铁锈环(b),如图所示。下列说法不正确的是
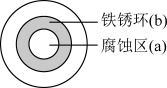

| A.铁锈环的主要成分是Fe2O3·xH2O |
| B.液滴之下氧气含量少,铁片作负极,发生的还原反应为Fe−2e-=Fe2+ |
| C.液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- |
| D.铁片腐蚀最严重的区域不是生锈最多的区域 |
您最近一年使用:0次
2022-04-22更新
|
145次组卷
|
2卷引用:河北省泊头市第一中学2021-2022学年高一下学期第一次月考化学试题



